磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应制取少量的SO2Cl2,装置如下图所示(有些夹持装置省略)。已知SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,遇水能发生剧烈的水解反应,并产生白雾。
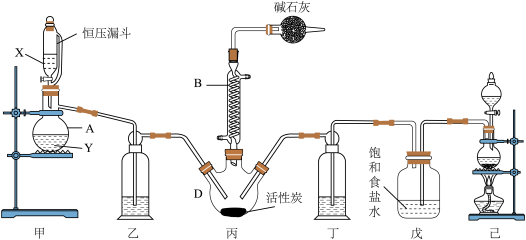
(1)单独检验己装置气密性的方法是:_______ 。
(2)由仪器B的使用可知SO2与Cl2反应的ΔH_______ 0(填“>”或“<”),仪器C的作用是_______ 。
(3)试剂X、Y的组合最好是________ 。
a.18.4 mol/L H2SO4+Cu b.4 mol/L HNO3+Na2SO3 c.60% H2SO4+K2SO3
(4)反应结束后,将丙中产物分离的实验操作是_______ 。
(5)分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静止得到无色溶液w。
①写出该反应的离子方程式:________ ;
②检验溶液w中存在Cl-的方法是________ 。
(6)SO2Cl2可以作为锂离子电池的正极活性材质,已知电池反应为:2Li+SO2Cl2=2LiCl +SO2↑。则电池工作时,正极的电极反应式为_________ 。

(1)单独检验己装置气密性的方法是:
(2)由仪器B的使用可知SO2与Cl2反应的ΔH
(3)试剂X、Y的组合最好是
a.18.4 mol/L H2SO4+Cu b.4 mol/L HNO3+Na2SO3 c.60% H2SO4+K2SO3
(4)反应结束后,将丙中产物分离的实验操作是
(5)分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静止得到无色溶液w。
①写出该反应的离子方程式:
②检验溶液w中存在Cl-的方法是
(6)SO2Cl2可以作为锂离子电池的正极活性材质,已知电池反应为:2Li+SO2Cl2=2LiCl +SO2↑。则电池工作时,正极的电极反应式为
更新时间:2017-04-09 16:34:15
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】回答下列问题:
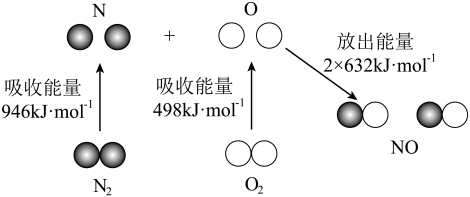
(1)根据如图所示的 和
和 反应生成
反应生成 过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中
过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中_______ (填“吸收”或“放出”)的能量为_______ kJ。
(2)在5L密闭容器内,800℃时发生反应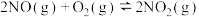 ,
, 随时间变化如下表:
随时间变化如下表:
①0~2s内,用 表示该反应的反应速率为
表示该反应的反应速率为_______  。
。
②下列措施能够使该反应的反应速率加快的是_______ (填字母)。
a.降低温度 b.使用合适的催化剂 c.减小压强(扩大容器容积)
(3) 、
、 和熔融
和熔融 可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的
可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的 。
。
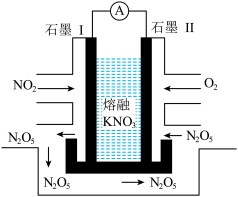
①放电时,该电池的负极是_______ (填“石墨Ⅰ”或“石墨Ⅱ”)。
②若电路中有2mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的
_______ L。
(1)根据如图所示的
 和
和 反应生成
反应生成 过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中
过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中
(2)在5L密闭容器内,800℃时发生反应
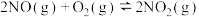 ,
, 随时间变化如下表:
随时间变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
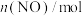 | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
①0~2s内,用
 表示该反应的反应速率为
表示该反应的反应速率为 。
。②下列措施能够使该反应的反应速率加快的是
a.降低温度 b.使用合适的催化剂 c.减小压强(扩大容器容积)
(3)
 、
、 和熔融
和熔融 可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的
可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的 。
。
①放电时,该电池的负极是
②若电路中有2mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】甲醇是性能优良的能源和车用燃料。
(1)工业上可用一氧化碳和氢气在催化剂作用下合成甲醇,研究该反应可能的历程,其中吸附在催化剂表面上的物种用*标注,该历程能量变化如图所示:

可知该历程的
_______ 0(填“大于”“等于”或“小于”),其中决速步骤的能垒为_______ eV,虚线框内最有可能发生的反应的化学方程式为_______ 。
(2)已知 (g)、CO(g)的燃烧热分别是
(g)、CO(g)的燃烧热分别是 和
和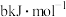 (a、b均小于0),
(a、b均小于0),
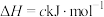 。则反应
。则反应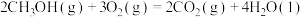 的
的
_______  。
。
(3)如图是碱性甲醇燃料电池。a电极发生的电极反应式是_______ 。标准状况下,当电路中累计有2mol电子通过时,消耗的氧气体积至少为_______ L。
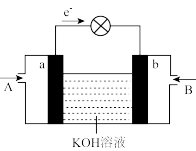
(1)工业上可用一氧化碳和氢气在催化剂作用下合成甲醇,研究该反应可能的历程,其中吸附在催化剂表面上的物种用*标注,该历程能量变化如图所示:

可知该历程的

(2)已知
 (g)、CO(g)的燃烧热分别是
(g)、CO(g)的燃烧热分别是 和
和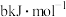 (a、b均小于0),
(a、b均小于0),
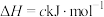 。则反应
。则反应 的
的
 。
。(3)如图是碱性甲醇燃料电池。a电极发生的电极反应式是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】原电池电极方程式的书写
I.氢氧燃料电池 氢氧燃烧电池是一种高效低污染的新型电池,主要用于航天领域。它的电极材料一般为活化电极,具有很强的催化活性,如铂电极、活性炭电极等。
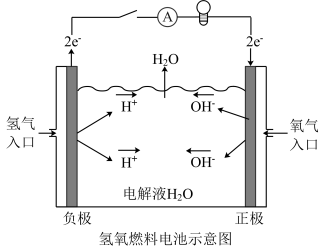
(1)电解质溶液为40%的KOH溶液。电极反应为:
负极:_______
正极:_______
电池的总反应式为:_______
(2)电解质溶液为H2SO4溶液。电极反应为:
负极:_______
正极:_______
电池的总反应式为:_______
(3)电解质溶液为Na2SO4溶液。电极反应为:
负极:_______
正极:_______
电池的总反应式为:_______
II.甲烷燃料电池 该电池用金属铂片插入KOH溶液中作电极,又在两极上分别通甲烷和氧气。
(4)电极反应式为:
负极:_______
正极:_______
电池总反应为:_______ 。
电池工作时,KOH被_______ ,溶液pH值_______ 。
I.氢氧燃料电池 氢氧燃烧电池是一种高效低污染的新型电池,主要用于航天领域。它的电极材料一般为活化电极,具有很强的催化活性,如铂电极、活性炭电极等。

(1)电解质溶液为40%的KOH溶液。电极反应为:
负极:
正极:
电池的总反应式为:
(2)电解质溶液为H2SO4溶液。电极反应为:
负极:
正极:
电池的总反应式为:
(3)电解质溶液为Na2SO4溶液。电极反应为:
负极:
正极:
电池的总反应式为:
II.甲烷燃料电池 该电池用金属铂片插入KOH溶液中作电极,又在两极上分别通甲烷和氧气。
(4)电极反应式为:
负极:
正极:
电池总反应为:
电池工作时,KOH被
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】乙酰苯胺为无色晶体,具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。实验室常用苯胺与乙酸反应制备乙酰苯胺:
 +CH3COOH
+CH3COOH
 +H2O
+H2O
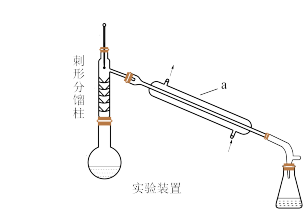
相关的文献数据如下:
实验流程如下:
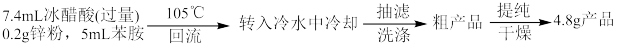
据此回答下列问题:
(1)实验装置中仪器a的名称_________ ,圆底烧瓶中加入少许锌粉目的是_______ ,锥形瓶中蒸馏物主要成分是_______ (填化学式)。
(2)反应需控制温度在105℃左右的原因是_______ ,判断反应已基本完全的依据是_______ 。
(3)粗产品中所含有机杂质主要为_______ ,进一步提纯的实验方法为_______ ,证明提纯后的产品为乙酰苯胺的简单实验方法为_______ 。
(4)计算所得到乙酰苯胺的产率是_______ 。
 +CH3COOH
+CH3COOH
 +H2O
+H2O
相关的文献数据如下:
| 物质 | 密度g/ml | 熔点℃ | 沸点℃ | 溶解性 |
| 冰醋酸 | 1.05 | 16.6 | 118 | 易溶于水 |
| 苯胺 | 1.02 | -6 | 184.4 | 微溶于水,易氧化 |
| 乙酰苯胺 | 1.21 | 114.3 | 305 | 微溶于冷水,易溶于热水 |
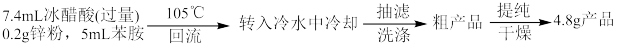
据此回答下列问题:
(1)实验装置中仪器a的名称
(2)反应需控制温度在105℃左右的原因是
(3)粗产品中所含有机杂质主要为
(4)计算所得到乙酰苯胺的产率是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】氨气与灼热的氧化铜反应生成铜、氮气和水。利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题。

(1)盛放浓氨水的仪器名称为_______ 。
(2)若撤去装置B会产生的安全隐患是_______ 。
(3)写出氨气与氧化铜反应的化学方程式_______ 。
(4)待实验完毕后,若实验测得 的体积(折算成标准状况)为
的体积(折算成标准状况)为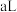 ,则被还原的氧化铜的物质的量为
,则被还原的氧化铜的物质的量为_______  ,若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为
,若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为_______ (用含a、b字母的代数式表示)
(5)量气管G读数时除了视线与凹液面最低点保持水平外,还需要注意_______ 。调节G过程中,G中的液面_______ (填“上升”“不变”“下降”)。

(1)盛放浓氨水的仪器名称为
(2)若撤去装置B会产生的安全隐患是
(3)写出氨气与氧化铜反应的化学方程式
(4)待实验完毕后,若实验测得
 的体积(折算成标准状况)为
的体积(折算成标准状况)为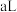 ,则被还原的氧化铜的物质的量为
,则被还原的氧化铜的物质的量为 ,若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为
,若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为(5)量气管G读数时除了视线与凹液面最低点保持水平外,还需要注意
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】实验室可用乙酸和乙醇为原料制备乙酸乙酯,制备装置如图所示(夹持和加热装置已省略)。
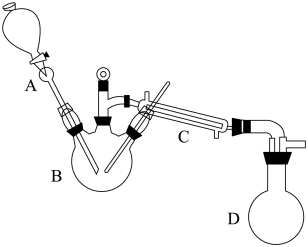
I.在三颈烧瓶中加入适量的乙醇,再缓慢加入浓硫酸,使其混合均好实验仪器。
II.通过仪器A向三颈烧瓶中加入乙醇和冰醋酸的混合液,小火加热至110~120℃,控制A中液体的滴速和馏出速率大致相等,滴加完毕后,继续加热15分钟。
III.依次用饱和 溶液、饱和食盐水和饱和
溶液、饱和食盐水和饱和 溶液洗涤馏出液。
溶液洗涤馏出液。
IV.分液,向分液后的有机层中加入无水氯化镁,静置,过滤除去氯化镁固体,进一步蒸馏纯化,收集馏分。
回答下列问题:
(1)冷水从C仪器___________ (填“上”或“下”)口进。
(2)若反应中使用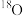 标注的乙醇
标注的乙醇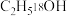 ,请写出冰醋酸
,请写出冰醋酸 与乙醇
与乙醇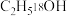 的反应
的反应___________
(3)上述有机反应的类型:___________
(4)为了减少产物的挥发,可以对仪器D采取的措施是___________ 。
(5)选用饱和 溶液洗涤的作用:
溶液洗涤的作用:___________
(6)用饱和 溶液洗涤的有关离子方程式为
溶液洗涤的有关离子方程式为___________ 。
(7)用 溶液洗涤除去乙醇之前,先要用饱和食盐水洗涤,原因是
溶液洗涤除去乙醇之前,先要用饱和食盐水洗涤,原因是___________ 。
(8)加入无水氯化镁的作用是___________ 。

I.在三颈烧瓶中加入适量的乙醇,再缓慢加入浓硫酸,使其混合均好实验仪器。
II.通过仪器A向三颈烧瓶中加入乙醇和冰醋酸的混合液,小火加热至110~120℃,控制A中液体的滴速和馏出速率大致相等,滴加完毕后,继续加热15分钟。
III.依次用饱和
 溶液、饱和食盐水和饱和
溶液、饱和食盐水和饱和 溶液洗涤馏出液。
溶液洗涤馏出液。IV.分液,向分液后的有机层中加入无水氯化镁,静置,过滤除去氯化镁固体,进一步蒸馏纯化,收集馏分。
回答下列问题:
(1)冷水从C仪器
(2)若反应中使用
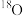 标注的乙醇
标注的乙醇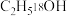 ,请写出冰醋酸
,请写出冰醋酸 与乙醇
与乙醇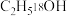 的反应
的反应(3)上述有机反应的类型:
(4)为了减少产物的挥发,可以对仪器D采取的措施是
(5)选用饱和
 溶液洗涤的作用:
溶液洗涤的作用:(6)用饱和
 溶液洗涤的有关离子方程式为
溶液洗涤的有关离子方程式为(7)用
 溶液洗涤除去乙醇之前,先要用饱和食盐水洗涤,原因是
溶液洗涤除去乙醇之前,先要用饱和食盐水洗涤,原因是(8)加入无水氯化镁的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
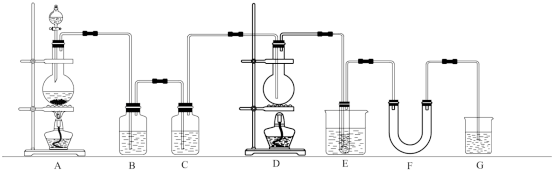
【推荐1】SnCl4是无色液体,沸点114.1℃,遇潮湿空气水解而生成SnO2和氯化氢。实验室利用下列装置可以制备无水SnCl4:
回答下列问题:
(1)本试验中检查制气装置A气密性的方法是_______ 。
(2)装置A中用浓盐酸的原因是①增强 的氧化性②增强
的氧化性②增强 的还原性,在发应后的固液混合物中加入
的还原性,在发应后的固液混合物中加入_______ 有氯气产生,证明①正确的,在发应后固液的混合物中加入_______ 有氯气产生,证明②正确的。
(3)实验过程中若发现B、C装置少量漏气,可采取的措施是_______ 。
(4)C的作用是_______ 。
(5)F中可装的试剂可以是_______ 。
a. b.
b. c.浓硫酸 d.
c.浓硫酸 d.
(6)制备反应停止熄灭酒精灯后,将G中导管移出溶液并使导管口靠近液面,装置冷却,之后的操作是_______ ,清洗仪器,摆放整齐,擦干净桌面。

回答下列问题:
(1)本试验中检查制气装置A气密性的方法是
(2)装置A中用浓盐酸的原因是①增强
 的氧化性②增强
的氧化性②增强 的还原性,在发应后的固液混合物中加入
的还原性,在发应后的固液混合物中加入(3)实验过程中若发现B、C装置少量漏气,可采取的措施是
(4)C的作用是
(5)F中可装的试剂可以是
a.
 b.
b. c.浓硫酸 d.
c.浓硫酸 d.
(6)制备反应停止熄灭酒精灯后,将G中导管移出溶液并使导管口靠近液面,装置冷却,之后的操作是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】用如图测定常温下1molO2的体积。
提供试剂:二氧化锰、过氧化氢溶液。
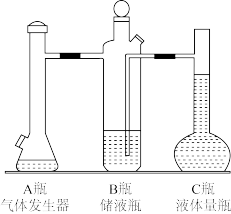
(1)气体发生器A中预先盛放的试剂是____ ,用注射器向A中注入的试剂是____ 。
(2)已知常温下O2摩尔体积为24.0L/mol,液体量瓶C的刻度范围是110-130mL,过氧化氢溶液取10.0mL,则H2O2溶液浓度(mol/L)范围可能是____ (保留三位有效数字)。
(3)现取0.90mol/L的过氧化氢溶液10.0mL,完全反应后且恢复室温,量瓶C中的读数为120.0mL,为保证储液瓶B的导管内外液面相平,又抽出了1.00mL气体,则室温下1mol氧气体积的测定值是____ L(保留三位有效数字)。
提供试剂:二氧化锰、过氧化氢溶液。

(1)气体发生器A中预先盛放的试剂是
(2)已知常温下O2摩尔体积为24.0L/mol,液体量瓶C的刻度范围是110-130mL,过氧化氢溶液取10.0mL,则H2O2溶液浓度(mol/L)范围可能是
(3)现取0.90mol/L的过氧化氢溶液10.0mL,完全反应后且恢复室温,量瓶C中的读数为120.0mL,为保证储液瓶B的导管内外液面相平,又抽出了1.00mL气体,则室温下1mol氧气体积的测定值是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】2-硝基-1,3-苯二酚(常温下为橙红色固体)由间苯二酚先磺化,再硝化,后去磺酸基生成。原理如图: 间苯二酚,碾成粉末放入三颈烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内
间苯二酚,碾成粉末放入三颈烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内 (如图1,已省略加热装置),步骤中发生反应的化学方程式为
(如图1,已省略加热装置),步骤中发生反应的化学方程式为___________ 。酚羟基邻对位的氢原子比较活泼,均易被取代,请分析第一步磺化引入磺酸基基团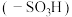 的作用是
的作用是___________ 。 。制取“混酸”的具体操作是
。制取“混酸”的具体操作是___________ 。
(3)蒸馏:将硝化反应混合物的稀释液转移到圆底烧瓶 中,然后用图2所示装置进行水蒸气蒸馏,过程中生成的2-硝基-1,3-苯二酚可随水蒸气一起被蒸馏出来。烧瓶
中,然后用图2所示装置进行水蒸气蒸馏,过程中生成的2-硝基-1,3-苯二酚可随水蒸气一起被蒸馏出来。烧瓶 中长玻璃管的作用是
中长玻璃管的作用是___________ 。图2装置中存在仪器使用错误是___________ 。蒸馏结束后正确的操作顺序为___________ (填序号)。
①熄灭酒精灯 ②打开旋塞 ③停止通冷凝水___________ ,通过重结晶的方法提纯粗品最终获得 纯净的橙红色晶体,则产品的产率为
纯净的橙红色晶体,则产品的产率为___________  (保留2位有效数字)
(保留2位有效数字)

 间苯二酚,碾成粉末放入三颈烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内
间苯二酚,碾成粉末放入三颈烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内 (如图1,已省略加热装置),步骤中发生反应的化学方程式为
(如图1,已省略加热装置),步骤中发生反应的化学方程式为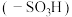 的作用是
的作用是
 。制取“混酸”的具体操作是
。制取“混酸”的具体操作是(3)蒸馏:将硝化反应混合物的稀释液转移到圆底烧瓶
 中,然后用图2所示装置进行水蒸气蒸馏,过程中生成的2-硝基-1,3-苯二酚可随水蒸气一起被蒸馏出来。烧瓶
中,然后用图2所示装置进行水蒸气蒸馏,过程中生成的2-硝基-1,3-苯二酚可随水蒸气一起被蒸馏出来。烧瓶 中长玻璃管的作用是
中长玻璃管的作用是①熄灭酒精灯 ②打开旋塞 ③停止通冷凝水

 纯净的橙红色晶体,则产品的产率为
纯净的橙红色晶体,则产品的产率为 (保留2位有效数字)
(保留2位有效数字)
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】有一包固体粉末,可能含有下列阳离子或阴离子中的若干种:K+、NH4+、Fe3+、Cu2+、Mg2+、Cl-、SO42-。现做以下实验:
(1)取少量固体,加适量蒸馏水,搅拌后固体全部溶解,得到无色透明溶液;
(2)在混合溶液中加入浓NaOH溶液并加热无现象;
(3)向混合溶液中滴入Ba(NO3)2溶液,无沉淀产生。再滴入AgNO3溶液生成白色沉淀;
(4)用铂丝蘸取少量粉末放在火焰上灼烧,透过蓝色钴玻璃观察时,火焰呈紫色。
试根据以上实验现象判断:
这包白色粉末一定含有的离子是_______________ ;一定不含有的离子是__________________________ ;并写出参加反应的离子方程式是:____________________
(1)取少量固体,加适量蒸馏水,搅拌后固体全部溶解,得到无色透明溶液;
(2)在混合溶液中加入浓NaOH溶液并加热无现象;
(3)向混合溶液中滴入Ba(NO3)2溶液,无沉淀产生。再滴入AgNO3溶液生成白色沉淀;
(4)用铂丝蘸取少量粉末放在火焰上灼烧,透过蓝色钴玻璃观察时,火焰呈紫色。
试根据以上实验现象判断:
这包白色粉末一定含有的离子是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】味精的鲜味物质是谷氨酸钠,杂质主要是氯化钠。某学生欲测定味精中食盐的含量。
(1)下面是该学生所做的有关实验,请补写缺失的实验步骤②和④。
①称取某品牌的袋装味精样品5.0g,并溶于蒸馏水;
②___________________________________________________________________
③过滤;
④____________________________________________________________________
⑤将沉淀烘干、称量,测得固体质量为2.9g。
(2)根据上述实验步骤回答下列有关问题:
①过滤操作所需要的玻璃仪器有____________________________________________
②验沉淀是否洗净的方法是_____________________________________________
③若味精包装上标注“谷氨酸钠含量≥80%,NaCl含量≤20%”,问此样品是否符合产品标注的质量分数?________________ (填“符合”或“不符合”)。
(3)若有甲、乙两学生分别做了这个实验,甲学生认真地做了一次实验,就取得了实验数据,而乙学生认真地做了两次实验,取两次数据的平均值作为实验的测定数据,你认为_____ 学生的方法更合理(填“甲”或“乙”)。
(1)下面是该学生所做的有关实验,请补写缺失的实验步骤②和④。
①称取某品牌的袋装味精样品5.0g,并溶于蒸馏水;
②
③过滤;
④
⑤将沉淀烘干、称量,测得固体质量为2.9g。
(2)根据上述实验步骤回答下列有关问题:
①过滤操作所需要的玻璃仪器有
②验沉淀是否洗净的方法是
③若味精包装上标注“谷氨酸钠含量≥80%,NaCl含量≤20%”,问此样品是否符合产品标注的质量分数?
(3)若有甲、乙两学生分别做了这个实验,甲学生认真地做了一次实验,就取得了实验数据,而乙学生认真地做了两次实验,取两次数据的平均值作为实验的测定数据,你认为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】燃煤火电厂产生的尾气(主要成分为 、NO)可以按如图所示流程脱除或利用。
、NO)可以按如图所示流程脱除或利用。
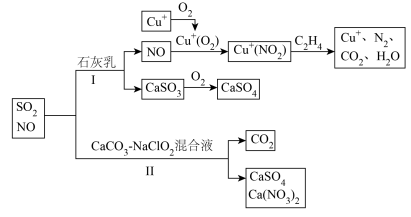
(1)写出途径Ⅰ中 转化成
转化成 的总反应化学方程式:
的总反应化学方程式:___________ 。
(2)途径Ⅰ中 的作用是
的作用是___________ ,途径Ⅰ中 的作用是
的作用是___________ 。
(3)写出途径Ⅱ中 与
与 、
、 混合液反应的化学方程式:
混合液反应的化学方程式:________ 。
(4)下列物质有可能代替途径Ⅱ中 的是______(填序号)。
的是______(填序号)。
(5)设计实验验证固体 有还原性(可供选择的试剂有:酸性
有还原性(可供选择的试剂有:酸性 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液)
溶液)____ ;写出实验过程中涉及的离子反应方程式:________ 。
 、NO)可以按如图所示流程脱除或利用。
、NO)可以按如图所示流程脱除或利用。
(1)写出途径Ⅰ中
 转化成
转化成 的总反应化学方程式:
的总反应化学方程式:(2)途径Ⅰ中
 的作用是
的作用是 的作用是
的作用是(3)写出途径Ⅱ中
 与
与 、
、 混合液反应的化学方程式:
混合液反应的化学方程式:(4)下列物质有可能代替途径Ⅱ中
 的是______(填序号)。
的是______(填序号)。A. | B. | C. | D. |
(5)设计实验验证固体
 有还原性(可供选择的试剂有:酸性
有还原性(可供选择的试剂有:酸性 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液)
溶液)
您最近一年使用:0次



