(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号 填入相应的空格中。
①ⅡA族元素的最外层电子数__________ 。
②第三周期元素的最高正价__________ 。
③F-、Na+、Mg2+、Al3+的离子半径__________ 。
(2)用A+、B-、C2-、D分别表示含有18电子的4种微粒(离子或分子)
①A+、B-、C2-半径由大到小顺序为__________ 。(填离子符号)
②D分子中含有4个原子,其电子式是______ 。

①ⅡA族元素的最外层电子数
②第三周期元素的最高正价
③F-、Na+、Mg2+、Al3+的离子半径
(2)用A+、B-、C2-、D分别表示含有18电子的4种微粒(离子或分子)
①A+、B-、C2-半径由大到小顺序为
②D分子中含有4个原子,其电子式是
更新时间:2017-05-09 04:20:14
|
【知识点】 元素周期律的应用
相似题推荐
填空题
|
适中
(0.65)
【推荐1】A、B、C、D、E五种短周期元素,原子序数依次增大,其中只有C为金属元素。A、C原子序数之和等于E的原子序数,D与B同主族且D原子序数是B原子序数的2倍。AB2和DB2溶于水得到酸性溶液,C2D溶于水得到碱性溶液。
(1)E元素在周期表中的位置为_____ ;工业上制取C单质的化学方程式为______ 。
(2)A的最低负价氢化物的空间构型为____ ;C、D、E的简单离子的离子半径由大到小的顺序是_____ (用离子符号表示)。
(3)在低温下,将E的单质通入饱和NaHCO3溶液中,反应后得到一种微绿色气体E2B、CE和另外一种无色气体。则该反应中E2B、CE这两种产物的物质的量之比n(E2B):n(CE)=_______ 。已知E2B溶于水生成一种具有漂白性的弱酸,该弱酸分子的结构式为__________ 。
(4)化合物C2 D3中,各原子(或离子)最外层均达到8电子稳定结构,则C2D3的电子式为_________ ,该化合物的水溶液在空气中久置后变质,生成一种单质,所得溶液呈强碱性,用化学方程式表示这一变化过程__________ 。
(1)E元素在周期表中的位置为
(2)A的最低负价氢化物的空间构型为
(3)在低温下,将E的单质通入饱和NaHCO3溶液中,反应后得到一种微绿色气体E2B、CE和另外一种无色气体。则该反应中E2B、CE这两种产物的物质的量之比n(E2B):n(CE)=
(4)化合物C2 D3中,各原子(或离子)最外层均达到8电子稳定结构,则C2D3的电子式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】如图是元素周期表的一部分。回答下列问题:
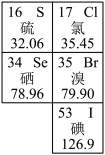
硒是人体必需的微量元素。
(1)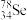 与
与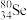 互称为
互称为___________ 。
(2)硒元素的气态氢化物的化学式为___________ 。
(3) 溶于水生成
溶于水生成 ,向所得溶液中通入
,向所得溶液中通入 气体发生反应,生成硒单质和
气体发生反应,生成硒单质和 ,写出
,写出 与
与 反应的化学方程式:
反应的化学方程式:___________
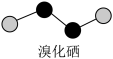
(4)溴化硒是一种重要的电子元件材料,其分子的球棍模型如下图所示。下列说法正确的是___________(填字母)。

硒是人体必需的微量元素。
(1)
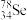 与
与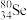 互称为
互称为(2)硒元素的气态氢化物的化学式为
(3)
 溶于水生成
溶于水生成 ,向所得溶液中通入
,向所得溶液中通入 气体发生反应,生成硒单质和
气体发生反应,生成硒单质和 ,写出
,写出 与
与 反应的化学方程式:
反应的化学方程式:(4)溴化硒是一种重要的电子元件材料,其分子的球棍模型如下图所示。下列说法正确的是___________(填字母)。

| A.溴化硒属于离子化合物 | B.原子半径: |
C. 元素的非金属性比 元素的非金属性比 的强 的强 | D.溴化硒的相对分子质量为317.72 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也”。青金石的化学组成可表示为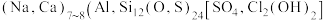 。回答下列问题:
。回答下列问题:
(1)硅在元素周期表中的位置是_______ ;铝离子的结构示意图为_______ 。
(2) 的电子式为
的电子式为_______ , 的结构式为
的结构式为_______ 。写出一种由青金石中非金属元素组成的既含有极性键又含有非极性键的物质的分子式_______ 。
(3)青金石所含的短周期元素中,金属性最强的是_______ ,非金属元素原子半径由大到小的顺序为_______ 。
(4)Be与Al的化学性质相似,则Be与NaOH溶液反应的化学方程式是_______ 。
(5)下列不能说明氯元素的非金属性比硫元素强的是_______(填字母)。
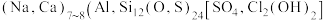 。回答下列问题:
。回答下列问题:(1)硅在元素周期表中的位置是
(2)
 的电子式为
的电子式为 的结构式为
的结构式为(3)青金石所含的短周期元素中,金属性最强的是
(4)Be与Al的化学性质相似,则Be与NaOH溶液反应的化学方程式是
(5)下列不能说明氯元素的非金属性比硫元素强的是_______(填字母)。
| A.氯、硫的最低负价分别为-1、-2 |
| B.硫化氢在300℃时开始分解,HCl在1500℃时开始缓慢分解 |
C. 的酸性比 的酸性比 的强 的强 |
D.向 水溶液中通入 水溶液中通入 有淡黄色沉淀生成 有淡黄色沉淀生成 |
您最近一年使用:0次



