勒夏特列原理在生产生活中有许多重要应用。
(1)实验室配制FeCl3溶液时,将FeCl3溶解在盐酸中,目的是防止______________ 。
(2)石蕊(用HZ表示)试液中存在的电离平衡HZ(红色) H++Z-(蓝色)。在中性溶液中,石蕊试液呈
H++Z-(蓝色)。在中性溶液中,石蕊试液呈______ 色;要使石蕊试液呈红色,可加入______ 。
(1)实验室配制FeCl3溶液时,将FeCl3溶解在盐酸中,目的是防止
(2)石蕊(用HZ表示)试液中存在的电离平衡HZ(红色)
 H++Z-(蓝色)。在中性溶液中,石蕊试液呈
H++Z-(蓝色)。在中性溶液中,石蕊试液呈
更新时间:2017-09-09 20:24:03
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
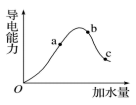
(1)a、b、c三点溶液酸性由强到弱的顺序为___________ 。
(2)若使c点溶液中的 c(CH3COO−) 提高,在如下措施中,不可选择的是______ (填字母,下同)。A.加热 B.加很稀的 NaOH 溶液 C.加固体 KOH D.加水 E.加固体 CH3COONa F.加 Zn 粒
(3)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是___________。

(1)a、b、c三点溶液酸性由强到弱的顺序为
(2)若使c点溶液中的 c(CH3COO−) 提高,在如下措施中,不可选择的是
(3)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是___________。
A. |
B. 个数 个数 |
C. 分子数 分子数 |
D. |
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】(1)内因:___________________ 。
(2)外因:①浓度:_________________________
②温度:________________________________________
③酸碱度
(3)酸式盐溶液的酸碱性:强酸酸式盐显__________ ,原因是_____________________________ 。多元弱酸酸式盐溶液的酸碱性取决于_____________________________________ ,例如NaHCO3溶液显碱性,原因是_________________ ,_______________________________ (离子方程式和文字说明);
NaHSO3溶液显酸性的原因是________________ ,_____________________ (离子方程式和文字说明)。
(4)用↑、↓、→、←表示,填表:CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-_______________
(2)外因:①浓度:
②温度:
③酸碱度
(3)酸式盐溶液的酸碱性:强酸酸式盐显
NaHSO3溶液显酸性的原因是
(4)用↑、↓、→、←表示,填表:CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O
 CH3COOH+OH-
CH3COOH+OH-| 改变条件 | 平衡移动 | c(CH3COO-) | c(OH-) | 水解 |
| 加入CH3COONa | ||||
| 通入HCl | ||||
| 升温 | ||||
| 加水 | ||||
| 加NaOH | ||||
| 加HAc | ||||
| 加NH4Cl |
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】(1)氨水中存在:NH3·H2O
 +OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。
+OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。
按照要求填空(答案选填物质对应的字母):
①电离平衡会向正向移动是_________ ,电离平衡会向逆向移动是__________ 。
②c( )、c(OH-)都增大的是
)、c(OH-)都增大的是___________ ,c( )、c(OH-)都变小的是
)、c(OH-)都变小的是___________ 。
③c( )增大,c(OH-)减小的是
)增大,c(OH-)减小的是___________ 。
④c( )减小,c(OH-)增大的是
)减小,c(OH-)增大的是___________ 。
(2)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为_________ ,若此温度下醋酸的电离常数K=1×10−5,pH为______ ,若升高温度, K将___________ (填“变大”、“变小”或“不变”)。
(3)Ⅰ、现有浓度均为0.1 mol∙L−1的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①若三种溶液中c(H+)分别为a mol∙L−1、b mol∙L−1、c mol∙L−1,则它们的大小关系为__________ 。
②等体积的以上三种酸分别与过量的NaOH溶液反应,若生成的盐的物质的量依次为A mol、B mol、C mol,则它们的大小关系为__________ 。
Ⅱ、现有pH=3的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、V3,其大小关系为________________ 。
②分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为____________ 。

 +OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。
+OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。按照要求填空(答案选填物质对应的字母):
①电离平衡会向正向移动是
②c(
 )、c(OH-)都增大的是
)、c(OH-)都增大的是 )、c(OH-)都变小的是
)、c(OH-)都变小的是③c(
 )增大,c(OH-)减小的是
)增大,c(OH-)减小的是④c(
 )减小,c(OH-)增大的是
)减小,c(OH-)增大的是(2)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为
(3)Ⅰ、现有浓度均为0.1 mol∙L−1的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①若三种溶液中c(H+)分别为a mol∙L−1、b mol∙L−1、c mol∙L−1,则它们的大小关系为
②等体积的以上三种酸分别与过量的NaOH溶液反应,若生成的盐的物质的量依次为A mol、B mol、C mol,则它们的大小关系为
Ⅱ、现有pH=3的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、V3,其大小关系为
②分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】(1)在配制FeCl3、Al(NO3)3、CuSO4、SnCl2等溶液时,为防止水解,常先将盐溶于少量__________ 中,再加蒸馏水稀释到所需浓度,原因是__________ 。
(2)Na2SiO3、Na2CO3、NaAlO2等碱性溶液不能贮存在__________ 塞的试剂瓶中,原因是__________ 。
(2)Na2SiO3、Na2CO3、NaAlO2等碱性溶液不能贮存在
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】按要求回答下列问题:
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因_______ 。
(2)已知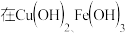 浓度相同的溶液中,其pH如下:
浓度相同的溶液中,其pH如下:
①若向该溶液中滴加NaOH溶液,则先沉淀的是_______ (填氢氧化物化学式)。
②如何除去氯化铜溶液中混有少量的氯化铁_______ 。
③若使氢氧化铁完全沉淀,氢氧化铜不产生沉淀,溶液的pH至少为多少_______ 。
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因
(2)已知
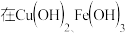 浓度相同的溶液中,其pH如下:
浓度相同的溶液中,其pH如下:| 氢氧化物 | 开始沉淀时的pH值 | 沉淀完全时的pH值 |
 | 4.67 | 6.67 |
 | 1.48 | 2.81 |
②如何除去氯化铜溶液中混有少量的氯化铁
③若使氢氧化铁完全沉淀,氢氧化铜不产生沉淀,溶液的pH至少为多少
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】在生产生活和科学研究中,人们常常根据需要促进或抑制盐的水解。试回答下列问题:
(1)FeCl2溶液呈____ (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____ ;实验室在配制FeCl2溶液时,常将FeCl2固体先溶于较浓的盐酸中,以_____ (填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)用离子方程式表示硫酸铝溶液和碳酸氢钠溶液混合时发生的主要反应____ 。
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是____ 。
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是___ 。
(1)FeCl2溶液呈
(2)用离子方程式表示硫酸铝溶液和碳酸氢钠溶液混合时发生的主要反应
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是
| A.甲同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。 |
| B.乙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。 |
| C.丙同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。 |
| D.丁同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。 |
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
您最近一年使用:0次



