(1)内因:___________________ 。
(2)外因:①浓度:_________________________
②温度:________________________________________
③酸碱度
(3)酸式盐溶液的酸碱性:强酸酸式盐显__________ ,原因是_____________________________ 。多元弱酸酸式盐溶液的酸碱性取决于_____________________________________ ,例如NaHCO3溶液显碱性,原因是_________________ ,_______________________________ (离子方程式和文字说明);
NaHSO3溶液显酸性的原因是________________ ,_____________________ (离子方程式和文字说明)。
(4)用↑、↓、→、←表示,填表:CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-_______________
(2)外因:①浓度:
②温度:
③酸碱度
(3)酸式盐溶液的酸碱性:强酸酸式盐显
NaHSO3溶液显酸性的原因是
(4)用↑、↓、→、←表示,填表:CH3COONa溶液改变下列条件,填写变化情况:CH3COO-+H2O
 CH3COOH+OH-
CH3COOH+OH-| 改变条件 | 平衡移动 | c(CH3COO-) | c(OH-) | 水解 |
| 加入CH3COONa | ||||
| 通入HCl | ||||
| 升温 | ||||
| 加水 | ||||
| 加NaOH | ||||
| 加HAc | ||||
| 加NH4Cl |
更新时间:2020-02-15 19:53:34
|
相似题推荐
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】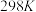 时,酸HA的电离平衡常数
时,酸HA的电离平衡常数 ,水的离子积
,水的离子积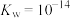 .试计算,在该温度下:
.试计算,在该温度下:
(1) 的HA溶液中,由水电离产生的
的HA溶液中,由水电离产生的
_____ ;
(2) 的NaA溶液中
的NaA溶液中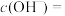
_____________
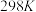 时,酸HA的电离平衡常数
时,酸HA的电离平衡常数 ,水的离子积
,水的离子积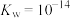 .试计算,在该温度下:
.试计算,在该温度下:(1)
 的HA溶液中,由水电离产生的
的HA溶液中,由水电离产生的
(2)
 的NaA溶液中
的NaA溶液中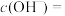
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】25℃时,硫氢化钾溶液里存在下列平衡:
a.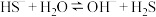 b.
b.
请回答下列问题:
(1)用a或b填空:___________ 是电离平衡;___________ 是水解平衡。
(2)当向硫氢化钾溶液中加入硫酸铜溶液时,生成了CuS沉淀,溶液的pH变___________ (填“大”或“小”)电离平衡向___________ (填“正反应方向”或“逆反应方向”,下同)移动;水解平衡向___________ 移动。
(3)当向硫氢化钾溶液中加入氢氧化钠固体时, 变
变___________ (填“大”或“小”)。
(4)若将溶液加热至沸腾,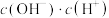 将变
将变___________ (填“大”或“小”)。
a.
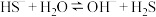 b.
b.
请回答下列问题:
(1)用a或b填空:
(2)当向硫氢化钾溶液中加入硫酸铜溶液时,生成了CuS沉淀,溶液的pH变
(3)当向硫氢化钾溶液中加入氢氧化钠固体时,
 变
变(4)若将溶液加热至沸腾,
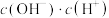 将变
将变
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】已知:可逆反应2SO2(g) + O2(g)⇌2SO3(g) △H<0,在一密闭容器中,该反应已达到平衡状态,按要求完成下列内容:
(1)2mol SO2(g) 和 1mol O2(g)的总能量_______ 2mol SO3(g)的总能量(填写“>”、“<”或“=”)
(2)保持容器体积不变,升高温度,平衡_______ 移动(填写“正向”、“逆向”或“不”)
(3)保持温度不变,压缩体积,平衡_______ 移动(填写“正向”、“逆向”或“不”),平衡常数_______ (填写“增大”、“减小”或“不变”)
(4)常温下, 溶液中,
溶液中,
_______ (填“>”“<”或“=”) ;
;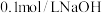 溶液的
溶液的
_______ 。
(5) 溶液呈
溶液呈_______ (填“酸”“碱”或“中”)性,其原因是_______ (用离子方程式表示)。
(1)2mol SO2(g) 和 1mol O2(g)的总能量
(2)保持容器体积不变,升高温度,平衡
(3)保持温度不变,压缩体积,平衡
(4)常温下,
 溶液中,
溶液中,
 ;
;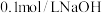 溶液的
溶液的
(5)
 溶液呈
溶液呈
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】(1)氨水中存在:NH3·H2O
 +OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。
+OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。
按照要求填空(答案选填物质对应的字母):
①电离平衡会向正向移动是_________ ,电离平衡会向逆向移动是__________ 。
②c( )、c(OH-)都增大的是
)、c(OH-)都增大的是___________ ,c( )、c(OH-)都变小的是
)、c(OH-)都变小的是___________ 。
③c( )增大,c(OH-)减小的是
)增大,c(OH-)减小的是___________ 。
④c( )减小,c(OH-)增大的是
)减小,c(OH-)增大的是___________ 。
(2)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为_________ ,若此温度下醋酸的电离常数K=1×10−5,pH为______ ,若升高温度, K将___________ (填“变大”、“变小”或“不变”)。
(3)Ⅰ、现有浓度均为0.1 mol∙L−1的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①若三种溶液中c(H+)分别为a mol∙L−1、b mol∙L−1、c mol∙L−1,则它们的大小关系为__________ 。
②等体积的以上三种酸分别与过量的NaOH溶液反应,若生成的盐的物质的量依次为A mol、B mol、C mol,则它们的大小关系为__________ 。
Ⅱ、现有pH=3的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、V3,其大小关系为________________ 。
②分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为____________ 。

 +OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。
+OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。按照要求填空(答案选填物质对应的字母):
①电离平衡会向正向移动是
②c(
 )、c(OH-)都增大的是
)、c(OH-)都增大的是 )、c(OH-)都变小的是
)、c(OH-)都变小的是③c(
 )增大,c(OH-)减小的是
)增大,c(OH-)减小的是④c(
 )减小,c(OH-)增大的是
)减小,c(OH-)增大的是(2)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为
(3)Ⅰ、现有浓度均为0.1 mol∙L−1的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①若三种溶液中c(H+)分别为a mol∙L−1、b mol∙L−1、c mol∙L−1,则它们的大小关系为
②等体积的以上三种酸分别与过量的NaOH溶液反应,若生成的盐的物质的量依次为A mol、B mol、C mol,则它们的大小关系为
Ⅱ、现有pH=3的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、V3,其大小关系为
②分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】一水合氨(NH3·H2O)是一种常见的弱碱,回答下列问题:
在0.1mol·L﹣1氨水中加入下列物质,一水合氨的电离平衡及平衡时物质的浓度的变化:
(1)写出NH3·H2O的电离方程式____ 。
(2)向氨水中加入NH4Cl固体,电离平衡向___ 移动(填“正向”、“逆向”或“不移动”,下同);pH ___ (填“增大”、“减小”或“不变”,下同)
(3)向氨水中加入FeCl3固体,电离平衡向_____ 移动;c(NH3·H2O)______
(4)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,若氨水的浓度为2.0mol∙L-1,则溶液中OH-的浓度是___ mol∙L-1。
在0.1mol·L﹣1氨水中加入下列物质,一水合氨的电离平衡及平衡时物质的浓度的变化:
(1)写出NH3·H2O的电离方程式
(2)向氨水中加入NH4Cl固体,电离平衡向
(3)向氨水中加入FeCl3固体,电离平衡向
(4)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,若氨水的浓度为2.0mol∙L-1,则溶液中OH-的浓度是
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】25℃时有以下5种溶液:①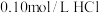 溶液;②
溶液;②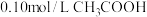 溶液;③
溶液;③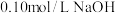 溶液;④
溶液;④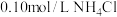 溶液;⑤
溶液;⑤ 溶液。
溶液。
(1)泡沫灭火器中的原料之一是上述5种溶液中的一种,此灭火器灭火的原理为_______ (用离子方程式表示)。
(2)往②加入少量 固体,此溶液的pH
固体,此溶液的pH_______ (填“增大”“减小”或“不变”)。
(3)①和②两种溶液中水的电离程度大小为①_______ ②(填“>”“<”或者“=”)。
(4)将②与③等体积混合后,溶液中存在的离子浓度由大到小的顺序是_______ (用离子符号表示)。
(5)用pH试纸测得④的 ,则此溶液中水电离出来的氢氧根离子浓度为
,则此溶液中水电离出来的氢氧根离子浓度为_______  。
。
(6)用 的标准盐酸滴定50.00mL未知浓度的NaOH溶液的酸碱中和滴定实验中,下列有关说法正确的是_______。
的标准盐酸滴定50.00mL未知浓度的NaOH溶液的酸碱中和滴定实验中,下列有关说法正确的是_______。
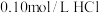 溶液;②
溶液;②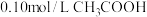 溶液;③
溶液;③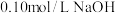 溶液;④
溶液;④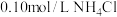 溶液;⑤
溶液;⑤ 溶液。
溶液。(1)泡沫灭火器中的原料之一是上述5种溶液中的一种,此灭火器灭火的原理为
(2)往②加入少量
 固体,此溶液的pH
固体,此溶液的pH(3)①和②两种溶液中水的电离程度大小为①
(4)将②与③等体积混合后,溶液中存在的离子浓度由大到小的顺序是
(5)用pH试纸测得④的
 ,则此溶液中水电离出来的氢氧根离子浓度为
,则此溶液中水电离出来的氢氧根离子浓度为 。
。(6)用
 的标准盐酸滴定50.00mL未知浓度的NaOH溶液的酸碱中和滴定实验中,下列有关说法正确的是_______。
的标准盐酸滴定50.00mL未知浓度的NaOH溶液的酸碱中和滴定实验中,下列有关说法正确的是_______。| A.用蒸馏水洗净酸式滴定管、锥形瓶后可分别直接注入标准盐酸和待测液NaOH溶液 |
| B.滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视滴定管液面变化 |
| C.此中和滴定实验的指示剂可采用酚酞,滴定终点的现象为:溶液由无色变为红色,且30s内颜色不变 |
| D.若滴定前仰视读数、滴定后俯视读数,则所测NaOH溶液的浓度偏低 |
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】请按要求作答:
I.现有:①硫酸铜溶液 ②CO2 ③石墨 ④KOH ⑤CH3COOH ⑥NH3 ⑦NH3•H2O ⑧NaHCO3
其中属于强电解质的是__ (填序号,下同),属于非电解质的是__ 。
II.常温下有浓度均为0.01mol/L的四种溶液:①Na2CO3②NaHCO3③HCl ④NH3·H2O,回答相关问题:
(1)上述溶液中,可发生水解的是________ (填序号)
(2)向④中加入少量NH4Cl固体,此时c(NH /OH-)的值
/OH-)的值_____ (“增大”、“减小”或“不变” )
(3)若将③和④的溶液混合后,溶液恰好呈中性,则混合前③的体积_________ ④的体积(填“大于”、“小于”或“等于” )
I.现有:①硫酸铜溶液 ②CO2 ③石墨 ④KOH ⑤CH3COOH ⑥NH3 ⑦NH3•H2O ⑧NaHCO3
其中属于强电解质的是
II.常温下有浓度均为0.01mol/L的四种溶液:①Na2CO3②NaHCO3③HCl ④NH3·H2O,回答相关问题:
(1)上述溶液中,可发生水解的是
(2)向④中加入少量NH4Cl固体,此时c(NH
 /OH-)的值
/OH-)的值(3)若将③和④的溶液混合后,溶液恰好呈中性,则混合前③的体积
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】(1)氯化铁水解的离子方程式为_________________________________ ,实验室配制氯化铁溶液时,常将氯化铁先溶于浓盐酸,然后再加水稀释,其目的是_________________________ 。
(2)若向氯化铁溶液中加入碳酸钙粉末,碳酸钙逐渐逐渐溶解,并产生无色气体的离子方程式为________ ,溶液中同时有红褐色沉淀生成,其原因是______________ 。
(2)若向氯化铁溶液中加入碳酸钙粉末,碳酸钙逐渐逐渐溶解,并产生无色气体的离子方程式为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】现有常温下两种溶液:
①0.1 mol•L-1 NH3•H20溶液
②0.1 mol•L-1 NH4Cl溶液
(1)溶液①的pH_____ 7(填‘>”“<”或“=”);该溶液_____ (填“促进”或“抑制”)了水的电离。
(2)溶液②呈_________ 性(填酸”“碱"或“中”),c(Cl-)_____ c(NH4+)(填‘>”“<”或“=”),升高温度可以___________ (填“促进”或“抑制“)NH4Cl的水解,此时溶液的pH_____ (填“变大”或“变小”或“不变”)。
①0.1 mol•L-1 NH3•H20溶液
②0.1 mol•L-1 NH4Cl溶液
(1)溶液①的pH
(2)溶液②呈
您最近一年使用:0次



