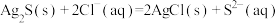下列溶液中有关说法正确的是
| A.室温下,0.1 mol/LNaHA溶液中离子浓度的关系有:c(Na+)=c(HA-)+c(OH-)+2c(A2-) |
| B.向0.1 mol/L(NH4)2SO4溶液中滴加少量浓硫酸,不引起明显体积变化,则c(NH4+)与c(SO42-)均增大 |
| C.已知Ksp(CuS)=1.3×10-36,则将足量CuSO4溶解在0.1 mol/L的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol/L |
| D.常温下,pH=5.6的CH3COOH与CH3COONa的混合溶液中,c(Na+)>c(CH3COO-) |
更新时间:2018-05-29 06:17:03
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,将0.01mol∙L-1盐酸逐滴加入10mL0.01mol∙L-1NaA溶液中。滴加过程中,A-、HA的物质的量分数(δ)随pH变化的关系如图1所示,pH随加入盐酸体积的变化如图2所示。下列说法正确的是
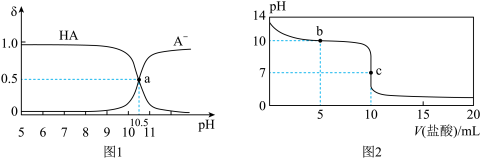

| A.当pH=7时,溶液中c(Cl-)=c(HA) |
| B.水解平衡常数Kh(NaA)=10-10.5 |
| C.b点对应溶液中:c(A-)>c(Cl-)>c(OH-) |
| D.c点对应溶液中:c(A-)+c(HA)= 0.01mol∙L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】配合物乙二胺四乙酸铁钠(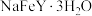 ,摩尔质量为
,摩尔质量为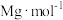 )可溶于水,易风化,常见于强化盐中。乙二胺四乙酸铁钠的制备及测定如下:
)可溶于水,易风化,常见于强化盐中。乙二胺四乙酸铁钠的制备及测定如下:
I.产品的制备:
步骤1:准确称取 于烧杯中,加水充分溶解,分批加入适量浓氨水,搅拌、过滤、洗涤、干燥。
于烧杯中,加水充分溶解,分批加入适量浓氨水,搅拌、过滤、洗涤、干燥。
步骤2:将Fe(OH)3、乙二胺四乙酸(H4Y),水加入三颈烧瓶中,搅拌,80℃水浴反应1h,加入Na2CO3溶液,发生反应: 。经过蒸发浓缩、冷却结晶,过滤、洗涤,晾干后得产品。
。经过蒸发浓缩、冷却结晶,过滤、洗涤,晾干后得产品。
II.产品中铁含量的测定:
称取m2g祥品,加稀硫酸溶解,配成100.00mL溶液。取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用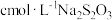 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: 。重复2~3次,消耗Na2S2O3标准溶液VmL。
。重复2~3次,消耗Na2S2O3标准溶液VmL。
根据上述实验,下列说法正确的是
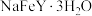 ,摩尔质量为
,摩尔质量为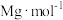 )可溶于水,易风化,常见于强化盐中。乙二胺四乙酸铁钠的制备及测定如下:
)可溶于水,易风化,常见于强化盐中。乙二胺四乙酸铁钠的制备及测定如下:I.产品的制备:
步骤1:准确称取
 于烧杯中,加水充分溶解,分批加入适量浓氨水,搅拌、过滤、洗涤、干燥。
于烧杯中,加水充分溶解,分批加入适量浓氨水,搅拌、过滤、洗涤、干燥。步骤2:将Fe(OH)3、乙二胺四乙酸(H4Y),水加入三颈烧瓶中,搅拌,80℃水浴反应1h,加入Na2CO3溶液,发生反应:
 。经过蒸发浓缩、冷却结晶,过滤、洗涤,晾干后得产品。
。经过蒸发浓缩、冷却结晶,过滤、洗涤,晾干后得产品。II.产品中铁含量的测定:
称取m2g祥品,加稀硫酸溶解,配成100.00mL溶液。取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用
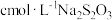 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: 。重复2~3次,消耗Na2S2O3标准溶液VmL。
。重复2~3次,消耗Na2S2O3标准溶液VmL。根据上述实验,下列说法正确的是
| A.若称取样品时间长,不影响乙二胺四乙酸铁钠产品纯度的计算结果 |
| B.若配制溶液倒转摇匀后发现液面低于刻度线,再加水,则测得产品中铁含量偏高 |
| C.若盛标准液的滴定管未润洗,则测得产品中铁含量会偏高 |
| D.若滴定终点后,滴定管尖嘴处悬挂一滴溶液,则测得产品中铁纯度偏低 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列实验操作能达到目的的是
| 选项 | 操作 | 目的 |
| A | 将混合气体通过饱和 溶液后干燥 溶液后干燥 | 除去 中的少量 中的少量 |
| B | 测定相同浓度的 溶液、 溶液、 溶液的pH 溶液的pH | 比较Cl和N的非金属性强弱 |
| C | 向AgCl浊液中滴加几滴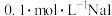 溶液 溶液 | 比较AgCl和AgI的 大小 大小 |
| D | 向淀粉水解液中加入少量银氨溶液,水浴加热 | 证明淀粉水解液中含有葡萄糖 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】为达到相应实验目的,下列实验设计可行的是
| 编号 | 实验目的 | 实验过程 |
| A | 探究浓度对反应速率的影响 | 向 2 支盛有 2mL 0.01mol/L 酸性 KMnO4溶液的试管中分别加入 2mL 0.1mol/L 和 1mL 0.2mol/L的 H2C2O4 溶液,观察溶液褪色所需时间 |
| B | 证明碳酸酸性强于硼酸 | 向饱和碳酸氢钠溶液中滴加少量的硼酸溶液,无气泡产生 |
| C | 证明 Ksp[Fe(OH)3])<Ksp[Mg(OH)2] | 向 盛 有 1mL0.1mol/LMgCl2溶液中滴加1mL0.4mol/LNaOH 溶液,有白色沉淀出现,再滴加 2滴 0.1mol/LFeCl3,静止,有红棕色沉淀出现 |
| D | 除去碱式滴定管内的气泡 | 将尖嘴垂直向下,挤压胶管内玻璃球将气泡排出 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
【推荐1】湿法提银工艺中,浸出 需加
需加 沉淀。25℃,平衡体系中含
沉淀。25℃,平衡体系中含 微粒的分布系数
微粒的分布系数 [如
[如 ]随
]随 的变化曲线如图所示,
的变化曲线如图所示,
已知: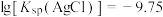 ,下列叙述正确的是
,下列叙述正确的是
 需加
需加 沉淀。25℃,平衡体系中含
沉淀。25℃,平衡体系中含 微粒的分布系数
微粒的分布系数 [如
[如 ]随
]随 的变化曲线如图所示,
的变化曲线如图所示,已知:
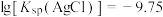 ,下列叙述正确的是
,下列叙述正确的是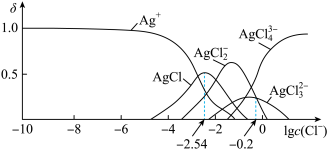
A.25℃时, 的溶解度随 的溶解度随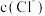 增大而减小 增大而减小 |
B.沉淀最彻底时,溶液中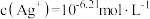 |
C.25℃时, 的平衡常数 的平衡常数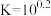 |
D.当 时,溶液中 时,溶液中 |
您最近一年使用:0次
【推荐2】某温度下,向10mL 0.1mol·L-1 CuCl2溶液中滴加0.1mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示。已知:Ksp(ZnS)=3×10-25,下列有关说法正确的是


| A.Na2S溶液中:c(H+)+c(HS-)+c(H2S)=c(OH-) |
| B.a、b、c三点对应的溶液中,水的电离程度最小的为b点 |
| C.c点溶液中c(Cu2+)=10-34.4 mol·L-1 |
| D.向100mL Zn2+、Cu2+物质的量浓度均为0.1mol·L-1的混合溶液中逐滴加入10-3 mol·L-1的Na2S溶液,Zn2+先沉淀 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】下列有关实验现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向淀粉的酸性水解液中滴入少量新制Cu(OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
| B | NaAlO2溶液与NaHCO3溶液混合 | 白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 N2O4 N2O4的△H<0 |
| D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1mol/L的NaI溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次


 溶液与过量
溶液与过量 溶液反应:
溶液反应:
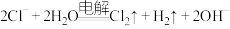
 溶液中滴入KSCN溶液:
溶液中滴入KSCN溶液:
 固体加入NaCl溶液:
固体加入NaCl溶液: