(1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH1=-1048.9 kJ/mol
N2H4(l)+O2(g)=== N2(g)+2H2O(g) ΔH2=-534.2 kJ/mol
则N2(g)+2O2(g)===N2O4 (l) ΔH3=_________ kJ/mol
(2)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为________ kJ。
(3).根据以下三个热化学方程式:
2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH=-Q1 kJ/mol,
2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH=-Q2 kJ/mol,
2H2S(g)+O2(g)===2S(s)+2H2O(g) ΔH=-Q3 kJ/mol。
判断Q1、Q2、Q3三者大小关系_______ >________ >_______
已知:2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH1=-1048.9 kJ/mol
N2H4(l)+O2(g)=== N2(g)+2H2O(g) ΔH2=-534.2 kJ/mol
则N2(g)+2O2(g)===N2O4 (l) ΔH3=
(2)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为
(3).根据以下三个热化学方程式:
2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH=-Q1 kJ/mol,
2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH=-Q2 kJ/mol,
2H2S(g)+O2(g)===2S(s)+2H2O(g) ΔH=-Q3 kJ/mol。
判断Q1、Q2、Q3三者大小关系
更新时间:2018-09-17 16:32:57
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g) 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
②CaSO4(s)+CO(g) CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
③CO(g) 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
(1)反应2 CaSO4(s)+7CO(g) CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=_______________ (用△H1、△H2和△H3表示)。
(2)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入__________________ 。
(3)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生成CaSO4,该反应的化学方程式为___________ ;在一定条件下CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为_______________ 。
①1/4CaSO4(s)+CO(g)
 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol②CaSO4(s)+CO(g)
 CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol③CO(g)
 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol(1)反应2 CaSO4(s)+7CO(g)
 CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=(2)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入
(3)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生成CaSO4,该反应的化学方程式为
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐2】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)通过以下反应均可获取H2。下列有关说法正确的是(_____ )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=206.1kJ·mol–1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH=74.8kJ·mol–1
(2)俄罗斯用“质子﹣M”号运载火箭成功将“光线”号卫星送入预定轨道。发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
①H2(g)=H2(l)△H1=﹣0.92kJ·mol﹣1
②O2(g)=O2(l)△H2=﹣6.84kJ·mol﹣1
③有关过程如图:
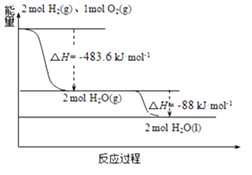
下列说法正确的是(_____ )
A.2mol H2(g)与1mol O2(g)所具有的总能量比2molH2O(g)所具有的总能量低
B.氢气的燃烧热为△H=﹣241.8 kJ·mol﹣1
C.火箭液氢燃烧的热化学方程式2H2(l)+O2(l)═2H2O(g)△H=﹣474.92kJ·mol﹣1
D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
(3)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____ 0(填“>”、“<”或“=”)。
(4)①合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。贮氢合金ThNi5可催化由CO、H2合成CH4的反应,已知温度为T时:
CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165kJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41kJ•mol
则温度为T时,该反应的热化学方程式为_________ 。
②研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式____________ 。
(5)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2 ,其中CO分子为C≡O)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1=___ kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=___ kJ·mol-1。
(1)通过以下反应均可获取H2。下列有关说法正确的是(
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=206.1kJ·mol–1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH=74.8kJ·mol–1
(2)俄罗斯用“质子﹣M”号运载火箭成功将“光线”号卫星送入预定轨道。发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
①H2(g)=H2(l)△H1=﹣0.92kJ·mol﹣1
②O2(g)=O2(l)△H2=﹣6.84kJ·mol﹣1
③有关过程如图:

下列说法正确的是(
A.2mol H2(g)与1mol O2(g)所具有的总能量比2molH2O(g)所具有的总能量低
B.氢气的燃烧热为△H=﹣241.8 kJ·mol﹣1
C.火箭液氢燃烧的热化学方程式2H2(l)+O2(l)═2H2O(g)△H=﹣474.92kJ·mol﹣1
D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
(3)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH
(4)①合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。贮氢合金ThNi5可催化由CO、H2合成CH4的反应,已知温度为T时:
CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165kJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41kJ•mol
则温度为T时,该反应的热化学方程式为
②研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式
(5)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2 ,其中CO分子为C≡O)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2③CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐3】文献查阅得到如下数据:
C2H4的燃烧热为1411kJ/mol
C2H6的燃烧热为1558kJ/mol
H2的燃烧热为285.8kJ/mol
(1)表示气体C2H4燃烧热的热化学方程式为____ 。
(2)C2H4(g)+H2(g)=C2H6(g) ΔH=____ 。
(3)已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol,一些化学键键能如下:H—H为436kJ/mol;O=O为498kJ/mol;则O—H键的键能为____ kJ/mol。
(4)用C2H4与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,写出该燃料电池的负极反应式____ 。用该电池作为电源电解600mL0.2mol/LCuSO4溶液,当转移0.06mol电子时消耗标准状况下O2的体积为____ L;此时,电解后溶液的pH为____ 。(假设电解后溶液体积不变)
C2H4的燃烧热为1411kJ/mol
C2H6的燃烧热为1558kJ/mol
H2的燃烧热为285.8kJ/mol
(1)表示气体C2H4燃烧热的热化学方程式为
(2)C2H4(g)+H2(g)=C2H6(g) ΔH=
(3)已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol,一些化学键键能如下:H—H为436kJ/mol;O=O为498kJ/mol;则O—H键的键能为
(4)用C2H4与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,写出该燃料电池的负极反应式
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题
(1)用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如下图所示的催化循环实现。
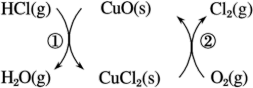
其中,反应①为2HCl(g)+CuO(s) = H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2的反应热为ΔH2,则总反应的热化学方程式为______________ (反应热用ΔH1和ΔH2表示)。
(2)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是____________ 。
(3)已知:温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol-1
贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为______ 。
(4)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1 kJ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为___________ 。
(5)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) = CH3OH(g) ΔH1
②CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) = CO(g)+H2O(g) ΔH3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
由此计算ΔH1=________ kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________ kJ·mol-1。
(6)已知:① H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol
② 断开1mol H2分子中的化学键需要吸收436kJ的能量
③ 断开1mol Cl2分子中的化学键需要吸收243kJ的能量
则:断开1mol HCl分子中的化学键需要吸收______ kJ的能量。
(1)用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如下图所示的催化循环实现。
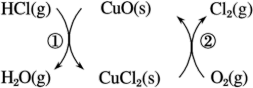
其中,反应①为2HCl(g)+CuO(s) = H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2的反应热为ΔH2,则总反应的热化学方程式为
(2)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
(3)已知:温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol-1
贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为
(4)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1 kJ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2 kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
(5)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) = CH3OH(g) ΔH1
②CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) = CO(g)+H2O(g) ΔH3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(6)已知:① H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol
② 断开1mol H2分子中的化学键需要吸收436kJ的能量
③ 断开1mol Cl2分子中的化学键需要吸收243kJ的能量
则:断开1mol HCl分子中的化学键需要吸收
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题。回答下列问题:
(1)近年我国努力调整能源结构,开发新能源。下列物质中,属于可再生能源的是_______ (填字母)。
A、氢能 B、天然气 C、石油
(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),反应过程中的能量变化情况如图所示。反应的活化能为_______ kJ/mol,曲线_______ (选填“I”或“II”)表示使用催化剂的反应过程。计算当反应生成1.5molCH3OH(g)时,能量变化值是_______ kJ。
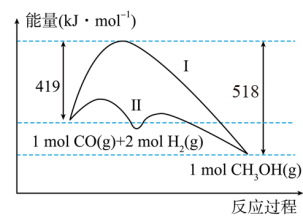
又知该反应中某些物质分子里的化学键的键能数据如下表:
若CO中的C与O之间为三键连接,则C≡O键的键能为_______ kJ·mol-l。
(3)CO2资源化利用的方法之一是合成二甲醚(CH3OCH3)。CO2催化加氢合成二甲醚的过程中主要发生下列反应:
反应I:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H=+41.2kJ/mol
反应II:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H=-122.5kJ/mol
其中,反应II:分以下①②两步完成,请写出反应①的热化学方程式。
①_______ 。
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
(1)近年我国努力调整能源结构,开发新能源。下列物质中,属于可再生能源的是
A、氢能 B、天然气 C、石油
(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),反应过程中的能量变化情况如图所示。反应的活化能为

又知该反应中某些物质分子里的化学键的键能数据如下表:
化学键 | C-H | H-H | C-O | H-O |
| 键能(kJ∙mol-1) | 413 | 436 | 343 | 465 |
若CO中的C与O之间为三键连接,则C≡O键的键能为
(3)CO2资源化利用的方法之一是合成二甲醚(CH3OCH3)。CO2催化加氢合成二甲醚的过程中主要发生下列反应:
反应I:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H=+41.2kJ/mol
反应II:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H=-122.5kJ/mol
其中,反应II:分以下①②两步完成,请写出反应①的热化学方程式。
①
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】已知:①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ/mol
③H2(g)+F2(g)=2HF(g)△H=-538kJ/mol
④H2(g)+ O2(g)=H2O(g)△H=-242kJ/mol
O2(g)=H2O(g)△H=-242kJ/mol
(1)以上四个反应中,属于放热反应的是_____ ,属于吸热反应的是_____ 。
(2)由以上反应可知,等物质的量的N2H4(g)和H2(g)与足量的O2(g)反应,放出能量更多的是_____ (填“N2H4”或“H2”,下同);等质量的N2H4(g)和H2(g)与足量的O2(g)反应,放出能量更多的是____ 。
(3)由反应①和②可求:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=-_____ kJ/mol
(4)有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,由反应②、③、④可求:N2H4(g)+2F2(g)=N2(g)+4HF(g) △H=-_____ kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ/mol
③H2(g)+F2(g)=2HF(g)△H=-538kJ/mol
④H2(g)+
 O2(g)=H2O(g)△H=-242kJ/mol
O2(g)=H2O(g)△H=-242kJ/mol(1)以上四个反应中,属于放热反应的是
(2)由以上反应可知,等物质的量的N2H4(g)和H2(g)与足量的O2(g)反应,放出能量更多的是
(3)由反应①和②可求:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=-
(4)有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,由反应②、③、④可求:N2H4(g)+2F2(g)=N2(g)+4HF(g) △H=-
您最近半年使用:0次
【推荐2】已知热化学反应方程式:
反应Ⅰ:N2H4(g) N2(g)+2H2(g) ΔH1
N2(g)+2H2(g) ΔH1
反应Ⅱ:N2(g)+3H2(g) 2NH3(g) ΔH2
2NH3(g) ΔH2
(1)ΔH1__ ΔH2(填“<”、“>”或“=”)。
(2)7N2H4(g) 8NH3(g)+3N2(g)+2H2(g) ΔH=
8NH3(g)+3N2(g)+2H2(g) ΔH=__ (用ΔH1、ΔH2表示)。
反应Ⅰ:N2H4(g)
 N2(g)+2H2(g) ΔH1
N2(g)+2H2(g) ΔH1反应Ⅱ:N2(g)+3H2(g)
 2NH3(g) ΔH2
2NH3(g) ΔH2(1)ΔH1
(2)7N2H4(g)
 8NH3(g)+3N2(g)+2H2(g) ΔH=
8NH3(g)+3N2(g)+2H2(g) ΔH=
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】已知一些烷烃的燃烧热如下表:
(1)热稳定性:正丁烷________ (填“>”或“<”)异丁烷。
(2)写出表示乙烷燃烧热的热化学方程式_____________________________________ 。
(3)相同物质的量的烷烃,碳原子数越多,燃烧放出的热量越_______ (填“多”或“少”)。
(4)有同学估计“正戊烷的燃烧热大约在3 540 kJ·mol−1左右”,你认为正确吗?______ 。理由是_______________________________________ 。
| 化合物 | 燃烧热/kJ·mol−1 | 化合物 | 燃烧热/kJ·mol−1 |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 异戊烷 | 3 531.3 |
(1)热稳定性:正丁烷
(2)写出表示乙烷燃烧热的热化学方程式
(3)相同物质的量的烷烃,碳原子数越多,燃烧放出的热量越
(4)有同学估计“正戊烷的燃烧热大约在3 540 kJ·mol−1左右”,你认为正确吗?
您最近半年使用:0次





 )
) 白磷(
白磷( )燃烧生成
)燃烧生成 时放出2982
时放出2982 热量,白磷(
热量,白磷(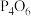 、
、 的结构如图所示,则上表中
的结构如图所示,则上表中

 完全反应生成固态
完全反应生成固态

