某研究小组以绿矾为原料制备化合物A[KxFe(Ⅲ)y(C2O4)z·nH2O],并通过如下实验步骤测定A的化学式:
步骤1:准确称取A样品4.910g,干燥脱水至恒重,残留物质量为4.370g;
步骤2:准确称取A样品4.910g置于锥形瓶中,加入足量的3.000mol·L-1的H2SO4溶液和适量蒸馏水,用0.5000mol·L-1的KMnO4溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为24.00 mL;
步骤3:将步骤1所得固体溶于水,加入铁粉0.2800g,恰好完全反应。
(1)①检验A中是否含有Fe2+可选用的试剂是___ (填字母)。
a.KSCN溶液 b.KMnO4溶液 c.氯水和KSCN溶液
②证明A中含有钾元素的方法是____________________________________ 。
(2)步骤2中发生反应的离子方程式为________________________________ 。
(3)通过计算确定化合物A的化学式(请写出计算过程)。___________
步骤1:准确称取A样品4.910g,干燥脱水至恒重,残留物质量为4.370g;
步骤2:准确称取A样品4.910g置于锥形瓶中,加入足量的3.000mol·L-1的H2SO4溶液和适量蒸馏水,用0.5000mol·L-1的KMnO4溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为24.00 mL;
步骤3:将步骤1所得固体溶于水,加入铁粉0.2800g,恰好完全反应。
(1)①检验A中是否含有Fe2+可选用的试剂是
a.KSCN溶液 b.KMnO4溶液 c.氯水和KSCN溶液
②证明A中含有钾元素的方法是
(2)步骤2中发生反应的离子方程式为
(3)通过计算确定化合物A的化学式(请写出计算过程)。
更新时间:2018/10/09 08:00:37
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】草酸亚铁晶体( )可作为制备汽车电池正极材料磷酸铁锂的原料。以
)可作为制备汽车电池正极材料磷酸铁锂的原料。以 溶液制备电池级草酸亚铁晶体的实验流程如图:
溶液制备电池级草酸亚铁晶体的实验流程如图:___________ ,得到的混合体系不宜在空气中久置,其原因是___________ 。
(2)“转化”过程 在下图所示的装置中进行。导管A的作用是
在下图所示的装置中进行。导管A的作用是___________ 。三颈烧瓶中间插入搅拌棒的作用除搅拌反应物使反应更充分外,还有___________ 。___________ 。
(4)以废渣(主要含 、
、 、
、 等)为原料制备实验所需的
等)为原料制备实验所需的 溶液。请补充实验方案:向废渣中分批加入稀硫酸,边加边搅拌,当固体不再溶解时,过滤:在搅拌下向滤液中滴加NaOH溶液至
溶液。请补充实验方案:向废渣中分批加入稀硫酸,边加边搅拌,当固体不再溶解时,过滤:在搅拌下向滤液中滴加NaOH溶液至___________ 时,过滤;用蒸馏水洗涤滤渣2~3次后,在搅拌下向滤渣中加入___________ 至滤渣完全溶解;在搅拌下向所得溶液中分批加入___________ ,直至向取出的少量溶液中滴加___________ 溶液不再出现红色,过滤。
[实验中可供使用的试剂:稀硫酸、铁粉、NaOH溶液、KSCN溶液、蒸馏水]
(5)测定草酸亚铁样品纯度的方法如下:准确称取0.2500g样品,加入适量水、 、磷酸,逐滴加入
、磷酸,逐滴加入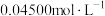
 溶液至恰好完全反应(草酸亚铁转化为
溶液至恰好完全反应(草酸亚铁转化为 和
和 ),消耗
),消耗 溶液18.00mL。计算样品中
溶液18.00mL。计算样品中 的纯度
的纯度___________ (写出计算过程)。
 )可作为制备汽车电池正极材料磷酸铁锂的原料。以
)可作为制备汽车电池正极材料磷酸铁锂的原料。以 溶液制备电池级草酸亚铁晶体的实验流程如图:
溶液制备电池级草酸亚铁晶体的实验流程如图: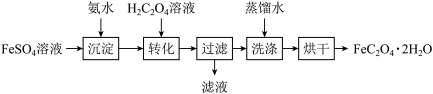
(2)“转化”过程
 在下图所示的装置中进行。导管A的作用是
在下图所示的装置中进行。导管A的作用是
(4)以废渣(主要含
 、
、 、
、 等)为原料制备实验所需的
等)为原料制备实验所需的 溶液。请补充实验方案:向废渣中分批加入稀硫酸,边加边搅拌,当固体不再溶解时,过滤:在搅拌下向滤液中滴加NaOH溶液至
溶液。请补充实验方案:向废渣中分批加入稀硫酸,边加边搅拌,当固体不再溶解时,过滤:在搅拌下向滤液中滴加NaOH溶液至[实验中可供使用的试剂:稀硫酸、铁粉、NaOH溶液、KSCN溶液、蒸馏水]
(5)测定草酸亚铁样品纯度的方法如下:准确称取0.2500g样品,加入适量水、
 、磷酸,逐滴加入
、磷酸,逐滴加入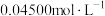
 溶液至恰好完全反应(草酸亚铁转化为
溶液至恰好完全反应(草酸亚铁转化为 和
和 ),消耗
),消耗 溶液18.00mL。计算样品中
溶液18.00mL。计算样品中 的纯度
的纯度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】① ②
② ③
③ ④
④ ⑤
⑤ 是实验室的常见物质,回答下列问题。
是实验室的常见物质,回答下列问题。
(1) 溶液呈
溶液呈_______ (填“酸性”、“中性”或“碱性”),结合化学用语解释原因:_______ 。
(2)下列有关②③溶液的叙述,正确的是_______ 。
a.向 溶液中加入少量
溶液中加入少量 固体,
固体, 减小
减小
b. 溶液中离子浓度关系满足:
溶液中离子浓度关系满足: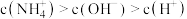
c.等浓度的 和
和 溶液的导电性相同
溶液的导电性相同
d.等 的
的 和
和 溶液分别稀释10倍,
溶液分别稀释10倍, 变化大的是
变化大的是 溶液
溶液
(3)常温下, 均等于9的
均等于9的 溶液和
溶液和 溶液,
溶液, 溶液中水电离出的
溶液中水电离出的 与
与 溶液中水电离出的
溶液中水电离出的 之比是
之比是_______ 。
(4)未知浓度的 溶液可通过不同方法测得其浓度。
溶液可通过不同方法测得其浓度。
方法一:用标准酸性 溶液滴定未知浓度的
溶液滴定未知浓度的 溶液。
溶液。
资料: 酸性条件下被还原为
酸性条件下被还原为
①滴定终点的现象为_______ 。
②该反应中
_______ 。
方法二:测定流程如下: 溶液装入滴定管
溶液装入滴定管_______ 中(填“a”或“b”)。 溶液的体积为
溶液的体积为 ,滴定步骤中标准
,滴定步骤中标准 溶液的浓度和消耗的体积分别为
溶液的浓度和消耗的体积分别为 和
和 ,计算
,计算 溶液的浓度还需要的实验数据有
溶液的浓度还需要的实验数据有_______ 。
 ②
② ③
③ ④
④ ⑤
⑤ 是实验室的常见物质,回答下列问题。
是实验室的常见物质,回答下列问题。(1)
 溶液呈
溶液呈(2)下列有关②③溶液的叙述,正确的是
a.向
 溶液中加入少量
溶液中加入少量 固体,
固体, 减小
减小b.
 溶液中离子浓度关系满足:
溶液中离子浓度关系满足: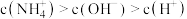
c.等浓度的
 和
和 溶液的导电性相同
溶液的导电性相同d.等
 的
的 和
和 溶液分别稀释10倍,
溶液分别稀释10倍, 变化大的是
变化大的是 溶液
溶液(3)常温下,
 均等于9的
均等于9的 溶液和
溶液和 溶液,
溶液, 溶液中水电离出的
溶液中水电离出的 与
与 溶液中水电离出的
溶液中水电离出的 之比是
之比是(4)未知浓度的
 溶液可通过不同方法测得其浓度。
溶液可通过不同方法测得其浓度。方法一:用标准酸性
 溶液滴定未知浓度的
溶液滴定未知浓度的 溶液。
溶液。资料:
 酸性条件下被还原为
酸性条件下被还原为
①滴定终点的现象为
②该反应中

方法二:测定流程如下:
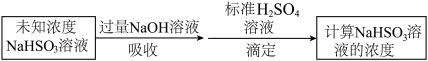
 溶液装入滴定管
溶液装入滴定管
 溶液的体积为
溶液的体积为 ,滴定步骤中标准
,滴定步骤中标准 溶液的浓度和消耗的体积分别为
溶液的浓度和消耗的体积分别为 和
和 ,计算
,计算 溶液的浓度还需要的实验数据有
溶液的浓度还需要的实验数据有
您最近一年使用:0次
【推荐3】Na2S可用于制造硫化染料、沉淀水体中的重金属等。
(1)Na2S溶液中S2-水解的离子方程式为_________ 。
(2)室温时,几种重金属离子的硫化物的溶度积常数如下表:
①向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是____ 。
②用Na2S溶液沉淀废水中Pb2+,为使Pb2+沉淀完全[c(Pb2+)≤1×10-6mol/L],则应满足溶液中c(S2-)≥_____ mol/L。
③反应Cu2+(aq)+FeS(s) Fe2+(aq)+CuS(s)的平衡常数K=
Fe2+(aq)+CuS(s)的平衡常数K=_______ 。
(3)测定某Na2S和NaHS混合样品中两者含量的实验步骤如下:
步骤1.准确称取一定量样品于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容。
步骤2.准确移取25.00mL上述溶液于锥形瓶中,加入茜素黄GG-百时香酚蓝混合指示剂,用0.2500mol/L盐酸标准溶液滴定(Na2S+HCl=NaHS+NaCl)至终点,消耗盐酸24.00mL;向其中再加入5mL中性甲醛(NaHS+HCHO+H2O→NaOH+HSCH2OH)和3滴酚酞指示剂,继续用0.2500mol/L盐酸标准溶液滴定(NaOH+HCl=NaCl+H2O)至终点,又消耗盐酸34.00mL。
计算原混合物中Na2S与NaHS的物质的量之比(写出计算过程)___________ 。
(1)Na2S溶液中S2-水解的离子方程式为
(2)室温时,几种重金属离子的硫化物的溶度积常数如下表:
| 金属硫化物 | FeS | PbS | CuS | HgS |
| Ksp | 6.3×10-18 | 1.0×10-28 | 6.3×10-36 | 1.6×10-52 |
①向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是
②用Na2S溶液沉淀废水中Pb2+,为使Pb2+沉淀完全[c(Pb2+)≤1×10-6mol/L],则应满足溶液中c(S2-)≥
③反应Cu2+(aq)+FeS(s)
 Fe2+(aq)+CuS(s)的平衡常数K=
Fe2+(aq)+CuS(s)的平衡常数K=(3)测定某Na2S和NaHS混合样品中两者含量的实验步骤如下:
步骤1.准确称取一定量样品于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容。
步骤2.准确移取25.00mL上述溶液于锥形瓶中,加入茜素黄GG-百时香酚蓝混合指示剂,用0.2500mol/L盐酸标准溶液滴定(Na2S+HCl=NaHS+NaCl)至终点,消耗盐酸24.00mL;向其中再加入5mL中性甲醛(NaHS+HCHO+H2O→NaOH+HSCH2OH)和3滴酚酞指示剂,继续用0.2500mol/L盐酸标准溶液滴定(NaOH+HCl=NaCl+H2O)至终点,又消耗盐酸34.00mL。
计算原混合物中Na2S与NaHS的物质的量之比(写出计算过程)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】氮化镁 是一种应用范围非常广泛的无机化合物,它可用于制备高硬度、高热导、抗腐蚀、抗磨损和耐高温的的氮化物。某兴趣小组用镁与氮气反应制备氮化镁,并用实验方法测定氮化镁的纯度,已知氮化镁极易与水反应生成
是一种应用范围非常广泛的无机化合物,它可用于制备高硬度、高热导、抗腐蚀、抗磨损和耐高温的的氮化物。某兴趣小组用镁与氮气反应制备氮化镁,并用实验方法测定氮化镁的纯度,已知氮化镁极易与水反应生成 和
和 。
。
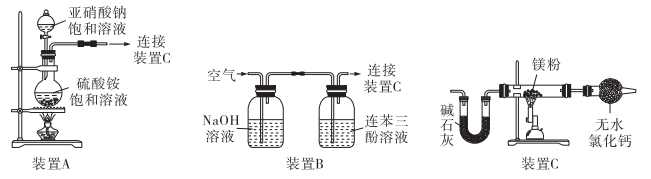
Ⅰ.利用装置A和C制备
(1)装置A在加入药品前必须完成的实验操作为_______ ,装置C中无水氯化钙的作用为_______ 。
(2)装置A中制取 的化学方程式为
的化学方程式为_______ 。
(3)制备过程中需要先加热装置A,一段时间后再加热装置C,这样操作的理由为_______ 。
Ⅱ.利用装置B和C制备
(4)装置B中 溶液里发生反应的离子方程式为
溶液里发生反应的离子方程式为_______ 。
(5)装置B中连苯三酚溶液的作用为_______ 。
Ⅲ.测定氮化镁的纯度
(6)取 氮化镁样品与适量蒸馏水反应,将生成的气体全部通入浓硫酸中,测得浓硫酸质量增重
氮化镁样品与适量蒸馏水反应,将生成的气体全部通入浓硫酸中,测得浓硫酸质量增重 ,则产品的纯度为
,则产品的纯度为_______ %(计算结果保留一位小数),该方法测得的纯度_______ (填“偏大”或“偏小”)。
 是一种应用范围非常广泛的无机化合物,它可用于制备高硬度、高热导、抗腐蚀、抗磨损和耐高温的的氮化物。某兴趣小组用镁与氮气反应制备氮化镁,并用实验方法测定氮化镁的纯度,已知氮化镁极易与水反应生成
是一种应用范围非常广泛的无机化合物,它可用于制备高硬度、高热导、抗腐蚀、抗磨损和耐高温的的氮化物。某兴趣小组用镁与氮气反应制备氮化镁,并用实验方法测定氮化镁的纯度,已知氮化镁极易与水反应生成 和
和 。
。
Ⅰ.利用装置A和C制备

(1)装置A在加入药品前必须完成的实验操作为
(2)装置A中制取
 的化学方程式为
的化学方程式为(3)制备过程中需要先加热装置A,一段时间后再加热装置C,这样操作的理由为
Ⅱ.利用装置B和C制备

(4)装置B中
 溶液里发生反应的离子方程式为
溶液里发生反应的离子方程式为(5)装置B中连苯三酚溶液的作用为
Ⅲ.测定氮化镁的纯度
(6)取
 氮化镁样品与适量蒸馏水反应,将生成的气体全部通入浓硫酸中,测得浓硫酸质量增重
氮化镁样品与适量蒸馏水反应,将生成的气体全部通入浓硫酸中,测得浓硫酸质量增重 ,则产品的纯度为
,则产品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】甲醛在石油化工、医药、轻纺、生物化工以及能源、交通运输等行业均有广泛用途。实验小组设计实验制备甲醛,并进行相关性质的探究。回答下列问题:
Ⅰ.制备甲醛
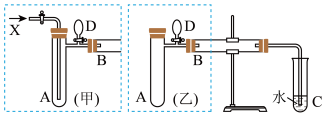
实验室利用甲醇、空气(或氧气)和铜(或利用甲醇和氧化铜)制备甲醛。如图是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示。
(1)从原子轨道重叠方式分类,甲醛分子中的H-C键是_______ σ键。
(2)若按(甲)装置进行实验,则通入A管的X是_______ (填名称)。若按(乙)装置进行实验,B管中发生反应的化学方程式为_______ 。
Ⅱ.探究甲醛与新制 反应的产物
反应的产物
取 溶液、过量的NaOH溶液和甲醛溶液于烧瓶中,控制温度为40~50℃回流1h,收集到大量气体Y,烧瓶中有红色沉淀生成,同时得到溶液Z。
溶液、过量的NaOH溶液和甲醛溶液于烧瓶中,控制温度为40~50℃回流1h,收集到大量气体Y,烧瓶中有红色沉淀生成,同时得到溶液Z。
(3)实验小组猜想气体产物Y可能是CO、 、
、 中的一种。为确定气体成分,利用下列装置验证猜想(已知:CO可将银氨溶液还原成黑色粉末银单质)。
中的一种。为确定气体成分,利用下列装置验证猜想(已知:CO可将银氨溶液还原成黑色粉末银单质)。__________ (按气流方向填写装置标号,有些装置可重复使用)。
②实验证明气体产物Y为 ,没有
,没有 和CO,则实验观察到装置A、C、D、E中的现象为
和CO,则实验观察到装置A、C、D、E中的现象为_______ 。
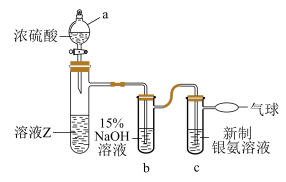
(4)在探究溶液Z中甲醛的氧化产物时,发现未生成 。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(夹持装置和加热装置已省略,已知:
。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(夹持装置和加热装置已省略,已知: )。
)。_______ (填标号)。
A.氧化性 B.强酸性 C.还原性 D.脱水性
②c中银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为_______ 。
(5)通过定量测定发现,甲醛与新制 反应中生成的红色沉淀主要为Cu,且Cu的物质的量和气体Y的相等,则该条件下甲醛与新制
反应中生成的红色沉淀主要为Cu,且Cu的物质的量和气体Y的相等,则该条件下甲醛与新制 、NaOH溶液反应生成Cu和气体Y的化学方程式为
、NaOH溶液反应生成Cu和气体Y的化学方程式为_______ 。
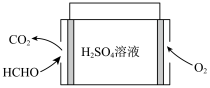
(6)甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图所示。国家标准是室内甲醛不能超过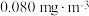 ,传感器在
,传感器在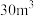 室内空间测定,电路中有
室内空间测定,电路中有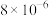 mol电子通过,该室内甲醛含量为
mol电子通过,该室内甲醛含量为_______ 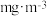 。
。
Ⅰ.制备甲醛
实验室利用甲醇、空气(或氧气)和铜(或利用甲醇和氧化铜)制备甲醛。如图是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示。
| 物质 | 沸点/℃ | 水溶性 |
| 甲醇 | 65 | 混溶 |
| 甲醛 | -21 | 混溶 |
(1)从原子轨道重叠方式分类,甲醛分子中的H-C键是
(2)若按(甲)装置进行实验,则通入A管的X是
Ⅱ.探究甲醛与新制
 反应的产物
反应的产物取
 溶液、过量的NaOH溶液和甲醛溶液于烧瓶中,控制温度为40~50℃回流1h,收集到大量气体Y,烧瓶中有红色沉淀生成,同时得到溶液Z。
溶液、过量的NaOH溶液和甲醛溶液于烧瓶中,控制温度为40~50℃回流1h,收集到大量气体Y,烧瓶中有红色沉淀生成,同时得到溶液Z。(3)实验小组猜想气体产物Y可能是CO、
 、
、 中的一种。为确定气体成分,利用下列装置验证猜想(已知:CO可将银氨溶液还原成黑色粉末银单质)。
中的一种。为确定气体成分,利用下列装置验证猜想(已知:CO可将银氨溶液还原成黑色粉末银单质)。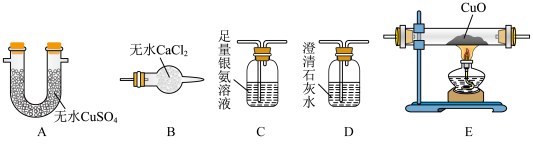
②实验证明气体产物Y为
 ,没有
,没有 和CO,则实验观察到装置A、C、D、E中的现象为
和CO,则实验观察到装置A、C、D、E中的现象为(4)在探究溶液Z中甲醛的氧化产物时,发现未生成
 。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(夹持装置和加热装置已省略,已知:
。为了进一步确定甲醛是否被氧化为HCOONa,进行如图实验(夹持装置和加热装置已省略,已知: )。
)。
A.氧化性 B.强酸性 C.还原性 D.脱水性
②c中银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为
(5)通过定量测定发现,甲醛与新制
 反应中生成的红色沉淀主要为Cu,且Cu的物质的量和气体Y的相等,则该条件下甲醛与新制
反应中生成的红色沉淀主要为Cu,且Cu的物质的量和气体Y的相等,则该条件下甲醛与新制 、NaOH溶液反应生成Cu和气体Y的化学方程式为
、NaOH溶液反应生成Cu和气体Y的化学方程式为(6)甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图所示。国家标准是室内甲醛不能超过
 ,传感器在
,传感器在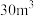 室内空间测定,电路中有
室内空间测定,电路中有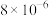 mol电子通过,该室内甲醛含量为
mol电子通过,该室内甲醛含量为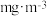 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】2-甲基-2-己醇常用于合成洗涤剂、乳化剂等。实验室制备2-甲基-2-己醇的流程如下:
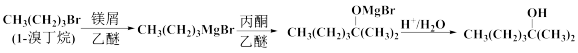
已知:RMgBr化学性质活泼,易与H2O、R'X 等发生反应生成RH、R-R'。
(1)仪器A的名称是___________ 。
(2)引发CH3(CH2)3Br 与镁屑反应可微热或加入米粒大小的碘单质,其中碘的作用可能是_____ ,若镁屑不足,则反应时生成的有机副产物为________ (填结构简式)。
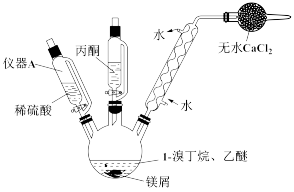
(3) 干燥管中无水氯化钙的作用为__________ 。
(4)加入丙酮及稀硫酸时均需用冰水冷却,这是因为_________ 。
(5)起始加入三颈烧瓶的1-溴丁烷的体积为5 mL,密度为1.28g/mL,最终所得产品的质量为2.71g,则2-甲基-2-己醇的产率为________ 。
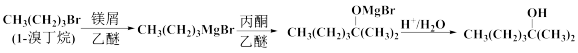
已知:RMgBr化学性质活泼,易与H2O、R'X 等发生反应生成RH、R-R'。
(1)仪器A的名称是
(2)引发CH3(CH2)3Br 与镁屑反应可微热或加入米粒大小的碘单质,其中碘的作用可能是

(3) 干燥管中无水氯化钙的作用为
(4)加入丙酮及稀硫酸时均需用冰水冷却,这是因为
(5)起始加入三颈烧瓶的1-溴丁烷的体积为5 mL,密度为1.28g/mL,最终所得产品的质量为2.71g,则2-甲基-2-己醇的产率为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】物质 是某新型净水剂的中间体,它可以看成由AlCl3(在180℃升华)和一种盐A按物质的量之比1:2组成。在密闭容器中加热X使之完全分解,发生如下转化:
是某新型净水剂的中间体,它可以看成由AlCl3(在180℃升华)和一种盐A按物质的量之比1:2组成。在密闭容器中加热X使之完全分解,发生如下转化:
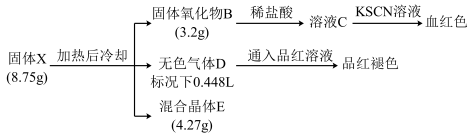
请回答下列问题:
(1)X的化学式为__ 。
(2)将E混合晶体溶于水配成溶液,向溶液中加入过量稀NaOH溶液时发生的总反应的离子方程式为__ 。
(3)高温下,若在密闭容器中长时间煅烧X,产物中还有另外一种气体,请设计实验方案验证之_ 。
 是某新型净水剂的中间体,它可以看成由AlCl3(在180℃升华)和一种盐A按物质的量之比1:2组成。在密闭容器中加热X使之完全分解,发生如下转化:
是某新型净水剂的中间体,它可以看成由AlCl3(在180℃升华)和一种盐A按物质的量之比1:2组成。在密闭容器中加热X使之完全分解,发生如下转化:
请回答下列问题:
(1)X的化学式为
(2)将E混合晶体溶于水配成溶液,向溶液中加入过量稀NaOH溶液时发生的总反应的离子方程式为
(3)高温下,若在密闭容器中长时间煅烧X,产物中还有另外一种气体,请设计实验方案验证之
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
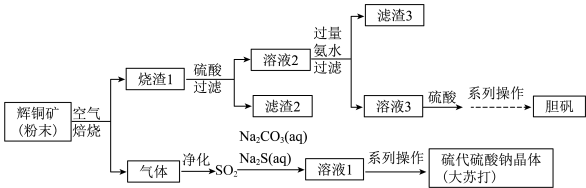
【推荐2】以辉铜矿(主要成分是 Cu2S。含少量 FeS2、FeS、SiO2等)为原料制备胆矾、硫代硫酸钠(Na2S2O3·5H2O)。流程如图所示。 回答下列问题:
(1)焙烧时,粉碎矿石的目的是___________ ;滤渣2的主要成分是___________ (填化学式)。
(2)向Na2S和 Na2CO3的混合溶液中通入SO2制备硫代硫酸钠的化学方程式为___________ 。
(3)某小组探究外界条件对 Na2S2O3相关反应的反应速率的影响,实验方案如下:
已知:① (慢),②
(慢),② (快)。
(快)。
上述反应中,活化能较大的反应是___________ (填“①”或“②”)。下列叙述错误的是___________ (填标号)。
A.在KI-淀粉溶液中滴加过量 Na2S2O3溶液,溶液始终不会变蓝
B.上述方案可以探究浓度对反应速率的影响
C.当n(Na2S2O3):n(K2S2O8)的值小于2时会出现蓝色
(4)检验溶液2中含 Fe2+的试剂可能是___________(填标号)。
(5)25.0 g CuSO4·5H2O受热分解。残留固体的质量与温度的关系如图所示。___________ (填化学式)。
②已知580~1000℃之间产生了两种气体和一种固体,写出发生反应的化学方程式:___________ 。
(1)焙烧时,粉碎矿石的目的是
(2)向Na2S和 Na2CO3的混合溶液中通入SO2制备硫代硫酸钠的化学方程式为
(3)某小组探究外界条件对 Na2S2O3相关反应的反应速率的影响,实验方案如下:
已知:①
 (慢),②
(慢),② (快)。
(快)。| 体积/mL | ||||
| 实验序号 | K2S2O8溶液 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 |
| 1 | 10.0 | 4.0 | 5.0 | 2.0 |
| 2 | 5.0 | 4.0 | 5.0 | 2.0 |
A.在KI-淀粉溶液中滴加过量 Na2S2O3溶液,溶液始终不会变蓝
B.上述方案可以探究浓度对反应速率的影响
C.当n(Na2S2O3):n(K2S2O8)的值小于2时会出现蓝色
(4)检验溶液2中含 Fe2+的试剂可能是___________(填标号)。
| A.KSCN溶液 | B.K3Fe(CN)6溶液 | C.酸性 KMnO4溶液 | D.NaOH 溶液 |

②已知580~1000℃之间产生了两种气体和一种固体,写出发生反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】实验测定H2C2O4·xH2O 中 x值: 已知:M(H2C2O4)=90 g·mol-1
① 称取 1.260 g H2C2O4·xH2O晶体,将其配成100.00 mL 水溶液为待测液;
②量取 25.00mL 待测液放入锥形瓶中,再加入适量的稀H2SO4;
③用20.00ml浓度为 0.05000 mol·L-1的 KMnO4标准溶液进行滴定。
(提示:H2C2O4被氧化为CO2 , KMnO4被还原为MnSO4)
(1)请写出与滴定有关反应的化学方程式______________ 。
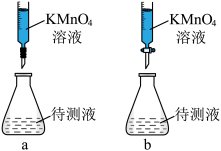
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是_____ (选填 a、b)。
(3)滴定过程中眼睛应注视______________________ 。
(4)通过上述数据,求得x=____________ 。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果______ (偏大、偏小或没有影响)。
① 称取 1.260 g H2C2O4·xH2O晶体,将其配成100.00 mL 水溶液为待测液;
②量取 25.00mL 待测液放入锥形瓶中,再加入适量的稀H2SO4;
③用20.00ml浓度为 0.05000 mol·L-1的 KMnO4标准溶液进行滴定。
(提示:H2C2O4被氧化为CO2 , KMnO4被还原为MnSO4)
(1)请写出与滴定有关反应的化学方程式
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是

(3)滴定过程中眼睛应注视
(4)通过上述数据,求得x=
您最近一年使用:0次



