如表是VIA族部分元素的相关性质。
请回答下列问题:
(l)硒的熔点范围可能是____ 。
(2)碲的化合价可能有____ 。
(3)氢硒酸有较强的____ 填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生反应的化学方程式为____ 。
(4)工业上Al2Te可用来制备H2Te,完成下列化学方程式:___ Al2Te3+___ =2Al(OH)3↓+____ H2Te↑
| 性质/元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点/℃ | -218.4 | 113 | 450 | |
| 单质沸点/℃ | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请回答下列问题:
(l)硒的熔点范围可能是
(2)碲的化合价可能有
(3)氢硒酸有较强的
(4)工业上Al2Te可用来制备H2Te,完成下列化学方程式:
更新时间:2018-10-22 08:34:19
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】根据“机理图”书写方程式。
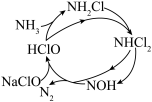
(1)酸性环境中脱硫过程示意图如图:

过程ⅰ反应的离子方程式为___________ 。
(2)酸性环境中,纳米 去除
去除 分两步,将步骤ⅱ补充完整:
分两步,将步骤ⅱ补充完整:___________ 。
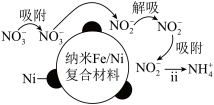
ⅰ、 ;
;
ⅱ、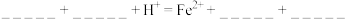 。
。
(3) 氧化可除去氨氮,反应机理如图所示(其中
氧化可除去氨氮,反应机理如图所示(其中 和略去):
和略去): 氧化
氧化 的总反应的化学方程式为
的总反应的化学方程式为___________ 。
(1)酸性环境中脱硫过程示意图如图:

过程ⅰ反应的离子方程式为
(2)酸性环境中,纳米
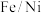 去除
去除 分两步,将步骤ⅱ补充完整:
分两步,将步骤ⅱ补充完整:
ⅰ、
 ;
;ⅱ、
 。
。(3)
 氧化可除去氨氮,反应机理如图所示(其中
氧化可除去氨氮,反应机理如图所示(其中 和略去):
和略去): 氧化
氧化 的总反应的化学方程式为
的总反应的化学方程式为
您最近半年使用:0次
填空题
|
适中
(0.65)
真题
【推荐2】废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是___ (填字母)
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
在H2SO4溶液中Cu 与H2O2反应生成Cu2+和H2O的热化学方程式为:__________ 。
(3)控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1
H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,
其主要原因是_________________________________________ 。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl 溶液,加热,生成
CuCl 的离子方程式是___________________________________ 。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是
| A.热裂解形成燃油 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
在H2SO4溶液中Cu 与H2O2反应生成Cu2+和H2O的热化学方程式为:
(3)控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1
H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol·L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,
其主要原因是
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl 溶液,加热,生成
CuCl 的离子方程式是
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐3】从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
(1)反应Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为_______ ;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是______________ 。
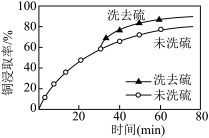
(2)浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化见如图。其原因是_____________ 。
(3)353K时,向FeCl3浸取液中加入CuCl2,能加快铜元素的浸取速率,其反应原理可用化学方程式表示为:________________________________________________________ ,CuCl+FeCl3=CuCl2+FeCl2。
(4)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见如图。转化时正极的电极反应式为______________________________________________________ 。

(1)反应Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为
(2)浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化见如图。其原因是

(3)353K时,向FeCl3浸取液中加入CuCl2,能加快铜元素的浸取速率,其反应原理可用化学方程式表示为:
(4)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见如图。转化时正极的电极反应式为

您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐1】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如表:
(1)X、Y、Q各自形成简单离子,其中离子半径最大的是__ (填离子符号)。
(2)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式___ 。
| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)X、Y、Q各自形成简单离子,其中离子半径最大的是
(2)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
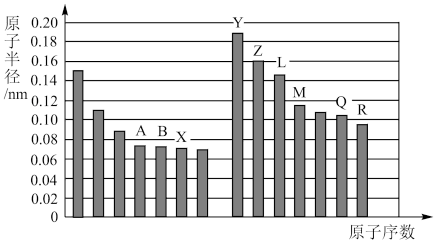
【推荐2】如图是部分短周期主族元素原子半径与原子序数的关系图。
回答下列问题(对应的微粒均用相应的元素符号表示):
(1)写出A在元素周期表中的位置__________ 。比较Z、Q两种元素的简单离子半径大小__________ ;
M的原子结构示意图为__________ ;B单质的电子式为__________ ,B的氢化物空间构型为__________
(2)图中最活泼的金属是__________ ,将其单质在氧气中加热,生成的产物为__________ 。
(3)比较Q、R两种元素的简单气态氢化物的沸点高低__________ ,并从原子结构角度解释其原因________________ ;
(4)B的氢化物在常温下跟R的氢化物混合发生反应的化学方程式为__________ ;现象为__________ 。
(5)设计一个实验方案,比较X、Q单质氧化性的强弱:________ (注明操作、现象及结论)

回答下列问题(对应的微粒均用相应的元素符号表示):
(1)写出A在元素周期表中的位置
M的原子结构示意图为
(2)图中最活泼的金属是
(3)比较Q、R两种元素的简单气态氢化物的沸点高低
(4)B的氢化物在常温下跟R的氢化物混合发生反应的化学方程式为
(5)设计一个实验方案,比较X、Q单质氧化性的强弱:
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐3】下表是元素周期表中的一部分。
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是________ ,氧化性最强的单质是________ ,还原性最强的单质是________ 。
(2)最高价氧化物对应的水化物中,碱性最强的是________ ,酸性最强的是________ ,呈两性的是________ 。
(3)A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是________ 。
(4)在B、C、D、G、I中,原子半径最大的是________ 。
(5)元素C与I形成的化合物的电子式是________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | E | F | H | J | ||||
| 3 | B | C | D | G | I |
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是
(2)最高价氧化物对应的水化物中,碱性最强的是
(3)A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是
(4)在B、C、D、G、I中,原子半径最大的是
(5)元素C与I形成的化合物的电子式是
您最近半年使用:0次



