I 充满HCl(标准状况)的烧瓶做完喷泉实验后得到的稀盐酸溶液,用标准氢氧化钠溶液滴定,以确定该稀盐酸的准确物质的量浓度。回答下列问题:
(1)该滴定实验盛装标准液的仪器是__________ , 若该仪器的量程为50mL,调液面为0,将该仪器中所有液体放出,则放出的溶液体积_______ 50mL。(填“>”,“=”,“<”)
(2)若该滴定实验用酚酞做指示剂,达到滴定终点时,溶液颜色从____ 色变为____ 色且保持30s内不变色。
(3)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第______ 种。
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(4)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
求测得的稀盐酸的物质的量浓度为_________________________ 。
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________ 。
(2)判断滴定终点的方法是______ 。
(3)计算:血液中含钙离子的浓度为____ g·mL-1。
(1)该滴定实验盛装标准液的仪器是
(2)若该滴定实验用酚酞做指示剂,达到滴定终点时,溶液颜色从
(3)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(4)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
| 实验编号 | 待测盐酸的体积(mL) | 滴入氢氧化钠溶液的体积(mL) |
| 1 | 20.00 | 17.30 |
| 2 | 20.00 | 17.02 |
| 3 | 20.00 | 16.98 |
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式
(2)判断滴定终点的方法是
(3)计算:血液中含钙离子的浓度为
更新时间:2018-11-13 16:13:42
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.温度t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,请回答下列问题:
(1)该温度下水的离子积常数Kw=________ 。
(2)该NaOH溶液中NaOH的物质的量浓度为__________ ,该NaOH溶液中由水电离出的c(OH-)为__________ 。
(3)给该NaOH溶液加热时,pH________ (填“变大”、“变小”或“不变”)。
Ⅱ.现用盐酸标准溶液来测定NaOH溶液的浓度。有以下实验操作:
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点
④重复以上操作
⑤配制250 mL盐酸标准溶液
⑥根据实验数据计算氢氧化钠的物质的量浓度
(1)实验过程中正确的操作顺序是______ (填序号),上述操作②中使用的仪器除锥形瓶外,还需要____ ,用________ 作指示剂。
(2)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积V(NaOH)=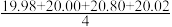 mL=20.20 mL。他的计算
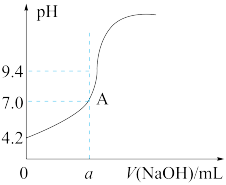
mL=20.20 mL。他的计算________ (填“合理”或“不合理”),理由是________________________ 。通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如图所示,则a________ (填“>”“<”或“=”)20.02。
(1)该温度下水的离子积常数Kw=
(2)该NaOH溶液中NaOH的物质的量浓度为
(3)给该NaOH溶液加热时,pH
Ⅱ.现用盐酸标准溶液来测定NaOH溶液的浓度。有以下实验操作:
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点
④重复以上操作
⑤配制250 mL盐酸标准溶液
⑥根据实验数据计算氢氧化钠的物质的量浓度
(1)实验过程中正确的操作顺序是
(2)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(HCl)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
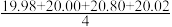 mL=20.20 mL。他的计算
mL=20.20 mL。他的计算
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】硫酸铜的水溶液具有较强的杀灭病原体的能力,可以用于药浴鱼体、消毒渔具、防治鱼病等。某学校课外活动小组欲进行某溶液中硫酸铜浓度的测定,先取25.00 mL,该溶液,向其中加入足量的KI溶液,再加入2滴指示剂,用0.2000 mol/LNa2S2O3标准溶液进行滴定,涉及的反应原理有 ,
, (未配平)。请回答下列问题:
(未配平)。请回答下列问题:
(1)该实验中选择的指示剂的名称是_______ 。
(2)检验盛装Na2S2O3溶液的滴定管不漏液后,接着对该仪器进行一系列操作,正确的操作顺序为洗涤→_______ →滴定(填序号)。
A.烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
(3)进行滴定操作时,用左手操作滴定管,右手摇动锥形瓶,眼睛注视_______ ,滴定至终点的现象是_______ 。
(4)滴定后记录的实验数据如下表,则该溶液中硫酸铜的浓度为_______ mol/L。
(5)下列操作会造成测定结果偏高的是_______(填序号)。
 ,
, (未配平)。请回答下列问题:
(未配平)。请回答下列问题:(1)该实验中选择的指示剂的名称是
(2)检验盛装Na2S2O3溶液的滴定管不漏液后,接着对该仪器进行一系列操作,正确的操作顺序为洗涤→
A.烘干
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.用洗耳球吹出润洗液
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数
(3)进行滴定操作时,用左手操作滴定管,右手摇动锥形瓶,眼睛注视
(4)滴定后记录的实验数据如下表,则该溶液中硫酸铜的浓度为
| 实验编号 | CuSO4 | Na2S2O3溶液浓度 | 消耗Na2S2O3溶液体积 |
| 1 | 25.00 mL | 0.2000 mol/L | 27.50 mL |
| 2 | 25.00 mL | 0.2000 mol/L | 24.80 mL |
| 3 | 25.00 mL | 0.2000 mol/L | 25.20 mL |
| A.滴定终点时俯视读数 | B.滴定管尖嘴内有气泡,滴定后消失 |
| C.锥形瓶水洗后未干燥 | D.标准液漏滴在锥形瓶外1滴 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某研究性学习小组用浓度为0.20 mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。

(1)准确量取一定体积的待测液需要使用的仪器是______________ 。
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为________ mL。
(3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是______________________________ 。
(4)将准确称取的5.0g烧碱样品配制成250mL 待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
由实验数据可知,烧碱的纯度为__________ 。
(5)下列操作会导致测得的待测液的浓度偏大的是________ (填字母)。
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
C.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失

(1)准确量取一定体积的待测液需要使用的仪器是
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为
(3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是
(4)将准确称取的5.0g烧碱样品配制成250mL 待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
滴定次数 | 待测液体积(mL) | 0.20 mol·L-1的盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.70 | 20. 60 |
第一次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.10 | 21.10 |
由实验数据可知,烧碱的纯度为
(5)下列操作会导致测得的待测液的浓度偏大的是
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
C.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】化工中间体呋喃甲酸可由呋喃甲醛(易被氧化)制得,装置如图。已知呋喃甲醛在NaOH溶液中可发生如下反应(反应大量放热)。


制备呋喃甲酸并测定其纯度的步骤:
I.a中加入0.1 mol新蒸馏的呋喃甲醛,b中加入8 mL33%的NaOH溶液。缓慢滴加NaOH溶液,搅拌,在8~12℃回流20 min得粘稠的黄色浆状物。
II.a中的产物倒入盛有约20 mL水的烧杯中,转移至分液漏斗,用乙醚萃取4次。
III.向水层中分批加入25%盐酸,调至pH=3,静置,过滤得呋喃甲酸粗品。
IV.将该粗品用适量水加热溶解,冷却加入活性炭,加热煮沸,趁热减压过滤,将滤液冷却、过滤、洗涤,80~85℃烘干,得呋喃甲酸样品4.8 g。
V.取1.120 g样品,配成100 mL溶液。准确量取20.00 mL于锥形瓶中,滴加指示剂,用0.0800 mol/L氢氧化钾(经邻苯二甲酸氢钾标定)溶液滴定。平行滴定三次,平均消耗氢氧化钾溶液24.80 mL。
回答下列问题:
(1)仪器a的名称是_______ ,与普通分液漏斗相比,仪器b的优点是_______ 。
(2)实验中使用新蒸馏的呋喃甲醛,其原因是_______ 。
(3)实验时要缓慢滴加NaOH溶液,其原因是_______ 。
(4)氢氧化钾溶液需要标定,其原因是_______ 。
(5)制得的呋喃甲酸纯度为_______ 。
(6)呋喃甲醇可通过蒸馏提纯(加热及夹持装置略),所需仪器为_______ (填标号)。



制备呋喃甲酸并测定其纯度的步骤:
I.a中加入0.1 mol新蒸馏的呋喃甲醛,b中加入8 mL33%的NaOH溶液。缓慢滴加NaOH溶液,搅拌,在8~12℃回流20 min得粘稠的黄色浆状物。
II.a中的产物倒入盛有约20 mL水的烧杯中,转移至分液漏斗,用乙醚萃取4次。
III.向水层中分批加入25%盐酸,调至pH=3,静置,过滤得呋喃甲酸粗品。
IV.将该粗品用适量水加热溶解,冷却加入活性炭,加热煮沸,趁热减压过滤,将滤液冷却、过滤、洗涤,80~85℃烘干,得呋喃甲酸样品4.8 g。
V.取1.120 g样品,配成100 mL溶液。准确量取20.00 mL于锥形瓶中,滴加指示剂,用0.0800 mol/L氢氧化钾(经邻苯二甲酸氢钾标定)溶液滴定。平行滴定三次,平均消耗氢氧化钾溶液24.80 mL。
回答下列问题:
(1)仪器a的名称是
(2)实验中使用新蒸馏的呋喃甲醛,其原因是
(3)实验时要缓慢滴加NaOH溶液,其原因是
(4)氢氧化钾溶液需要标定,其原因是
(5)制得的呋喃甲酸纯度为
(6)呋喃甲醇可通过蒸馏提纯(加热及夹持装置略),所需仪器为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
真题
名校
【推荐2】化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。
Ⅰ.用已准确称量的KBrO3固体配制一定体积的a mol·L−1 KBrO3标准溶液;
Ⅱ.取v1 mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入v2 mL废水;
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用b mol·L−1 Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液v3 mL。
已知:I2+2Na2S2O3=2NaI+ Na2S4O6
Na2S2O3和Na2S4O6溶液颜色均为无色
(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和____________ 。
(2)Ⅱ中发生反应的离子方程式是_______________________________ 。
(3)Ⅲ中发生反应的化学方程式是_________________________________ 。
(4)Ⅳ中加KI前,溶液颜色须为黄色,原因是______________________________ 。
(5)KI与KBrO3物质的量关系为n(KI)≥6n(KBrO3)时,KI一定过量,理由是________ 。
(6)Ⅴ中滴定至终点的现象是_____________________________ 。
(7)废水中苯酚的含量为___________ g·L−1(苯酚摩尔质量:94 g·mol −1)。
(8)由于Br2具有____________ 性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。
Ⅰ.用已准确称量的KBrO3固体配制一定体积的a mol·L−1 KBrO3标准溶液;
Ⅱ.取v1 mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入v2 mL废水;
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用b mol·L−1 Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液v3 mL。
已知:I2+2Na2S2O3=2NaI+ Na2S4O6
Na2S2O3和Na2S4O6溶液颜色均为无色
(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和
(2)Ⅱ中发生反应的离子方程式是
(3)Ⅲ中发生反应的化学方程式是
(4)Ⅳ中加KI前,溶液颜色须为黄色,原因是
(5)KI与KBrO3物质的量关系为n(KI)≥6n(KBrO3)时,KI一定过量,理由是
(6)Ⅴ中滴定至终点的现象是
(7)废水中苯酚的含量为
(8)由于Br2具有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃。实验室可用如图装置制取ICl3。

(1)仪器a的名称是___________________ 。
(2)制备氯气选用的药品为漂白粉固体(主要成分为CaClO2)和浓盐酸,相关反应的化学方程式为_______________________________________ 。
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象:____________________________ 。
(4)试剂X为____________________________ 。
(5)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为___________________ 。
(6)欲测定上述实验制备ICl3样品中ICl3的纯度,准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI 晶体,充分反应生成I2(样品中杂质不反应)。写出反应的方程式_________________________ ;将所得溶液配置成100mL待测液,取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32- =2I-+ S4O62-),以淀粉溶液作指示剂,达到终点时的现象为______________________ ;重复滴定,实验数据记录如下:
该样品中ICl3的质量分数为____________________ 。(ICl3相对分子质量为233.5)

(1)仪器a的名称是
(2)制备氯气选用的药品为漂白粉固体(主要成分为CaClO2)和浓盐酸,相关反应的化学方程式为
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象:
(4)试剂X为
(5)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为
(6)欲测定上述实验制备ICl3样品中ICl3的纯度,准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI 晶体,充分反应生成I2(样品中杂质不反应)。写出反应的方程式
| 滴定次数 | 待测液体积(mL) | Na2S2O3标准液体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 1 | 25.00 | 0.50 | 20.40 |
| 2 | 25.00 | 4.00 | 24.10 |
| 3 | 25.00 | 4.20 | 26.70 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1CH3COOH溶液所得滴定曲线如图:
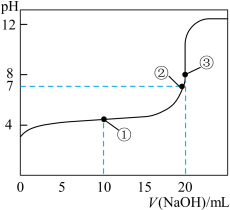
(1)在整个实验过程中,不需要的仪器是______ (填序号).
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
(2)点②所示溶液为中性:c(Na+)________ c(CH3COO-)(填“>”“<”或“=”)。
(3)盛装标准NaOH溶液选择图中滴定管_________ (填标号)。

(4)滴定时边滴边摇动锥形瓶,眼睛应注意观察____________ 。
(5)下列操作会导致测定结果偏低的是______ 。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
Ⅰ、滴定终点的现象是_________________________________ 。
Ⅱ、计算:血液中含钙离子的浓度为______ mol/L。

(1)在整个实验过程中,不需要的仪器是
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
(2)点②所示溶液为中性:c(Na+)
(3)盛装标准NaOH溶液选择图中滴定管

(4)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(5)下列操作会导致测定结果偏低的是
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
Ⅰ、滴定终点的现象是
Ⅱ、计算:血液中含钙离子的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】I. 室温下,某一元弱酸HA的电离常数K=4×10-7。向20.00mL浓度约为0.1mol·L-1HA溶液中逐滴加入0.1000mol·L-1的标准NaOH溶液,其pH变化曲线如图所示:

(1)a点溶液中pH约为___________ 。
(2)a、b、c、d四点中水的电离程度最大的是_______ 点,指示剂选择____________ (“甲基橙”或”酚酞”)
(3)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_______ (填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
Ⅱ.氧化还原滴定实验与酸碱中和滴定类似,用0.03 mol/L高锰酸钾溶液滴定草酸溶液:
滴定数据如下:
(1)写出反应的离子方程式_________________________ 。
(2)如何判断滴定终点_________________________________ 。
(3)该草酸溶液的物质的量浓度为_________ mol/L。

(1)a点溶液中pH约为
(2)a、b、c、d四点中水的电离程度最大的是
(3)滴定过程中部分操作如下,下列各操作使测量结果偏高的是
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
Ⅱ.氧化还原滴定实验与酸碱中和滴定类似,用0.03 mol/L高锰酸钾溶液滴定草酸溶液:
滴定数据如下:
| 滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 2.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
(2)如何判断滴定终点
(3)该草酸溶液的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】“侯氏制碱法”曾为世界制碱工业做出了突出贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3,进一步处理得到产品Na2CO3和NH4Cl,实验流程如图:

(1)侯氏制碱法的化学原理是将CO2通入饱和氨盐水中,该反应的化学方程式为___________ 。
(2)根据上述实验流程用下列仪器制备NaHCO3,正确的连接顺序是___________ (按气流方向,用小写字母表示)。
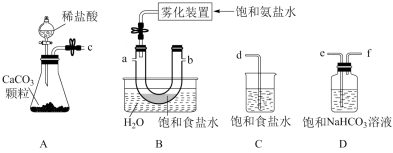
(3)反应完成后,将(2)中装置B的U形管内混合物处理得到滤液和固体NaHCO3:
①向滤液中加入NaCl和乙醇并降温NH4Cl晶体会逐步结晶析出,加入乙醇的目的是___________ 。
②将碳酸氢钠在300°C加热得到碳酸钠所选用的仪器是___________ (填标号);
A、 B、
B、 C、
C、 D、
D、
(4)无水NaHCO3可作为基准物质标定盐酸浓度,应选择指示剂___________ (选填“甲基橙”、“酚酞”、“石蕊”)。称量前,若无水NaHCO3保存不当,吸收了一定量水分,用其做标准液滴定锥形瓶中未知浓度的盐酸浓度时,会使结果___________ (选填“偏高”、“偏低”、“不变”)。
(5)某化学学习小组对产品Na2CO3溶液进行电解,原理如图所示。

该离子交换膜为___________ ( 选填“阳”或“阴”)离子交换膜。阳极的电极反应式为___________ 。

(1)侯氏制碱法的化学原理是将CO2通入饱和氨盐水中,该反应的化学方程式为
(2)根据上述实验流程用下列仪器制备NaHCO3,正确的连接顺序是

(3)反应完成后,将(2)中装置B的U形管内混合物处理得到滤液和固体NaHCO3:
①向滤液中加入NaCl和乙醇并降温NH4Cl晶体会逐步结晶析出,加入乙醇的目的是
②将碳酸氢钠在300°C加热得到碳酸钠所选用的仪器是
A、
 B、
B、 C、
C、 D、
D、
(4)无水NaHCO3可作为基准物质标定盐酸浓度,应选择指示剂
(5)某化学学习小组对产品Na2CO3溶液进行电解,原理如图所示。

该离子交换膜为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】过氧化尿素[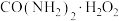 ,无毒无味的白色粉末,易溶于水,水溶液离解为尿素和
,无毒无味的白色粉末,易溶于水,水溶液离解为尿素和 ,45℃以上能分解]是一种新型精细化工产品,也是一种新型的固体消毒剂和氧化剂,其合成原理如下:
,45℃以上能分解]是一种新型精细化工产品,也是一种新型的固体消毒剂和氧化剂,其合成原理如下: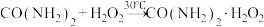 ,实验过程:在三口烧瓶(实验装置如图所示)中加入一定比例的双氧水、尿素和稳定剂,搅拌,固体溶解后,升温至30℃,反应40min,加入包膜剂,继续搅拌10min。然后降温至0℃,结晶3h后,抽滤,将滤饼置于烘箱中,50℃下烘干2h,得到最终的过氧化尿素产品。
,实验过程:在三口烧瓶(实验装置如图所示)中加入一定比例的双氧水、尿素和稳定剂,搅拌,固体溶解后,升温至30℃,反应40min,加入包膜剂,继续搅拌10min。然后降温至0℃,结晶3h后,抽滤,将滤饼置于烘箱中,50℃下烘干2h,得到最终的过氧化尿素产品。
(1)仪器A的名称是___________ 。
(2)过氧化尿素是过氧化氢和尿素的加合产物,二者之间通过___________ (填“配位键”或“氢键”)相结合。
(3)从抽滤后的母液中分离出 和尿素,可采用的操作是___________(填字母)。
和尿素,可采用的操作是___________(填字母)。
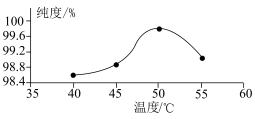
(4)过氧化尿素的纯度与干燥温度的关系如图所示:___________ 。
(5)为测定产品中活性氧的含量,称取干燥样品4.000 g,溶解,在250 mL容量瓶中定容,准确量取25 mL于锥形瓶中,加入2 mL 6.0 mol⋅L-1硫酸,然后用0.1000 mol⋅L-1的KMnO4标准溶液滴定,滴定终点时,消耗KMnO4溶液16.00mL(已知KMnO4溶液与尿素不反应)。
①写出用KMnO4标准溶液滴定时反应的离子方程式:___________ 。
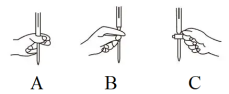
②本实验KMnO4溶液滴定过程中操作滴定管的图示正确的是___________ (填字母)。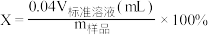 ,根据滴定结果,可确定产品中活性氧的含量为
,根据滴定结果,可确定产品中活性氧的含量为___________ %。
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量___________ (填“偏高”“偏低”或“不变”)。
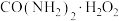 ,无毒无味的白色粉末,易溶于水,水溶液离解为尿素和
,无毒无味的白色粉末,易溶于水,水溶液离解为尿素和 ,45℃以上能分解]是一种新型精细化工产品,也是一种新型的固体消毒剂和氧化剂,其合成原理如下:
,45℃以上能分解]是一种新型精细化工产品,也是一种新型的固体消毒剂和氧化剂,其合成原理如下: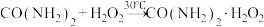 ,实验过程:在三口烧瓶(实验装置如图所示)中加入一定比例的双氧水、尿素和稳定剂,搅拌,固体溶解后,升温至30℃,反应40min,加入包膜剂,继续搅拌10min。然后降温至0℃,结晶3h后,抽滤,将滤饼置于烘箱中,50℃下烘干2h,得到最终的过氧化尿素产品。
,实验过程:在三口烧瓶(实验装置如图所示)中加入一定比例的双氧水、尿素和稳定剂,搅拌,固体溶解后,升温至30℃,反应40min,加入包膜剂,继续搅拌10min。然后降温至0℃,结晶3h后,抽滤,将滤饼置于烘箱中,50℃下烘干2h,得到最终的过氧化尿素产品。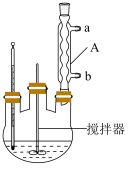
(1)仪器A的名称是
(2)过氧化尿素是过氧化氢和尿素的加合产物,二者之间通过
(3)从抽滤后的母液中分离出
 和尿素,可采用的操作是___________(填字母)。
和尿素,可采用的操作是___________(填字母)。| A.盐析、过滤 | B.减压蒸馏、结晶 | C.分液、过滤 | D.减压蒸馏、萃取 |
(4)过氧化尿素的纯度与干燥温度的关系如图所示:
(5)为测定产品中活性氧的含量,称取干燥样品4.000 g,溶解,在250 mL容量瓶中定容,准确量取25 mL于锥形瓶中,加入2 mL 6.0 mol⋅L-1硫酸,然后用0.1000 mol⋅L-1的KMnO4标准溶液滴定,滴定终点时,消耗KMnO4溶液16.00mL(已知KMnO4溶液与尿素不反应)。
①写出用KMnO4标准溶液滴定时反应的离子方程式:
②本实验KMnO4溶液滴定过程中操作滴定管的图示正确的是
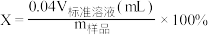 ,根据滴定结果,可确定产品中活性氧的含量为
,根据滴定结果,可确定产品中活性氧的含量为④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】过氧化钙是一种温和的氧化剂,常温下为白色固体,易溶于酸,难溶于水、乙醇等溶剂。
(1)某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙,按气流方向连接顺序为__________________ (填仪器接口的字母编号,装置可重复使用);实验步骤如下:①检验装置的气密性后,装入药品;②打开分液漏斗活塞,通入一段时间气体,加热药品;③反应结束后,先想灭酒精灯,待反应管冷却至室温后,停止通入气体;④拆除装置,取出产物。实验步骤③的操作目的是______________________ 。

(2)利用反应Ca2++H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH ,在碱性环境下制取CaO2·8H2O的装置如下:
,在碱性环境下制取CaO2·8H2O的装置如下:

①仪器C的名称____________ ;反应结束后,经__________ (填操作名称)、洗涤、低温烘干可获得CaO2·8H2O。
②装置A中发生反应的化学方程式为_____________ ;装置B中用冰水浴控制温度,其可能原因是______________________________ 。
③测定产品中CaO2·8H2O的含量的实验步骤如下:
步骤一:准确称取a g产品放入锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴___________ (作指示剂)。
步骤三:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3溶液体积为VmL。则CaO2·8H2O的质量分数为____ (用含字母的式子表示) 。 [已知:I2+2S2O =2I-+ S4O
=2I-+ S4O ]
]
(1)某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙,按气流方向连接顺序为

(2)利用反应Ca2++H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH
 ,在碱性环境下制取CaO2·8H2O的装置如下:
,在碱性环境下制取CaO2·8H2O的装置如下:
①仪器C的名称
②装置A中发生反应的化学方程式为
③测定产品中CaO2·8H2O的含量的实验步骤如下:
步骤一:准确称取a g产品放入锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴
步骤三:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3溶液体积为VmL。则CaO2·8H2O的质量分数为
 =2I-+ S4O
=2I-+ S4O ]
]
您最近一年使用:0次
【推荐3】化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I.摩擦剂中氢氧化铝的定性检验取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是________ 。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是_______ 。
II.牙膏样品中碳酸钙的定量测定
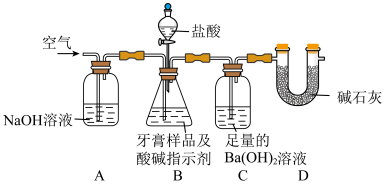
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(3)D装置的作用是__________ 。
(4)下列各项措施中,不能提高测定准确度的是__________ (填标号)。
①在加入盐酸之前,应排净装置内的CO2气体
②滴加盐酸不宜过快
③在A-B之间增添盛有浓H2SO4的洗气装置
④在B-C之间增添盛有饱和NaHCO3溶液的洗气装置
(5)实验中准确称取10.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为__________ 。
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I.摩擦剂中氢氧化铝的定性检验取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是
II.牙膏样品中碳酸钙的定量测定
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(3)D装置的作用是
(4)下列各项措施中,不能提高测定准确度的是
①在加入盐酸之前,应排净装置内的CO2气体
②滴加盐酸不宜过快
③在A-B之间增添盛有浓H2SO4的洗气装置
④在B-C之间增添盛有饱和NaHCO3溶液的洗气装置
(5)实验中准确称取10.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为
您最近一年使用:0次



