碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的 、
、 ,有利于减少
,有利于减少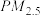 的排放。已知如下信息:
的排放。已知如下信息:
Ⅰ.
Ⅱ.


①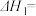
________ 。
②在催化剂作用下 和
和 转化为无毒气体,写出反应的热化学方程式:
转化为无毒气体,写出反应的热化学方程式:____________________________________________________________________________ 。
③一定条件下,单位时间内不同温度下测定的氮氧化物的转化率如图所示。温度高于 时,随温度的升高氮氧化物转化率降低的原因可能是
时,随温度的升高氮氧化物转化率降低的原因可能是_____________________________________________________________________________ 。

(2)测定汽车尾气常用的方法有两种。
①方法1:电化学气敏传感器法。其中 传感器的工作原理如图所示,则工作电极的反应式
传感器的工作原理如图所示,则工作电极的反应式________________________________ 为。

②方法2:氧化还原滴定法。用 溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出
溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:________________ 。
(3)工业上可以用 溶液或氨水吸收过量的
溶液或氨水吸收过量的 ,分别生成
,分别生成 、
、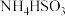 ,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中
,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中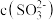 较小的是
较小的是________________ ,用文字和化学用语解释原因: __________________________________________________________________________ 。
(1)消除汽车尾气中的
 、
、 ,有利于减少
,有利于减少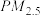 的排放。已知如下信息:
的排放。已知如下信息:Ⅰ.

Ⅱ.



①
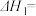
②在催化剂作用下
 和
和 转化为无毒气体,写出反应的热化学方程式:
转化为无毒气体,写出反应的热化学方程式:③一定条件下,单位时间内不同温度下测定的氮氧化物的转化率如图所示。温度高于
 时,随温度的升高氮氧化物转化率降低的原因可能是
时,随温度的升高氮氧化物转化率降低的原因可能是
(2)测定汽车尾气常用的方法有两种。
①方法1:电化学气敏传感器法。其中
 传感器的工作原理如图所示,则工作电极的反应式
传感器的工作原理如图所示,则工作电极的反应式
②方法2:氧化还原滴定法。用
 溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出
溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:(3)工业上可以用
 溶液或氨水吸收过量的
溶液或氨水吸收过量的 ,分别生成
,分别生成 、
、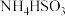 ,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中
,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中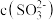 较小的是
较小的是
2018高二·全国·专题练习 查看更多[1]
更新时间:2018-12-02 11:08:09
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ⊿H
CH3OH(g) ⊿H
已知某些化学键的键能数据如下表:
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,该反应的⊿H = ;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
则从反应开始到20min时,以CO表示的平均反应速率= ,该温度下平衡常数K= ,若升高温度则K值 (填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是 ;
A、容器内气体的平均摩尔质量保持不变
B、2v(H2)正=v(CH3OH)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO的同时生成2nmolH2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如右,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l),则负极的电极反应式为 。
 CH3OH(g) ⊿H
CH3OH(g) ⊿H已知某些化学键的键能数据如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,该反应的⊿H = ;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,以CO表示的平均反应速率= ,该温度下平衡常数K= ,若升高温度则K值 (填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是 ;
A、容器内气体的平均摩尔质量保持不变
B、2v(H2)正=v(CH3OH)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO的同时生成2nmolH2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如右,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l),则负极的电极反应式为 。

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】(1) 工业上利用CO2生产甲醇燃料,反应方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。
CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。
①该反应在0-8 min内CO2的平均反应速率为_______ 。
②第12 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和3 mol H2O(g),则v正_____ v逆(填“>”、“<”或“=”)。
③仅改变某一条件再进行实验,测得H2物质的量变化如上图虚线所示。与实线相比,曲线Ⅰ改变的条件可能是______ ,曲线Ⅱ改变的条件可能是________ 。
④在一定温度下,在容积为2L的两个相同密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则z的取值范围为______ 。
(2)①将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_______ 性,该溶液中各离子浓度由大到小的顺序为:________________ ,所得溶液中c(H+)-c(OH-)=___________ (填写表达式)(已知:H2SO3:Ka1=1.7×10﹣2,Ka2=6.0×10﹣8,NH3•H2O:Kb=1.8×10﹣5)
②采用下图装置将SO2转化为重要化工原料。若A为SO2,B为O2,则A为_____ 极,该极电极反应式为_______________ 。
 CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。
CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。
①该反应在0-8 min内CO2的平均反应速率为
②第12 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和3 mol H2O(g),则v正
③仅改变某一条件再进行实验,测得H2物质的量变化如上图虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
④在一定温度下,在容积为2L的两个相同密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物 投入量 | 1molCO2、3molH2 | xmolCO2、ymolH2、zmolCH3OH(g)、zmolH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则z的取值范围为
(2)①将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈
②采用下图装置将SO2转化为重要化工原料。若A为SO2,B为O2,则A为

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO2(g) =CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:____________________________ 。
②方法2:用氢氧化钠溶液将SO2转化为NaHSO3,再氧化为 Na2SO4。实验测得NaHSO3溶液中 = 1500,则溶液的pH为
= 1500,则溶液的pH为______________ (已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g) H2S (g)+CO(g) ΔH>0。
H2S (g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__________ (填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将一定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(g) COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g)
COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g) H2S(g)+ CO(g)的平衡常数K=
H2S(g)+ CO(g)的平衡常数K=__________ 。T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________ 。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为
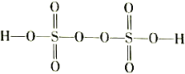 。
。
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为_________ mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________ 。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO2(g) =CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:
②方法2:用氢氧化钠溶液将SO2转化为NaHSO3,再氧化为 Na2SO4。实验测得NaHSO3溶液中
 = 1500,则溶液的pH为
= 1500,则溶液的pH为(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g)
 H2S (g)+CO(g) ΔH>0。
H2S (g)+CO(g) ΔH>0。①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将一定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(g)
 COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g)
COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g) H2S(g)+ CO(g)的平衡常数K=
H2S(g)+ CO(g)的平衡常数K=(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为
 。
。①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】(1)甲醇蒸气转化为氢气的一种原理是CH3OH和H2O反应生成CO2和H2。
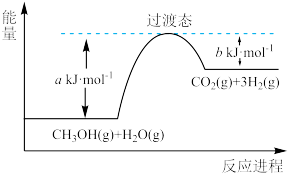
下图是该过程中能量变化示意图。若在反应体系中加入催化剂,反应速率增大,正反应活化能a的变化是_______ (填“增大”、“减小”或“不变”),反应热ΔH的变化是_______ (填“增大”、“减小”或“不变”)。请写出反应进程CH3OH(g)和H2O(g)反应的热化学方程式_______ 。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下4.48 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为_______ ,放出的热量为_______ kJ(用含有a和b的代数式表示)。

下图是该过程中能量变化示意图。若在反应体系中加入催化剂,反应速率增大,正反应活化能a的变化是
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下4.48 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═﹣889.6kJ/mol
请回答下列问题:
(1)反应物能量总和_______ (填“大于”、“小于”或“等于”)生成物能量总和.
(2)若1mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量_______ (填“>”、“<”或“=”)889.6kJ.
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g)═2H2O(l)△H=﹣572kJ/mol,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是________ .
(4)如图所示的装置是由CH4、O2和KOH溶液组成的新型燃料电池.
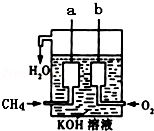
①该电池的负极是________ (填“a”或“b”)电极,该极的电极反应式是_______________ .
②电池工作一段时间后电解质溶液的pH____________ (填“增大”、“减小”或“不变”).
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═﹣889.6kJ/mol
请回答下列问题:
(1)反应物能量总和
(2)若1mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g)═2H2O(l)△H=﹣572kJ/mol,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是
(4)如图所示的装置是由CH4、O2和KOH溶液组成的新型燃料电池.

①该电池的负极是
②电池工作一段时间后电解质溶液的pH
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】火力发电厂释放出大量氮氧化物(NOx)、二氧化硫等气体会造成环境污染,对燃煤废气进行脱除处理.可实现绿色环保、低碳减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为______ 。
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图),则上述CO2转化为甲醇反应的△H3______ 0(填“>”、“<”或“=”)。


②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:0~10min内,氢气的平均反应速率_____ ;第10min后,若升温,将使c(CH3OH)/c(CO2)_____ (填“变大”、“减小”、“不变”);判断理由是_________ ;若向该容器中再充入1molCO2和3molH2,再次达到平衡时,则CH3OH(g)的体积分数将_________ (“变大”、“减小”、“不变”)。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为___________ 。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,配制了pH=8.2的溶液,则该溶液中微粒浓度由小到大的顺序为________________ 。
(1)脱硝。利用甲烷催化还原NOx:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图),则上述CO2转化为甲醇反应的△H3


②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:0~10min内,氢气的平均反应速率
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】甲醇和水蒸气制取H2的反应如下:
反应I(主):CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) ∆H1=+49 kJ/mol
反应II(副):H2(g)+CO2(g) ⇌CO(g)+H2O(g) ∆H2
反应III:CH3OH(g) CO(g)+2H2(g) ∆H3=+90kJ/mol
CO(g)+2H2(g) ∆H3=+90kJ/mol
(1)△H2=___ 。
(2)下列有关反应I的说法不正确的是___ 。(填选项序号)
a.恒温、恒压条件下,在反应体系中充入He,平衡不移动
b.恒温、恒容条件下,容器内的压强不发生变化反应达到平衡
c.反应达平衡时,H2的消耗速率是CO2 的消耗速率的3 倍
d.温度不变,减小压强,逆反应速率减小,正反应速率增大,平衡向正反应方向移动
(3)在一体积不变的密闭容器中,充入2.0 mol CH3OH(g)和1.0molH2O(g),达平衡后,再加入1.0mol CH3OH(g)和0.5mol H2O(g),平衡向___ 移动。在相同温度下,再达平衡时,甲醇的转化率___ (填“增大”“ 减小”或“不变”)。
(4)催化剂不仅可以改变化学反应速率,还有一种特性叫“催化剂的选择性”。下图为某催化剂作用下,CH3OH 转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率与平衡状态生成率相差较大的原因是催化剂对___ (填“反应I”或“反应II”)的选择性低。
②写出一条能提高CH3OH转化率而降低CO生成率的措施___ 。
(5)250℃,一定压强和催化剂条件下,在1L的容器中1.00mol CH3OH 和1.32 mol H2O充分反应(忽略反应III),平衡时测得H2 为2.70mol,CO为0.030mol,H2O为0.44mol,列式计算反应II的平衡常数K=___ (结果保留两位有效数字)。
反应I(主):CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) ∆H1=+49 kJ/mol
反应II(副):H2(g)+CO2(g) ⇌CO(g)+H2O(g) ∆H2
反应III:CH3OH(g)
 CO(g)+2H2(g) ∆H3=+90kJ/mol
CO(g)+2H2(g) ∆H3=+90kJ/mol(1)△H2=
(2)下列有关反应I的说法不正确的是
a.恒温、恒压条件下,在反应体系中充入He,平衡不移动
b.恒温、恒容条件下,容器内的压强不发生变化反应达到平衡
c.反应达平衡时,H2的消耗速率是CO2 的消耗速率的3 倍
d.温度不变,减小压强,逆反应速率减小,正反应速率增大,平衡向正反应方向移动
(3)在一体积不变的密闭容器中,充入2.0 mol CH3OH(g)和1.0molH2O(g),达平衡后,再加入1.0mol CH3OH(g)和0.5mol H2O(g),平衡向
(4)催化剂不仅可以改变化学反应速率,还有一种特性叫“催化剂的选择性”。下图为某催化剂作用下,CH3OH 转化率、CO生成率与温度的变化关系。

①随着温度的升高,CO的实际反应生成率与平衡状态生成率相差较大的原因是催化剂对
②写出一条能提高CH3OH转化率而降低CO生成率的措施
(5)250℃,一定压强和催化剂条件下,在1L的容器中1.00mol CH3OH 和1.32 mol H2O充分反应(忽略反应III),平衡时测得H2 为2.70mol,CO为0.030mol,H2O为0.44mol,列式计算反应II的平衡常数K=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·molˉl
C(s)+O2(g)=CO2(g) △H=―393.5 kJ·molˉl
2C(s)+O 2(g)=2CO(g) △H=―221kJ·molˉl 若某反应的平衡常数表达式为: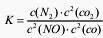 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式 ______________________________ 。
(2)N2O5在一定条件下可发生分解:2N2O5(g) 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
① 反应开始时体系压强为P0,第3.00 min时体系压强为p1,则p1:p0=_____________ ;2.00min~5.00 min内,O2的平均反应速率为 _______________ 。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是______________ 。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g) 2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。

如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=________ (小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入氢氧化钠的物质的量________ mol(保留两位有效数字)。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·molˉl
C(s)+O2(g)=CO2(g) △H=―393.5 kJ·molˉl
2C(s)+O 2(g)=2CO(g) △H=―221kJ·molˉl 若某反应的平衡常数表达式为:
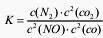 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式 (2)N2O5在一定条件下可发生分解:2N2O5(g)
 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
① 反应开始时体系压强为P0,第3.00 min时体系压强为p1,则p1:p0=
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g)
 2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入氢氧化钠的物质的量
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】工业上常用CO和H2合成甲醇,反应方程式为:
CO (g) +2H2(g) CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
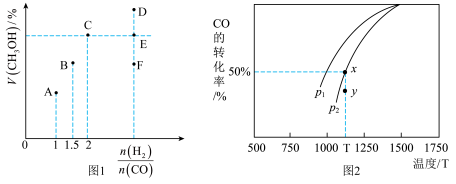
(1)当起始n (H2):n(CO) =2,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率v(H2)=____ 。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH (g),达新平衡时H2的转化率将_______ (选填“增大”、“减小”或“不变”)。
(2)当起始n (H2):n(CO) =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_____ 点(选填“D”、“E”或“F”)。
(3)由图2可知该反应的△H_____ 0(选填“>”、“<”或“=”,下同),压强pl____ p2;当压强为p2时,在y点:v(正)____ v(逆)。
CO (g) +2H2(g)
 CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
(1)当起始n (H2):n(CO) =2,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率v(H2)=
(2)当起始n (H2):n(CO) =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
(3)由图2可知该反应的△H
您最近一年使用:0次



