Ⅰ. A、B、C、D、E均为中学化学常见的纯净物,B为最常见的液体,它们之间有如下反应关系:
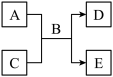
(1)若A为短周期的金属单质,D为气态单质,0.1 mol/L-1 C溶液的pH=13,则该反应的离子方程式为____________ 。
(2)若A的水溶液能使淀粉溶液变蓝,C为非金属氧化物,且能使品红溶液褪色,则该反应的化学方程式为___________ 。
(3)若A、C、D、E均为化合物,E为白色絮状沉淀,且A、C、E均含有同一种元素,则该反应的离子方程式为___________ 。
Ⅱ.
(4)二氧化氯是目前国际上公认的第四代高效、无毒的光谱消毒剂,它可由KClO3和H2SO4存在下与Na2SO3反应制得。请写出该反应的离子反应方程式:___________ 。
(5)过碳酸钠是一种有多种用途的新型氧系固定漂白剂,化学式可表示为Na2CO3∙3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是_________ 。
A. MnO2 B. KMnO4溶液 C. 稀盐酸 D. Na2SO3溶液

(1)若A为短周期的金属单质,D为气态单质,0.1 mol/L-1 C溶液的pH=13,则该反应的离子方程式为
(2)若A的水溶液能使淀粉溶液变蓝,C为非金属氧化物,且能使品红溶液褪色,则该反应的化学方程式为
(3)若A、C、D、E均为化合物,E为白色絮状沉淀,且A、C、E均含有同一种元素,则该反应的离子方程式为
Ⅱ.
(4)二氧化氯是目前国际上公认的第四代高效、无毒的光谱消毒剂,它可由KClO3和H2SO4存在下与Na2SO3反应制得。请写出该反应的离子反应方程式:
(5)过碳酸钠是一种有多种用途的新型氧系固定漂白剂,化学式可表示为Na2CO3∙3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是
A. MnO2 B. KMnO4溶液 C. 稀盐酸 D. Na2SO3溶液
更新时间:2019-01-04 16:58:15
|
相似题推荐
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐1】草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3, A12O3, CaO,MgO,碳及有机物等)制取CoC2O4的工艺流程如图:
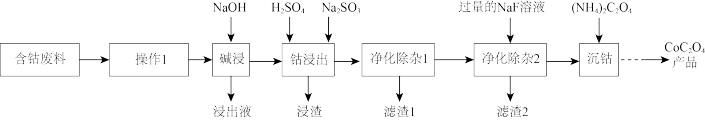
(1)操作1的目的是除去废料中的碳及有机物,通常采用的方法是_______ 。
(2)碱浸过程中,主要反应的离子方程式是_______ 。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_______ 。
(4)“净化除杂1”过程中,先在40~50°C加入足量的H2O2,其作用是_______ ;再升温至80~85°C,加入Na2CO3溶液,调pH至4.5,“滤渣I”主要成分是_______ 。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Mg2+)=1. 0×10 −5 mol∙L−1,则滤液中c(Ca2+)为_______ mol∙L−1 [已知Ksp (MgF2)=6.4×10−9、Ksp(CaF2)=4. 0×10−11];
(6)为测定制得样品的纯度,现称取1. 00g样品,将其用适当试剂转化,得到草酸铵[ (NH4) 2C2O4]为测定产品的纯度,将1g产品用适当试剂转化,得到草酸铵[ (NH4) 2C2O4]溶液。已知NH3·H2O的Kb=1.76× 10−5;H2C2O4的Ka1=5.9×10−2,Ka2=6. 4×10−5。判断(NH4) 2C2O4溶液呈_______ (填 “酸性”、“碱性” 或“中性”)。将草酸钴溶液用过量稀硫酸酸化,用0. 1000 mol∙L−1 KMnO4液滴定,可测定产品的纯度。

(1)操作1的目的是除去废料中的碳及有机物,通常采用的方法是
(2)碱浸过程中,主要反应的离子方程式是
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为
(4)“净化除杂1”过程中,先在40~50°C加入足量的H2O2,其作用是
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Mg2+)=1. 0×10 −5 mol∙L−1,则滤液中c(Ca2+)为
(6)为测定制得样品的纯度,现称取1. 00g样品,将其用适当试剂转化,得到草酸铵[ (NH4) 2C2O4]为测定产品的纯度,将1g产品用适当试剂转化,得到草酸铵[ (NH4) 2C2O4]溶液。已知NH3·H2O的Kb=1.76× 10−5;H2C2O4的Ka1=5.9×10−2,Ka2=6. 4×10−5。判断(NH4) 2C2O4溶液呈
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】KI淀粉溶液在酸性条件下能与氧气反应。现有以下实验记录:
回答下列问题:
(1)该反应的离子方程式为___________ 。
(2)该实验的目的是___________ 。
(3)实验试剂除了1 KI溶液、0.1
KI溶液、0.1 H2SO4溶液外,还需要的试剂是
H2SO4溶液外,还需要的试剂是___________ ,实验现象为___________ 。
(4)实验操作中除了需要上述条件外,还必须控制___________ (填字母)不变。
A.温度B.试剂的用量(体积)C.试剂添加的顺序
(5)由上述实验记录可得出的结论是___________ 。
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的实验方案是___________ 。
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(1)该反应的离子方程式为
(2)该实验的目的是
(3)实验试剂除了1
 KI溶液、0.1
KI溶液、0.1 H2SO4溶液外,还需要的试剂是
H2SO4溶液外,还需要的试剂是(4)实验操作中除了需要上述条件外,还必须控制
A.温度B.试剂的用量(体积)C.试剂添加的顺序
(5)由上述实验记录可得出的结论是
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的实验方案是
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐3】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)制取MnSO4∙H2O并回收单质硫的工艺流程如下:

已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是_______ ;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_______ 。
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入_______ ;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4-5,再继续煮沸一段时间,“继续煮沸”的目的是______ 。步骤⑤所得滤渣为_______ (填化学式)。
(3)步骤⑦需在90-100℃下进行,该反应的化学方程式________ 。
(4)测定产品MnSO4∙H2O的方法之一是:准确称取ag产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用cmol∙L-1KMnO4标准溶液滴定,确定达到滴定终点的标志是_______ 。若消耗标准溶液VmL,则产品中Mn2+的质量分数为ω(Mn2+)=________ 。

已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入
(3)步骤⑦需在90-100℃下进行,该反应的化学方程式
(4)测定产品MnSO4∙H2O的方法之一是:准确称取ag产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用cmol∙L-1KMnO4标准溶液滴定,确定达到滴定终点的标志是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐1】A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)。
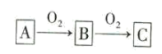
(1)若A是一种黄色固体单质,则B→C的化学方程式为___________ 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为___________ ,试用化学方程式表示该物质与水的反应:___________ 。将C长期露置于空气中,最后将变成物质D,D的化学式为___________ 。

(1)若A是一种黄色固体单质,则B→C的化学方程式为
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】A、B、C、D、E为中学化学常见物质,其中均含同一种金属元素。A为单质,C可用作呼吸面具中的供氧剂,B、E的溶液 均大于7,五种物质之间的转化关系如图所示。请回答下列问题:
均大于7,五种物质之间的转化关系如图所示。请回答下列问题:
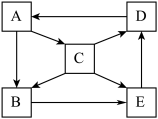
(1) 的化学方程式是
的化学方程式是_______ 。
(2)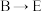 的离子方程式是
的离子方程式是_______ 。
(3) 的化学方程式是
的化学方程式是_______ 。
(4)D的化学式是_______ 。
 均大于7,五种物质之间的转化关系如图所示。请回答下列问题:
均大于7,五种物质之间的转化关系如图所示。请回答下列问题:
(1)
 的化学方程式是
的化学方程式是(2)
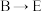 的离子方程式是
的离子方程式是(3)
 的化学方程式是
的化学方程式是(4)D的化学式是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)硫酸是一种重要的化工产品。在实验室中,向蔗糖中加入浓硫酸会产生“黑面包”现象并有难闻气味,其中产生难闻气味体现了浓硫酸的___________ (填“强氧化性”“吸水性”或“脱水性”)。
(2)由上图,可知A为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有___________ ;在催化剂作用下CO跟NO反应生成两种无毒气体的化学方程式为___________ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层,发生反应的化学方程式为___________ 。
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:___________ 。
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2,取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的离子方程式:___________ 。

(1)硫酸是一种重要的化工产品。在实验室中,向蔗糖中加入浓硫酸会产生“黑面包”现象并有难闻气味,其中产生难闻气味体现了浓硫酸的
(2)由上图,可知A为
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层,发生反应的化学方程式为
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。常用的方法是先用热空气吹出Br2,再用SO2水溶液吸收Br2,取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2水溶液吸收Br2反应的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】在实验室探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器和I中酒精灯已略去)。
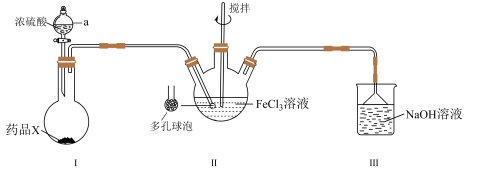
(1)仪器a的名称是________ 。
(2)装置III倒扣漏斗的作用是_________ 。
(3)装置I烧瓶中放入的药晶X为铜片,其发生反应的化学方程式为_______ ;反应过程中,烧瓶中观察到的现象是________ 。
(4)装置II中用“多孔球泡”的作用是________ 。
(5)装置II中反应的离子方程式为________ 。

(1)仪器a的名称是
(2)装置III倒扣漏斗的作用是
(3)装置I烧瓶中放入的药晶X为铜片,其发生反应的化学方程式为
(4)装置II中用“多孔球泡”的作用是
(5)装置II中反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐1】中学常见单质A、B和甲、乙、丙三种化合物有如图所示的转化关系(部分产物未列出)。单质A常作为食品包装材料,甲是两性氧化物。

根据图示转化关系回答下列问题:
(1)写出下列物质的化学式:A_______ ,乙_______ 。
(2)写出单质A与Fe2O3反应的化学方程式:_______ ,利用该反应的原理,可用于_______ 。
(3)用单质A做成的容器可以储存和运输浓硫酸的原因是_______ 。
(4)写出反应①的离子方程式:_______ 。
(5)工业上冶炼下列物质通常不采用电解法的是_______ (填字母,下同)。
a.Na b.Mg c.Fe d.Ag
(6)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有_______ 。
a.KCl b.KClO3 c.MnO2 d.Mg

根据图示转化关系回答下列问题:
(1)写出下列物质的化学式:A
(2)写出单质A与Fe2O3反应的化学方程式:
(3)用单质A做成的容器可以储存和运输浓硫酸的原因是
(4)写出反应①的离子方程式:
(5)工业上冶炼下列物质通常不采用电解法的是
a.Na b.Mg c.Fe d.Ag
(6)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有
a.KCl b.KClO3 c.MnO2 d.Mg
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】现有三种金属单质A、B、C,其中A灼烧时火焰呈黄色,B、C是常见的金属单质。A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间有如下转化关系(图中有些反应产物和反应条件已略去)。请回答下列问题:

(1)写出气体乙的化学式:_______ ;试剂X可能是_______ (填序号)。
A.Cl2 B.双氧水 C.Fe D.KI溶液
(2)写出反应②的离子方程式:_______ 。
(3)写出金属A与水反应的离子方程式:_______ 。
(4)溶液F与溶液D反应的产物在空气中转化为H的化学方程式为_______ 。产生的现象为_______ 。

(1)写出气体乙的化学式:
A.Cl2 B.双氧水 C.Fe D.KI溶液
(2)写出反应②的离子方程式:
(3)写出金属A与水反应的离子方程式:
(4)溶液F与溶液D反应的产物在空气中转化为H的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】铝和铁是生活中常见的两种金属。
(1)用铝箔包住金属钠,用针在铝箔上刺些小孔,用镊子夹住放入水中,可能发生反应的化学方程式表示为___________ 和___________ 。
(2)在高温下,Fe与水蒸气可发生反应。应用下图装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。

①写出该反应的化学方程式并用双线桥标出电子转移的方向和数目:___________ 。
②烧瓶底部放置了几片碎瓷片,碎瓷片的作用是___________ 。
③酒精灯和酒精喷灯首先点燃的是___________ 。
④现欲将5.6gFe完全溶解在稀硫酸中,加水后得200mL溶液。所得硫酸亚铁溶液的物质的量浓度是___________ ,反应中转移的电子数是___________ 。
(1)用铝箔包住金属钠,用针在铝箔上刺些小孔,用镊子夹住放入水中,可能发生反应的化学方程式表示为
(2)在高温下,Fe与水蒸气可发生反应。应用下图装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。

①写出该反应的化学方程式并用双线桥标出电子转移的方向和数目:
②烧瓶底部放置了几片碎瓷片,碎瓷片的作用是
③酒精灯和酒精喷灯首先点燃的是
④现欲将5.6gFe完全溶解在稀硫酸中,加水后得200mL溶液。所得硫酸亚铁溶液的物质的量浓度是
您最近一年使用:0次







