海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。
I.(1)海水中所得粗盐中通常含Ca2+、Mg2+、SO42-等杂质,为了得到精盐,下列试剂加入的先后顺序正确的是________ 。
A.BaCl2→Na2CO3→NaOH→HCl B.NaOH→BaCl2→Na2CO3→HCl
C.BaCl2→NaOH→Na2CO3→HCl D. Na2CO3→NaOH→BaCl2→HCl
(2)为了检验精盐中是否含有SO42-,正确的方法是____________________________ 。
II.海藻中提取碘的流程如图所示
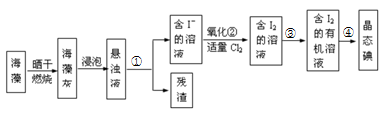
(1)灼烧过程中,需使用到的(除泥三角外)实验仪器有______ 。
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯 F.三脚架
(2)指出提取碘的过程中有关实验操作名称:①________ ③__________ ④_________ 。
(3)步骤②反应的离子方程式为___________________ ,该过程氧化剂也可以用H2O2,将等物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为__________ 。
(4)下列关于海藻提取碘的说法,正确的是_________ 。
A.含碘的有机溶剂呈现紫红色
B.操作③中先放出下层液体,然后再从下口放出上层液体
C.操作④时,温度计的水银球应伸入液面以下但不能触碰到蒸馏烧瓶的底部
I.(1)海水中所得粗盐中通常含Ca2+、Mg2+、SO42-等杂质,为了得到精盐,下列试剂加入的先后顺序正确的是
A.BaCl2→Na2CO3→NaOH→HCl B.NaOH→BaCl2→Na2CO3→HCl
C.BaCl2→NaOH→Na2CO3→HCl D. Na2CO3→NaOH→BaCl2→HCl
(2)为了检验精盐中是否含有SO42-,正确的方法是
II.海藻中提取碘的流程如图所示

(1)灼烧过程中,需使用到的(除泥三角外)实验仪器有
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯 F.三脚架
(2)指出提取碘的过程中有关实验操作名称:①
(3)步骤②反应的离子方程式为
(4)下列关于海藻提取碘的说法,正确的是
A.含碘的有机溶剂呈现紫红色
B.操作③中先放出下层液体,然后再从下口放出上层液体
C.操作④时,温度计的水银球应伸入液面以下但不能触碰到蒸馏烧瓶的底部
18-19高一上·山西长治·期末 查看更多[4]
山西省长治市第二中学2018-2019学年高一上学期期末考试化学试题【全国百强校】四川省成都外国语学校2018-2019学年高一下学期入学考试化学试题(已下线)2019年6月29日 《每日一题》必修2—— 押题6 化学生产工艺流程分析甘肃省武威市第六中学2018-2019学年高二下学期第三次学段考试化学试题
更新时间:2019-02-04 08:46:28
|
相似题推荐
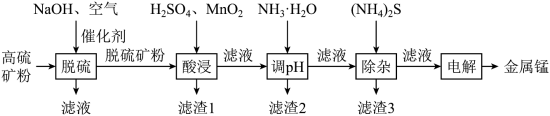
【推荐1】一种高硫锰矿的主要成分为 ,主要杂质为
,主要杂质为 ,还含有少量
,还含有少量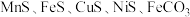 等,其中
等,其中 含量较大。研究人员设计了如下流程,制得了金属锰。
含量较大。研究人员设计了如下流程,制得了金属锰。
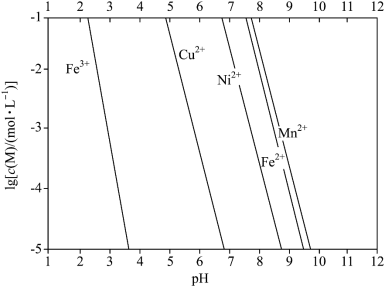
已知:①金属离子的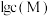 与溶液
与溶液 的关系如下图所示。
的关系如下图所示。
②金属硫化物的溶度积常数如下表。
回答下列问题。
(1)碱性溶液中,在催化剂存在下通空气氧化脱硫,硫化物中的硫元素被氧化为单质。写出硫化亚铁发生反应的化学方程式___________ 。
(2)根据矿物组成,脱硫时能被 部分溶解的物质是
部分溶解的物质是___________ 。若未经脱硫直接酸浸,会产生的污染物是___________ 。
(3)酸浸时,加入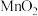 的作用是
的作用是___________ (用离子方程式表示)。
(4)调溶液 到5左右,滤渣2的主要成分是
到5左右,滤渣2的主要成分是___________ ;加入适量的 除去的主要离子是
除去的主要离子是___________ 。
(5)除杂后的 溶液通过电解制得金属锰,惰性阳极发生的电极反应为
溶液通过电解制得金属锰,惰性阳极发生的电极反应为___________ 。
(6)请写出基态Mn原子的价层电子排布式___________ ;锰的化合物 是一种锂电池材料,其晶胞中的氧原子以面心立方堆积(如图),若该晶胞参数为a pm,则晶体密度为
是一种锂电池材料,其晶胞中的氧原子以面心立方堆积(如图),若该晶胞参数为a pm,则晶体密度为___________  。
。

 ,主要杂质为
,主要杂质为 ,还含有少量
,还含有少量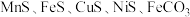 等,其中
等,其中 含量较大。研究人员设计了如下流程,制得了金属锰。
含量较大。研究人员设计了如下流程,制得了金属锰。
已知:①金属离子的
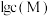 与溶液
与溶液 的关系如下图所示。
的关系如下图所示。
②金属硫化物的溶度积常数如下表。
| 金属硫化物 |  |  |  |  |
 |  | 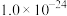 | 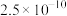 |  |
(1)碱性溶液中,在催化剂存在下通空气氧化脱硫,硫化物中的硫元素被氧化为单质。写出硫化亚铁发生反应的化学方程式
(2)根据矿物组成,脱硫时能被
 部分溶解的物质是
部分溶解的物质是(3)酸浸时,加入
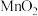 的作用是
的作用是(4)调溶液
 到5左右,滤渣2的主要成分是
到5左右,滤渣2的主要成分是 除去的主要离子是
除去的主要离子是(5)除杂后的
 溶液通过电解制得金属锰,惰性阳极发生的电极反应为
溶液通过电解制得金属锰,惰性阳极发生的电极反应为(6)请写出基态Mn原子的价层电子排布式
 是一种锂电池材料,其晶胞中的氧原子以面心立方堆积(如图),若该晶胞参数为a pm,则晶体密度为
是一种锂电池材料,其晶胞中的氧原子以面心立方堆积(如图),若该晶胞参数为a pm,则晶体密度为 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】己二酸在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,实验室常用环己醇来制备,其反应原理如下:

 KOOC(CH2)4COOK
KOOC(CH2)4COOK HOOC(CH2)4COOH
HOOC(CH2)4COOH
KMnO4在碱性环境中被环己醇还原成MnO2。
实验步骤:
①在250mL三口烧瓶中加入50mL0.3mol/LKOH溶液和6.0g高锰酸钾,按如图所示安装装置。

②开电磁搅拌器,水浴升温至35℃使之溶解。控制滴速滴加环己醇2.1mL,维持反应温度在43℃~47℃。
③反应完成后,将混合物用沸水浴加热8min使难溶物凝聚。
④趁热过滤,滤渣用少量热水洗涤几次,每次洗涤后都尽量压干水分。
⑤滤液倒入100ml烧杯中用浓盐酸酸化至pH为2~4,小火加热蒸发滤液至20ml左右。冷却析出晶体,抽滤、干燥、称重得产品1.82g。
⑥纯度测定:称取1.500粗产品,配成100ml乙醇溶液。每次取25.00ml溶液,用0.200mol/L的NaOH标准溶液滴定,三次平均消耗25.00ml标准溶液。
回答下列问题:
(1)A的名称是___________ 。
(2)实验时,发现环己醇的黏性太强,分液漏斗中残留过多从而导致产率较低,可以向环己醇中加入___________ (填“水”或“乙醇”)稀释从而降低黏性。
(3)步骤③发现溶液呈浅红色,可向溶液中加入适量的NaHSO3,对应反应的离子方程式为___________ 。
(4)步骤④趁热过滤的目的是___________ 。
(5)本实验制备的己二酸的纯度为___________ (保留3位有效数值)。

 KOOC(CH2)4COOK
KOOC(CH2)4COOK HOOC(CH2)4COOH
HOOC(CH2)4COOHKMnO4在碱性环境中被环己醇还原成MnO2。
| 名称 | 相对分子质量 | 密度/(g/mL) | 熔点/℃ | 沸点/℃ | 溶解度/g/100gH2O |
| 环己醇 | 100 | 0.96 | 24 | 161.8 | 3.6 |
| 己二酸 | 146 | 1.36 | 152 | 300.5(分解) | 1.5 |
①在250mL三口烧瓶中加入50mL0.3mol/LKOH溶液和6.0g高锰酸钾,按如图所示安装装置。

②开电磁搅拌器,水浴升温至35℃使之溶解。控制滴速滴加环己醇2.1mL,维持反应温度在43℃~47℃。
③反应完成后,将混合物用沸水浴加热8min使难溶物凝聚。
④趁热过滤,滤渣用少量热水洗涤几次,每次洗涤后都尽量压干水分。
⑤滤液倒入100ml烧杯中用浓盐酸酸化至pH为2~4,小火加热蒸发滤液至20ml左右。冷却析出晶体,抽滤、干燥、称重得产品1.82g。
⑥纯度测定:称取1.500粗产品,配成100ml乙醇溶液。每次取25.00ml溶液,用0.200mol/L的NaOH标准溶液滴定,三次平均消耗25.00ml标准溶液。
回答下列问题:
(1)A的名称是
(2)实验时,发现环己醇的黏性太强,分液漏斗中残留过多从而导致产率较低,可以向环己醇中加入
(3)步骤③发现溶液呈浅红色,可向溶液中加入适量的NaHSO3,对应反应的离子方程式为
(4)步骤④趁热过滤的目的是
(5)本实验制备的己二酸的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】榴石矿石可以看作由CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如图:

(1)SiO2的用途广泛,试写出其中的一种重要用途______ ;
(2)溶液Ⅰ中除了Ca2+外,还含有的金属阳离子有_________ ;
(3)鼓入空气并充分搅拌的目的是_______ ,发生反应的化学方程式为_________ 。
(4)工业上制取Al的反应方程式为_______ 。
(5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)________ 。

(1)SiO2的用途广泛,试写出其中的一种重要用途
(2)溶液Ⅰ中除了Ca2+外,还含有的金属阳离子有
(3)鼓入空气并充分搅拌的目的是
(4)工业上制取Al的反应方程式为
(5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。
(1)利用海水可以提取溴和镁,提取过程如下:

①提取溴的过程中,经过2次Br- → Br2转化的目的是_____ ,吸收塔中发生反应的离子方程式是________ ,
②从MgCl2溶液中得到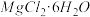 晶体的主要操作是
晶体的主要操作是______ 、______ 、过滤、洗涤、干燥。
(2)
①灼烧过程中用到的实验仪器有铁三角架、酒精灯、坩埚钳、_____ 、______ 。
②操作①中需用到玻璃棒,则玻璃棒的作用是_______________ 。
③向酸化后的水溶液加入适量3% H2O2溶液,发生反应的化学方程式为________ 。
④操作③是分液,则操作②是___________ ;操作④是___________
(1)利用海水可以提取溴和镁,提取过程如下:

①提取溴的过程中,经过2次Br- → Br2转化的目的是
②从MgCl2溶液中得到
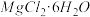 晶体的主要操作是
晶体的主要操作是(2)

①灼烧过程中用到的实验仪器有铁三角架、酒精灯、坩埚钳、
②操作①中需用到玻璃棒,则玻璃棒的作用是
③向酸化后的水溶液加入适量3% H2O2溶液,发生反应的化学方程式为
④操作③是分液,则操作②是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,步骤③和步骤⑥该步骤的实验操作名称分别是________ 、________ .
(2)步骤④反应的离子方程式是________ .步骤④中的转化还可以双氧水(H2O2),请写出反应的离子方程式:________ .
(3)步骤⑤中,某学生选择用苯来提取碘的理由是________ .
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:________ .

请填写下列空白:
(1)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,步骤③和步骤⑥该步骤的实验操作名称分别是
(2)步骤④反应的离子方程式是
(3)步骤⑤中,某学生选择用苯来提取碘的理由是
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】我国卤水锂资源占锂资源总量的79%,是世界锂资源储量最大的国家之一,某盐湖卤水(Li、Mg、B、Na、Cl含量较多)制备碳酸锂技术流程如下:
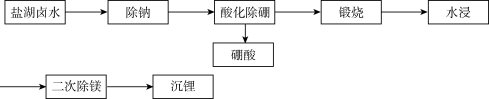
(1)盐湖卤水提取粗盐一般采取__________ 方法。
(2)已知H3BO3的Ka=5.81×10-10,请类比NH3·H2O的电离写出H3BO3的电离方程式__________ 。
(3)酸化除硼后的溶液需__________ 处理,煅烧产生的__________ 气体用水吸收得到一种强酸副产品。
(4)已知某温度下,Mg(OH)2的溶解度为5.8×10-4g,则Ksp[Mg(OH)2]=__________ mol3·L3。
(5)若沉锂选择用氨水—NH4HCO3混合溶液,发生反应的离子方程式为__________ ,请分析选用碳酸钠溶液做沉淀剂的缺点__________ 。

(1)盐湖卤水提取粗盐一般采取
(2)已知H3BO3的Ka=5.81×10-10,请类比NH3·H2O的电离写出H3BO3的电离方程式
(3)酸化除硼后的溶液需
| 某温度下 | Mg(OH)2 | MgCO3 | LiOH | Li2CO3 |
| Ksp=6.8×10-6 | S=10g | Ksp=1.7×10-3 |
(4)已知某温度下,Mg(OH)2的溶解度为5.8×10-4g,则Ksp[Mg(OH)2]=
(5)若沉锂选择用氨水—NH4HCO3混合溶液,发生反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某化学兴趣小组的同学通过以下步骤提取海带中的碘:
①将海带晒干灼烧成灰 ②将海带浸泡得其悬浊液
③过滤得含碘离子的溶液 ④向该溶液中加入适量Cl2置换出碘
⑤对含碘溶液进行一系列的提取后得碘单质
(1)灼烧过程在下列哪种仪器中( )
A. 烧杯 B. 试管 C. 蒸发皿 D. 坩埚
(2)过滤用到的三种玻璃仪器主要是____________________ 。
(3)用有机溶剂将碘从水中提取出来需要用到下列哪套装置____ 。
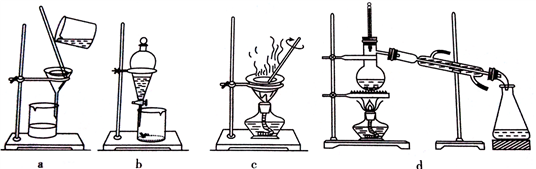
若用四氯化碳作溶剂进行提取,则分层后下层物质为___________ 。
(4)写出步骤④中发生反应的离子方程式:_________________________________ 。
①将海带晒干灼烧成灰 ②将海带浸泡得其悬浊液
③过滤得含碘离子的溶液 ④向该溶液中加入适量Cl2置换出碘
⑤对含碘溶液进行一系列的提取后得碘单质
(1)灼烧过程在下列哪种仪器中
A. 烧杯 B. 试管 C. 蒸发皿 D. 坩埚
(2)过滤用到的三种玻璃仪器主要是
(3)用有机溶剂将碘从水中提取出来需要用到下列哪套装置

若用四氯化碳作溶剂进行提取,则分层后下层物质为
(4)写出步骤④中发生反应的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
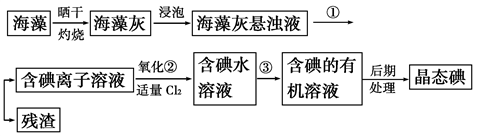
(1)指出提取碘的过程中有关的实验操作名称:
①____ ,③____ 。
(2)提取碘的过程中,可供选择的有机试剂是____ 。
A.酒精 B.四氯化碳
C.醋酸 D.苯
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是____________________________ 。
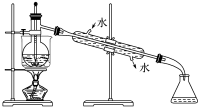
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出下图中实验装置中的错误之处:①________________ ;②______________ ;③________________ 。

(1)指出提取碘的过程中有关的实验操作名称:
①
(2)提取碘的过程中,可供选择的有机试剂是
A.酒精 B.四氯化碳
C.醋酸 D.苯
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出下图中实验装置中的错误之处:①

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘化钾(即碘离子)的形式存在。实验室里从海藻中提取碘的流程如下图,已知 (Cl2+2KI=2KCl+I2)
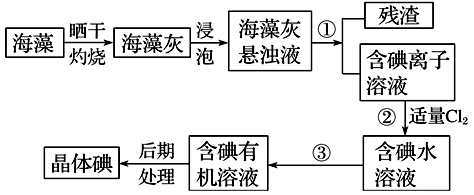
(1)实验室焙烧海带,需要下列仪器中的________ (填字母)。
a.试管 b.烧杯c.坩埚 d.泥三角 e.三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________ ,③__________ 。
(3)提取碘的过程中,可选择的有机试剂是________ 。
A.苯、酒精 B.四氯化碳、苯 C.汽油、醋酸 D.汽油、酒精
(4)某小组用CCl4萃取碘水中的碘,在如图的分液漏斗中,下层液体呈______ 色;他们打开分液漏斗活塞,却未见液体流下,原因可能是___________________ 。

(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
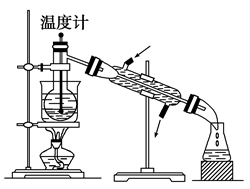
①________________________________________________ ;
②______________________________________________________ ;
③________________________________________________________ 。
(6)进行上述蒸馏操作时,使用水浴加热的目的_______________________ ,最后晶态碘在________ 里聚集。

(1)实验室焙烧海带,需要下列仪器中的
a.试管 b.烧杯c.坩埚 d.泥三角 e.三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①
(3)提取碘的过程中,可选择的有机试剂是
A.苯、酒精 B.四氯化碳、苯 C.汽油、醋酸 D.汽油、酒精
(4)某小组用CCl4萃取碘水中的碘,在如图的分液漏斗中,下层液体呈

(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:

①
②
③
(6)进行上述蒸馏操作时,使用水浴加热的目的
您最近一年使用:0次



