某研究性学习小组用48.0克铜屑与氧化铜的混合物与硫酸和硝酸的混酸100 mL溶液反应制取五水硫酸铜晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后溶液中只有硫酸铜。若在固体混合物中铜屑的质量分数为0.4,试计算:(1)最终制得晶体的质量。(2)混酸中两溶质的物质的量浓度。
11-12高三上·江苏苏州·阶段练习 查看更多[1]
(已下线)2012届江苏省苏州市苏苑高级中学高三上学期10月份月考化学试卷
更新时间:2011-10-22 19:17:56
|
相似题推荐
计算题
|
适中
(0.65)
解题方法
【推荐1】下表是某食用碘盐包装袋上的部分说明:
请回答下列问题:
(1)下列说法正确的是___________ 。
A.碘酸钾易挥发 B.高温会导致碘的损失
C.用淀粉就能直接检验碘盐中的碘酸钾 D.碘酸钾可氧化氯化钠
(2)碘酸钾与碘化钾在酸性条件下发生如下反应:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平),该化学方程式配平后系数依次为___________________ 。
w.该反应的还原剂为_____ ;1mol KIO3完全反应转移的电子总数为______ 。
(3)碘不能多也不能少。已知:I2+2S2O32-=2I-+S4O62-,我校化学兴趣小组测定某食用碘盐中碘的含量。其步骤为:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;③以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示)_________ mg/kg。
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
A.碘酸钾易挥发 B.高温会导致碘的损失
C.用淀粉就能直接检验碘盐中的碘酸钾 D.碘酸钾可氧化氯化钠
(2)碘酸钾与碘化钾在酸性条件下发生如下反应:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平),该化学方程式配平后系数依次为
w.该反应的还原剂为
(3)碘不能多也不能少。已知:I2+2S2O32-=2I-+S4O62-,我校化学兴趣小组测定某食用碘盐中碘的含量。其步骤为:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;③以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示)
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】Cu能与稀硝酸反应生成无色气体NO,其变化可表述为:___ Cu+______HNO3(稀)==______Cu(NO3)2+______NO↑+______H2O
(1)请配平上述化学方程式。
(2)稀硝酸在反应中显示出来的性质是__________ (填编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生2 mol NO,则转移的电子的物质的量为__________ mol。
(4)该反应中氧化剂与还原剂之比为____________ 。
(1)请配平上述化学方程式。
(2)稀硝酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生2 mol NO,则转移的电子的物质的量为
(4)该反应中氧化剂与还原剂之比为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题
(1)将Cl2通入KOH溶液,反应后得到KCl、 KClO 、KClO3的混合溶液(无其它溶质),经测定KClO和KClO3的个数之比为9:1,则Cl2和KOH溶液反应时,被还原和被氧化的Cl原子的个数之比为_______________ ,参加反应的Cl2和KOH个数之比为_______ 。
(2)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,NaClO被还原成NaCl,若Na2Sx与NaClO的个数之比为1∶16,则x的值为_______________ 。
(1)将Cl2通入KOH溶液,反应后得到KCl、 KClO 、KClO3的混合溶液(无其它溶质),经测定KClO和KClO3的个数之比为9:1,则Cl2和KOH溶液反应时,被还原和被氧化的Cl原子的个数之比为
(2)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,NaClO被还原成NaCl,若Na2Sx与NaClO的个数之比为1∶16,则x的值为
您最近一年使用:0次
【推荐1】锌与100mL18.5mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的c(H+)=0.1mol·L-1。请计算:
(1)反应中共消耗H2SO4的物质的量为__ 。
(2)反应中共消耗Zn的质量为__ 。
(3)气体的成分及物质的量之比为__ 。
(1)反应中共消耗H2SO4的物质的量为
(2)反应中共消耗Zn的质量为
(3)气体的成分及物质的量之比为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】大气污染物中的氮氧化物可用NaOH吸收,先后发生如下反应:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO3+NaNO2+H2O。
请计算:
(1)若33.6mL(标况下)氮氧化物(只含NO和NO2)与VmL0.1mol•L-1NaOH溶液恰好完全反应,则V=___ 。
(2)若V(NO):V(NO2)=5:1,与amolO2混合,通入60mL1.0mol•L-1NaOH溶液充分吸收后,溶液中只有一种溶质,则a=___ 。
请计算:
(1)若33.6mL(标况下)氮氧化物(只含NO和NO2)与VmL0.1mol•L-1NaOH溶液恰好完全反应,则V=
(2)若V(NO):V(NO2)=5:1,与amolO2混合,通入60mL1.0mol•L-1NaOH溶液充分吸收后,溶液中只有一种溶质,则a=
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】将70.4g铜置入一定量的浓硝酸中,并微热,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当铜反应完毕时(铜片完全消失),共收集到NO2和NO的混合气体22.4L(标准状况),求:
(1)反应中被还原的HNO3的物质的量是_______ mol。
(2)生成的NO2与NO物质的量之比为_______ 。
(1)反应中被还原的HNO3的物质的量是
(2)生成的NO2与NO物质的量之比为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】某合金(仅含铜、铁)中铜和铁的物质的量之和为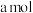 ,其中
,其中 的物质的量分数为b,将其全部投入
的物质的量分数为b,将其全部投入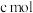 的稀硝酸中,加热使其充分反应(假设
的稀硝酸中,加热使其充分反应(假设 是唯一的还原产物)。
是唯一的还原产物)。
(1)若产生标准状况下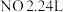 ,则反应转移电子的物质的量为
,则反应转移电子的物质的量为________________ 
(2)若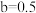 ,溶液中的
,溶液中的 与
与 的物质的量之比
的物质的量之比 ,标准状况下产生
,标准状况下产生 ,
,
___ 
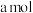 ,其中
,其中 的物质的量分数为b,将其全部投入
的物质的量分数为b,将其全部投入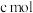 的稀硝酸中,加热使其充分反应(假设
的稀硝酸中,加热使其充分反应(假设 是唯一的还原产物)。
是唯一的还原产物)。(1)若产生标准状况下
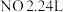 ,则反应转移电子的物质的量为
,则反应转移电子的物质的量为
(2)若
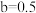 ,溶液中的
,溶液中的 与
与 的物质的量之比
的物质的量之比 ,标准状况下产生
,标准状况下产生 ,
,

您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】硫的含氧钠盐有许多,现有Na2SO3、Na2S2O3、Na2S2O4(连二亚硫酸钠),其热稳定性比相应的酸强。
已知:2Na2S2O4 =Na2S2O3+Na2SO3+SO2↑
4H++ 2S2O42- = 3SO2↑+ S↓ + 2H2O
完成下列计算:
(1)用Na2S2O3溶液与不同浓度的硫酸反应,可以研究浓度对化学反应速率的影响。现有98%的浓硫酸(密度为1.84g·cm-3)来配制500mL1mol·L(密度为1.06g·cm-3)的稀硫酸,则需要浓硫酸___________ mL;加水_______ g;
(2)称取部分氧化的亚硫酸钠样品10.16克溶于水,加入稍过量的盐酸酸化了的氯化钡溶液,过滤,洗涤,干燥,所得沉淀质量为2.33克,则该亚硫酸钠中已有_______ %(质量分数)的亚硫酸钠被氧化。
(3)现有8.70g的无水Na2S2O4,吸水后得到10.50g Na2S2O4·nH2O,则水合物中n的值是______ ;
(4)Na2S2O4在500℃时部分分解得产物A,将9.16g产物A中加入足量的稀硫酸中,生成SO21.568L(标准状况),试确定残留物中钠、硫和氧的原子个数比_______ ;若取另一份Na2S2O4部分分解得到的产物B,则ag产物B中钠、硫和氧的原子个数比为__________ (范围)。
已知:2Na2S2O4 =Na2S2O3+Na2SO3+SO2↑
4H++ 2S2O42- = 3SO2↑+ S↓ + 2H2O
完成下列计算:
(1)用Na2S2O3溶液与不同浓度的硫酸反应,可以研究浓度对化学反应速率的影响。现有98%的浓硫酸(密度为1.84g·cm-3)来配制500mL1mol·L(密度为1.06g·cm-3)的稀硫酸,则需要浓硫酸
(2)称取部分氧化的亚硫酸钠样品10.16克溶于水,加入稍过量的盐酸酸化了的氯化钡溶液,过滤,洗涤,干燥,所得沉淀质量为2.33克,则该亚硫酸钠中已有
(3)现有8.70g的无水Na2S2O4,吸水后得到10.50g Na2S2O4·nH2O,则水合物中n的值是
(4)Na2S2O4在500℃时部分分解得产物A,将9.16g产物A中加入足量的稀硫酸中,生成SO21.568L(标准状况),试确定残留物中钠、硫和氧的原子个数比
您最近一年使用:0次
【推荐2】硫能溶解于 形成多硫化钠,
形成多硫化钠,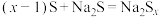 (其中
(其中 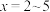 )。
)。
(1)

 溶液中加入0.64g硫粉恰好反应生成多硫化钠(
溶液中加入0.64g硫粉恰好反应生成多硫化钠( ),则
),则
___________ ;
(2)在一定体积和浓度的 溶液中加入1.6g硫粉,控制条件使硫粉完全反应,反应后溶液中阴离子有
溶液中加入1.6g硫粉,控制条件使硫粉完全反应,反应后溶液中阴离子有 、
、 、
、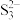 (忽略其它阴离子),且物质的量之比为
(忽略其它阴离子),且物质的量之比为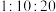 。则反应后溶液中
。则反应后溶液中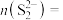
___________  。
。
 形成多硫化钠,
形成多硫化钠,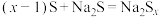 (其中
(其中 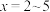 )。
)。(1)


 溶液中加入0.64g硫粉恰好反应生成多硫化钠(
溶液中加入0.64g硫粉恰好反应生成多硫化钠( ),则
),则
(2)在一定体积和浓度的
 溶液中加入1.6g硫粉,控制条件使硫粉完全反应,反应后溶液中阴离子有
溶液中加入1.6g硫粉,控制条件使硫粉完全反应,反应后溶液中阴离子有 、
、 、
、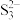 (忽略其它阴离子),且物质的量之比为
(忽略其它阴离子),且物质的量之比为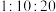 。则反应后溶液中
。则反应后溶液中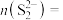
 。
。
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐3】我国利用黄铁矿(主要成分是FeS2)为原料制取浓硫酸,其过程是:
第一步煅烧:4FeS2+11O2==2Fe2O3+8SO2;
第二步催化氧化:2SO2+O2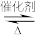 2SO3;
2SO3;
第三步吸收:SO3+H2O=H2SO4
某工厂化验室为测定某黄铁矿的纯度,取1.00g矿石样品(所含杂质不挥发且不与氧气反应),在氧气流中充分灼烧完全反应后,冷却,称量固体残留物,质量为0.75g。
(1)该黄铁矿中FeS2的质量分数为多少?___________
(2)该工厂用这种黄铁矿制硫酸,在FeS2燃烧过程中损失2%,由SO2氧化成:SO3时,SO2的利用率为80%,吸收塔中:SO3完全吸收。若煅烧10.0t上述黄铁矿,则可制得98%的硫酸多少吨?___________
第一步煅烧:4FeS2+11O2==2Fe2O3+8SO2;
第二步催化氧化:2SO2+O2
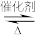 2SO3;
2SO3;第三步吸收:SO3+H2O=H2SO4
某工厂化验室为测定某黄铁矿的纯度,取1.00g矿石样品(所含杂质不挥发且不与氧气反应),在氧气流中充分灼烧完全反应后,冷却,称量固体残留物,质量为0.75g。
(1)该黄铁矿中FeS2的质量分数为多少?
(2)该工厂用这种黄铁矿制硫酸,在FeS2燃烧过程中损失2%,由SO2氧化成:SO3时,SO2的利用率为80%,吸收塔中:SO3完全吸收。若煅烧10.0t上述黄铁矿,则可制得98%的硫酸多少吨?
您最近一年使用:0次



