硫有多种化合物,如H2S、COS(羰基硫)、SO2等,它们对环境均有一定的影响。
(1)H2S经 K2CO3溶液吸收后,生成两种酸式盐 。其中无氧酸的酸式盐 的化学式是________________ 。
(2)COS(羰基硫)燃烧时有SO2生成,其原理为:2COS+3O2 2CO2+2SO2。若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是
2CO2+2SO2。若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是_________________ mol。
(3)电厂排出的烟气中含有CO、SO2等。它们在一定条件下可转化为一种固体和一种无害气体。该反应的化学方程式是______________________________ 。其中氧化剂与还原剂物质的量之比为______________ 。
(4)石灰石作为脱硫剂,可有效吸收废气中的SO2,减少酸雨的产生。
①在煤炭中加入石灰石可减少燃烧时SO2的排放量,并生成CaSO4。该反应的化学方程式是____________ 。
②你认为减少酸雨产生的途径可采取的措施是____________________ (填序号)。
a.避免直接用高硫煤作燃料 b.把工厂的烟囱造高
c.燃料脱硫 d.开发新能源
(1)H2S经 K2CO3溶液吸收后,生成两种
(2)COS(羰基硫)燃烧时有SO2生成,其原理为:2COS+3O2
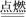 2CO2+2SO2。若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是
2CO2+2SO2。若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是(3)电厂排出的烟气中含有CO、SO2等。它们在一定条件下可转化为一种固体和一种无害气体。该反应的化学方程式是
(4)石灰石作为脱硫剂,可有效吸收废气中的SO2,减少酸雨的产生。
①在煤炭中加入石灰石可减少燃烧时SO2的排放量,并生成CaSO4。该反应的化学方程式是
②你认为减少酸雨产生的途径可采取的措施是
a.避免直接用高硫煤作燃料 b.把工厂的烟囱造高
c.燃料脱硫 d.开发新能源
18-19高一下·福建泉州·阶段练习 查看更多[2]
更新时间:2019-03-26 15:28:33
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2

【实验一】测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
(1)鼓入空气的作用是_____________________ 。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________ (用化学方 程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________ 。
(3)该黄铁砂石中硫元素的质量分数为____________________ (列出 表达式即可)。
【实验二】测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00 mL稀释液,用0.100 mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________ (填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________ 。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________ 。

【实验一】测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
(1)鼓入空气的作用是
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是
(3)该黄铁砂石中硫元素的质量分数为
【实验二】测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00 mL稀释液,用0.100 mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量
(5)请写出步骤②中洗涤的方法
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知铅(Pb)与硅同主族且Pb比Si多3个电子层。
(1)难溶物PbSO4溶于CH3COONH4溶液可制得(CH3COO)2Pb[(CH3COO)2Pb易溶于水],发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是______ (填“强”或“弱”)电解质。
(2)将PbO2加入硝酸酸化的Mn(NO3)2溶液中搅拌后溶液显紫红色;则每反应1 mol Mn(NO3)2转移____________ mol电子。
(3)在汽车尾气系统中装置催化转化器,可有效降低尾气中的CO、NO、NO2和碳氢化合物等污染性气体。在催化转换器的前半部,CO和NO在催化剂的作用下发生反应,生成两种无污染的气体,该反应的化学方程式为:___________________________________ 。
(4)①在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,溶液变蓝色,且反应后溶液呈碱性,发生反应的离子方程式是______________ 。
②在上述碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,写出发生反应的离子方程式是______________ 。
(5)处理含Cr2O72-的废水可先用(NH4)2Fe(SO4)2将Cr2O72-转化为Cr3+,再用氨水将Cr3+转变为难溶的Cr(OH)3,在该过程中氧化剂为______________ ,其中氨水转化Cr3+为Cr(OH)3的离子方程式为____________________________________________ ;该方案处理后的废水中因含有大量________ 元素,直接排放会导致水体富营养化。
(1)难溶物PbSO4溶于CH3COONH4溶液可制得(CH3COO)2Pb[(CH3COO)2Pb易溶于水],发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是
(2)将PbO2加入硝酸酸化的Mn(NO3)2溶液中搅拌后溶液显紫红色;则每反应1 mol Mn(NO3)2转移
(3)在汽车尾气系统中装置催化转化器,可有效降低尾气中的CO、NO、NO2和碳氢化合物等污染性气体。在催化转换器的前半部,CO和NO在催化剂的作用下发生反应,生成两种无污染的气体,该反应的化学方程式为:
(4)①在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,溶液变蓝色,且反应后溶液呈碱性,发生反应的离子方程式是
②在上述碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,写出发生反应的离子方程式是
(5)处理含Cr2O72-的废水可先用(NH4)2Fe(SO4)2将Cr2O72-转化为Cr3+,再用氨水将Cr3+转变为难溶的Cr(OH)3,在该过程中氧化剂为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】中国政府承诺:力争 的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”。
的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”。 的捕集与利用成为当前研究的热点。
的捕集与利用成为当前研究的热点。
Ⅰ.“氨法”捕集二氧化碳是实现“碳中和”的重要途径之一
反应的化学方程式为: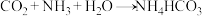 。
。
完成下列填空:
(1)写出氮原子的核外电子排布式_______ ,写出 分子的电子式
分子的电子式_______ 。
(2)用方程式表示二氧化碳溶于水溶液呈现酸性的原因_______ 。
(3)组成 的四种元素中,由其中任意两种元素组成且含非极性键的分子可以是
的四种元素中,由其中任意两种元素组成且含非极性键的分子可以是_______ (写出一种,下同);由其中任意三种元素组成的离子化合物可以是_______ 。
(4)上述氨法吸收废气中 时,一般温度控制在30℃,用化学方程式表示温度不宜太高的原因。
时,一般温度控制在30℃,用化学方程式表示温度不宜太高的原因。_______
Ⅱ.我国化学家研究在铜基催化剂作用下将 高效转化为甲酸,合成铜基催化剂时有一步反应为:
高效转化为甲酸,合成铜基催化剂时有一步反应为: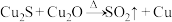 (未配平)。
(未配平)。
(5)配平上述化学方程式_______ 。若反应中转移 电子,则生成气体在标准状态下的体积为
电子,则生成气体在标准状态下的体积为_______ L。
 的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”。
的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”。 的捕集与利用成为当前研究的热点。
的捕集与利用成为当前研究的热点。Ⅰ.“氨法”捕集二氧化碳是实现“碳中和”的重要途径之一
反应的化学方程式为:
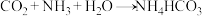 。
。完成下列填空:
(1)写出氮原子的核外电子排布式
 分子的电子式
分子的电子式(2)用方程式表示二氧化碳溶于水溶液呈现酸性的原因
(3)组成
 的四种元素中,由其中任意两种元素组成且含非极性键的分子可以是
的四种元素中,由其中任意两种元素组成且含非极性键的分子可以是(4)上述氨法吸收废气中
 时,一般温度控制在30℃,用化学方程式表示温度不宜太高的原因。
时,一般温度控制在30℃,用化学方程式表示温度不宜太高的原因。Ⅱ.我国化学家研究在铜基催化剂作用下将
 高效转化为甲酸,合成铜基催化剂时有一步反应为:
高效转化为甲酸,合成铜基催化剂时有一步反应为: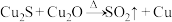 (未配平)。
(未配平)。(5)配平上述化学方程式
 电子,则生成气体在标准状态下的体积为
电子,则生成气体在标准状态下的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】(1)据中新社2017年6月29日电,也门遭世界最严重霍乱疫情 1400人死亡疑20余万人感染。霍乱是由霍乱弧菌引起的急性肠道传染病,患者常出现呕吐、腹泻、脱水和高烧等症状,重症和延误治疗可致死亡。据联合国儿童基金会专家表示,正常情况下,霍乱可以预防并且治愈率很高,但由于也门基础设施被完全损坏,将很难控制疾病传播。
请根据此信息和题意回答下列问题(填字母,下同)。
a.蛋白质 b.氨基酸 c.葡萄糖 d.变性 e.盐析
①霍乱弧菌中的主要成分中含有____________ ;该成分经水解后变为__________ ;
②为了预防霍乱,该疫情地区普遍采用喷洒消毒水进行消毒,对所接触到的器具均采用高温灭菌处理,这是因为在高温条件下病毒和细菌都发生了__________ 。
(2)化学与材料密切相关,材料是人类生存和发展的物质基础。
①在快中子反应堆中得以广泛应用的钠钾合金在常温下呈液态,这个事实说明合金的熔点比其成分金属的熔点_______ (填“高”或者“低”)。
②有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料而是一种线型高分子化合物,它具有_____________ 性(选填“热塑”或“热固”)。
③据报道,每年我国因金属腐蚀造成的损失占国民生产总值(GDP)的4%。钢铁在潮湿的空气中发生________ 腐蚀时,负极的电极反应为 ______________ 。
(3)化学与环境紧密联系。
①空气质量报告的各项指标可以反映出各地空气的质量。下列物质不属于空气污染物的是______ (填字母)
a.SO2 b.NO2 c.PM2.5 d.CO2
② 天然水中杂质较多,常需加入明矾,ClO2等物质处理后才能饮用。加入ClO2的作用是__________________ ;加入明矾后, Al3+水解的离子方程式是 ________________ 。
③为减少SO2的排放量,可向煤中加入适量__________ (填名称);也可以将煤气化,即在高温条件下与水蒸气反应转化为水煤气,该反应方程式为___________________ 。
请根据此信息和题意回答下列问题(填字母,下同)。
a.蛋白质 b.氨基酸 c.葡萄糖 d.变性 e.盐析
①霍乱弧菌中的主要成分中含有
②为了预防霍乱,该疫情地区普遍采用喷洒消毒水进行消毒,对所接触到的器具均采用高温灭菌处理,这是因为在高温条件下病毒和细菌都发生了
(2)化学与材料密切相关,材料是人类生存和发展的物质基础。
①在快中子反应堆中得以广泛应用的钠钾合金在常温下呈液态,这个事实说明合金的熔点比其成分金属的熔点
②有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料而是一种线型高分子化合物,它具有
③据报道,每年我国因金属腐蚀造成的损失占国民生产总值(GDP)的4%。钢铁在潮湿的空气中发生
(3)化学与环境紧密联系。
①空气质量报告的各项指标可以反映出各地空气的质量。下列物质不属于空气污染物的是
a.SO2 b.NO2 c.PM2.5 d.CO2
② 天然水中杂质较多,常需加入明矾,ClO2等物质处理后才能饮用。加入ClO2的作用是
③为减少SO2的排放量,可向煤中加入适量
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg·L−1。
(1)酸雨是降水呈酸性(pH小于5.6)的统称,个别地方甚至低于2.1(食醋的pH=3)。引起硫酸型酸雨的罪魁祸首是大气中的SO2.它们的主要来源是煤和石油的燃烧,全世界每年排放1.5亿吨的SO2。
①SO2可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型酸雨。试写出这两个反应的化学方程式:_______ ;_______ 。
②酸雨可导致的危害有_______ (填序号)。
A.腐蚀建筑物 B.导致树木枯萎 C.造成洪涝灾害 D.酸化水源、土壤等
③为了减少酸雨的形成,必须减少SO2的排放量,对化石燃料中的硫元素通常加入_______ 进行处理,并最终转化为工业用品石膏;相应的化学方程式为_______ 。
(2)某化学兴趣小组选用如图所示的实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。

①若原料气从左向右流时,上述装置连接的顺序是:原料气_______ (用字母和箭头表示)。
②写出装置B中发生反应的离子方程式:_______ ;当装置B中出现_______ 现象时,立即停止通气。
③你认为下列试剂中,可以用来代替试管中的碘淀粉溶液的是_______ (填序号)。
a.酸性KMnO4溶液 B.NaOH溶液 C.溴水 D.氨水
④若碘溶液的浓度为0.05 mol·L−1,体积为20 mL,停止通气时,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积)。那么SO2的含量是否超标?_______ 。(写计算过程)
(1)酸雨是降水呈酸性(pH小于5.6)的统称,个别地方甚至低于2.1(食醋的pH=3)。引起硫酸型酸雨的罪魁祸首是大气中的SO2.它们的主要来源是煤和石油的燃烧,全世界每年排放1.5亿吨的SO2。
①SO2可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型酸雨。试写出这两个反应的化学方程式:
②酸雨可导致的危害有
A.腐蚀建筑物 B.导致树木枯萎 C.造成洪涝灾害 D.酸化水源、土壤等
③为了减少酸雨的形成,必须减少SO2的排放量,对化石燃料中的硫元素通常加入
(2)某化学兴趣小组选用如图所示的实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。

①若原料气从左向右流时,上述装置连接的顺序是:原料气
②写出装置B中发生反应的离子方程式:
③你认为下列试剂中,可以用来代替试管中的碘淀粉溶液的是
a.酸性KMnO4溶液 B.NaOH溶液 C.溴水 D.氨水
④若碘溶液的浓度为0.05 mol·L−1,体积为20 mL,停止通气时,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积)。那么SO2的含量是否超标?
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】为消除燃煤烟气中含有的SO2、NOx,研究者提出若干烟气“脱硫”、“脱硝”的方法。
(1)下列物质中,能吸收SO2的有___________ (填序号)。
a.氨水 b.酸性KMnO4溶液 c.BaCl2溶液 d.Na2CO3溶液
(2)向燃煤中加入适量石灰石,高温时将SO2转化为CaSO4的化学方程式是___________ 。
(3)选择性催化还原法(SCR)“脱硝”。在催化剂的作用下,选取还原剂将烟气中的NO进行无害化处理。NH3还原NO的化学方程式是___________ 。
(4)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2、NO转化为SO 、NO
、NO ,均为放热反应。
,均为放热反应。
①NaClO溶液吸收烟气中SO2的离子方程式是___________ 。
②一定时间内,温度对硫、硝脱除率的影响曲线如下图,SO2的脱除率高于NO,可能的原因是___________ (写出1种即可)。 和Cl−的物质的量之比为
和Cl−的物质的量之比为___________ 。
(1)下列物质中,能吸收SO2的有
a.氨水 b.酸性KMnO4溶液 c.BaCl2溶液 d.Na2CO3溶液
(2)向燃煤中加入适量石灰石,高温时将SO2转化为CaSO4的化学方程式是
(3)选择性催化还原法(SCR)“脱硝”。在催化剂的作用下,选取还原剂将烟气中的NO进行无害化处理。NH3还原NO的化学方程式是
(4)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2、NO转化为SO
 、NO
、NO ,均为放热反应。
,均为放热反应。①NaClO溶液吸收烟气中SO2的离子方程式是
②一定时间内,温度对硫、硝脱除率的影响曲线如下图,SO2的脱除率高于NO,可能的原因是
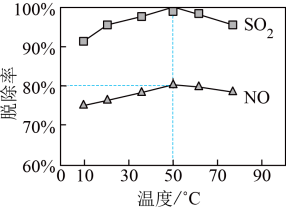
 和Cl−的物质的量之比为
和Cl−的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】硫是生命的必须元素,在自然界的循环中具有重要意义

(1)火山口附近 和
和 反应会产生硫单质,其中
反应会产生硫单质,其中 体现
体现___________ 性(填“氧化”或“还原”)。
(2)大气中的 会形成酸雨,相关的化学方程式为
会形成酸雨,相关的化学方程式为___________ 。
(3)大气中的水蒸气在紫外线作用下会转化成活泼的 (羟基自由基,“·”表示1个电子)。
(羟基自由基,“·”表示1个电子)。 可以看成催化剂,将
可以看成催化剂,将 转化为
转化为 ,过程如下:
,过程如下:
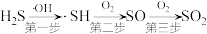
则第一步反应和第二步反应的方程式为___________ 、___________ 。
(4)土壤中的黄铁矿(主要成分是 )在细菌的作用下发生转化。请将该反应的方程式补充完整。
)在细菌的作用下发生转化。请将该反应的方程式补充完整。___________
 。
。
(5)结合溶解平衡理论解释图中ZnS转化为铜蓝色的原因___________ 。

(1)火山口附近
 和
和 反应会产生硫单质,其中
反应会产生硫单质,其中 体现
体现(2)大气中的
 会形成酸雨,相关的化学方程式为
会形成酸雨,相关的化学方程式为(3)大气中的水蒸气在紫外线作用下会转化成活泼的
 (羟基自由基,“·”表示1个电子)。
(羟基自由基,“·”表示1个电子)。 可以看成催化剂,将
可以看成催化剂,将 转化为
转化为 ,过程如下:
,过程如下: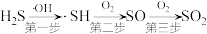
则第一步反应和第二步反应的方程式为
(4)土壤中的黄铁矿(主要成分是
 )在细菌的作用下发生转化。请将该反应的方程式补充完整。
)在细菌的作用下发生转化。请将该反应的方程式补充完整。 。
。(5)结合溶解平衡理论解释图中ZnS转化为铜蓝色的原因
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】12.5g CuSO4﹒5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。

请回答下列问题:
(1)试确定200℃时固体物质的化学式___________ 。
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为___________ 。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有蓝色晶体析出,该晶体的化学式为___________ ,其存在的最高温度是___________ 。
(3)若在0.05mol·L-1 硫酸铜溶液中通入足量 H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的pH值约为___________ 。

请回答下列问题:
(1)试确定200℃时固体物质的化学式
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为
(3)若在0.05mol·L-1 硫酸铜溶液中通入足量 H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的pH值约为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】天然气中伴随有H2S等合硫化合物,脱硫方法有多种:
(1)一种湿法脱硫是用碳酸钾溶液吸收其中的H2S,同时生成两种酸式盐,该反应的化学方程为___________ 。
(2)一种于法脱硫,其涉及反应:H2(g)+CO(g)+SO2(g) H2O(g)+CO2(g)+S(s)
H2O(g)+CO2(g)+S(s)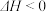 ,高脱硫率可采取的措施是
,高脱硫率可采取的措施是_____________ 。
a.高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出硫
(3)用脱硫剂ZDE—01的海绵铁法脱硫,可实现常温脱硫
①脱硫:Fe2O3·H2O(s)+3H2S(g)=Fe2S3·H2O(s)+3H2O(g)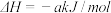
②再生:2Fe2S3·H2O(s)+3O2(g)=2Fe2O3·H2O(s)+6S(s)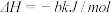
则2H2S(g)+O2(g)=2H2O(g)+2S(s) =
=_______ (用a、b表示)
(4)一种改进的克劳斯法脱硫的工艺,化学反应如下:
H3S+1.5O2=H2O+SO2 SO2+0.5O2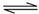 SO3
SO3
SO3(g)+H2O(g)=H2SO4(g) H2SO4(g)+0.17H2O(g) H2SO4(aq)
H2SO4(aq)
该法最终得到的硫酸溶液的质量分数为________ 。
(1)一种湿法脱硫是用碳酸钾溶液吸收其中的H2S,同时生成两种酸式盐,该反应的化学方程为
(2)一种于法脱硫,其涉及反应:H2(g)+CO(g)+SO2(g)
 H2O(g)+CO2(g)+S(s)
H2O(g)+CO2(g)+S(s)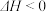 ,高脱硫率可采取的措施是
,高脱硫率可采取的措施是a.高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出硫
(3)用脱硫剂ZDE—01的海绵铁法脱硫,可实现常温脱硫
①脱硫:Fe2O3·H2O(s)+3H2S(g)=Fe2S3·H2O(s)+3H2O(g)
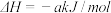
②再生:2Fe2S3·H2O(s)+3O2(g)=2Fe2O3·H2O(s)+6S(s)
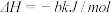
则2H2S(g)+O2(g)=2H2O(g)+2S(s)
 =
=(4)一种改进的克劳斯法脱硫的工艺,化学反应如下:
H3S+1.5O2=H2O+SO2 SO2+0.5O2
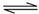 SO3
SO3SO3(g)+H2O(g)=H2SO4(g) H2SO4(g)+0.17H2O(g)
 H2SO4(aq)
H2SO4(aq)该法最终得到的硫酸溶液的质量分数为
您最近一年使用:0次



