Ⅰ.北京时间11月1日清晨5时58分07秒,中国“长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)=2H2O(l);ΔH=–571.6kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=–890.3kJ/mol
C(s)+O2(g)=CO2(g);ΔH=–393.5kJ/mol
根据上面的热化学方程式完成下列问题:
⑴通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是_________ 。
⑵根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=___________ 。
⑶已知H2O(l)=H2O(g);ΔH=+44.0kJ/mol
试写出甲烷燃烧生成二氧化碳和水蒸气时的热化学方程式:_____________________ 。
Ⅱ.据统计,发达国家每年由于金属腐蚀造成的直接损失约占全年国民生产总值的2%~4%,远远超出水灾、火灾、风灾、地震等自然灾害造成损失的总和。因此,了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
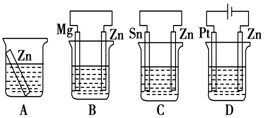
⑴分别放在以下装置(都盛有0.1mol/L的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是_____________ 。
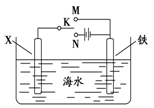
⑵利用下图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于______ 处。若X为锌,开关K置于M处,该电化学防护法称为______________________ 。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)=2H2O(l);ΔH=–571.6kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=–890.3kJ/mol
C(s)+O2(g)=CO2(g);ΔH=–393.5kJ/mol
根据上面的热化学方程式完成下列问题:
⑴通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是
⑵根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=
⑶已知H2O(l)=H2O(g);ΔH=+44.0kJ/mol
试写出甲烷燃烧生成二氧化碳和水蒸气时的热化学方程式:
Ⅱ.据统计,发达国家每年由于金属腐蚀造成的直接损失约占全年国民生产总值的2%~4%,远远超出水灾、火灾、风灾、地震等自然灾害造成损失的总和。因此,了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
⑴分别放在以下装置(都盛有0.1mol/L的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是

⑵利用下图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于

2011高二上·山东潍坊·学业考试 查看更多[1]
(已下线)2011-2012学年山东省潍坊市三县高二上学期模块学分认定检测化学试卷
更新时间:2016-12-09 02:15:45
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】高炉炼铁是重要的工业过程,冶炼过程中涉及如下反应:
①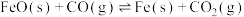
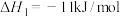
②

③
(1)反应③的
___________ kJ/mol。
(2)在恒温恒容密闭容器中投入足量石墨与 进行反应③,可判定其达到平衡的条件有___________(填序号)。
进行反应③,可判定其达到平衡的条件有___________(填序号)。
(3)反应②的压力平衡常数表达式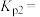
___________ 。
(4)恒容密闭容器中加入足量C、FeO,进行上述反应。改变温度,测得平衡时容器总压的对数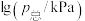 、各气体的物质的量分数
、各气体的物质的量分数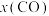 、
、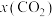 的变化如图所示:
的变化如图所示:
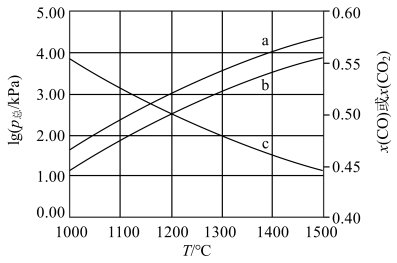
①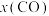 对应的曲线是
对应的曲线是___________ (填序号),判断依据是___________ 。
②在1200℃下进行上述反应,平衡时 分压为
分压为___________ kPa,反应①在此温度下的压力平衡常数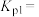
___________ 。
①
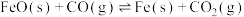
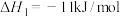
②


③

(1)反应③的

(2)在恒温恒容密闭容器中投入足量石墨与
 进行反应③,可判定其达到平衡的条件有___________(填序号)。
进行反应③,可判定其达到平衡的条件有___________(填序号)。| A.容器总压保持不变 | B.生成 ,同时生成1molCO ,同时生成1molCO |
| C.CO的体积分数保持不变 | D.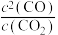 保持不变 保持不变 |
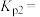
(4)恒容密闭容器中加入足量C、FeO,进行上述反应。改变温度,测得平衡时容器总压的对数
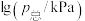 、各气体的物质的量分数
、各气体的物质的量分数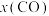 、
、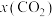 的变化如图所示:
的变化如图所示:
①
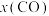 对应的曲线是
对应的曲线是②在1200℃下进行上述反应,平衡时
 分压为
分压为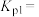
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】天然气是正要的燃料和化工原料,其主要成分是CH4,以及C2H6等烃类。
(1)在恒容密闭容器中发生如下反应:C2H6(g) C2H4(g)+H2(g)∆H,已知相关键能数据如表所示:
C2H4(g)+H2(g)∆H,已知相关键能数据如表所示:
①该反应的反应热为___ kJ•mol-1。
②下列能说明该反应已达到平衡状态的是__ 。
A.v(C2H6)=v(H2)
B.容器内气体压强不变
C.混合气体的密度不变
D.混合气体的颜色不变
③提高该反应平衡转化率的方法有__ 、___ 。
(2)在2L恒容密闭容器中,投入4molC2H4和4molH2,在一定条件下生成C2H6,测得不同温度下,平衡时C2H6的物质的量数据如表:
①温度T1___ (填“>”“<”或“=”)T3.
②在T2温度下,达到平衡时C2H4的转化率为___ 。
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:

①阴极上的电极反应方程式为__ 。
②若消耗11.2LCO2时(标准状况下),转移电子的数目为__ NA。
(1)在恒容密闭容器中发生如下反应:C2H6(g)
 C2H4(g)+H2(g)∆H,已知相关键能数据如表所示:
C2H4(g)+H2(g)∆H,已知相关键能数据如表所示:| 共价键 | H—H | C—H | C—C | C=C |
| E/(kJ•mol-1) | 436 | 413 | 344 | 614 |
②下列能说明该反应已达到平衡状态的是
A.v(C2H6)=v(H2)
B.容器内气体压强不变
C.混合气体的密度不变
D.混合气体的颜色不变
③提高该反应平衡转化率的方法有
(2)在2L恒容密闭容器中,投入4molC2H4和4molH2,在一定条件下生成C2H6,测得不同温度下,平衡时C2H6的物质的量数据如表:
| 温度/K | T1 | T2 | T3 | T4 |
| n(C2H6)/mol | 3.2 | 2.8 | 2.4 | 2.0 |
②在T2温度下,达到平衡时C2H4的转化率为
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:

①阴极上的电极反应方程式为
②若消耗11.2LCO2时(标准状况下),转移电子的数目为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)已知热化学反应方程式:
I:HCOOH(g) CO(g)+H2O(g) △H1=+72.6kJ•mol-1;
CO(g)+H2O(g) △H1=+72.6kJ•mol-1;
II:2CO(g)+O2(g) 2CO2(g) △H 2=-566.0kJ•mol-1;
2CO2(g) △H 2=-566.0kJ•mol-1;
III:2H2(g)+O2(g) 2H2O(g) △H 3=-483.6kJ•mol-1
2H2O(g) △H 3=-483.6kJ•mol-1
则反应IV:CO2(g)+H2(g) HCOOH(g)的△H =
HCOOH(g)的△H =____________ kJ•mol-1。
(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→M•HCOOH(s);第二步:___________________。
①第一步反应的△H_________ 0(填“>”或“<”)。
②第二步反应的方程式为________________________ 。
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1_________ t2(填“>”、“<”或“=”)。
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[ ]的变化如图所示:
]的变化如图所示:
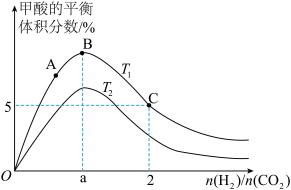
①图中T1、T2表示不同的反应温度,判断T1____________ T2(填“〉”、“<”或“=” ) ,依据为____________________ 。
②图中a=______________ 。
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为____________ 。
④T1温度下,该反应的平衡常数K=______________ (计算结果用分数表示)。
(1)已知热化学反应方程式:
I:HCOOH(g)
 CO(g)+H2O(g) △H1=+72.6kJ•mol-1;
CO(g)+H2O(g) △H1=+72.6kJ•mol-1;II:2CO(g)+O2(g)
 2CO2(g) △H 2=-566.0kJ•mol-1;
2CO2(g) △H 2=-566.0kJ•mol-1;III:2H2(g)+O2(g)
 2H2O(g) △H 3=-483.6kJ•mol-1
2H2O(g) △H 3=-483.6kJ•mol-1则反应IV:CO2(g)+H2(g)
 HCOOH(g)的△H =
HCOOH(g)的△H =(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→M•HCOOH(s);第二步:___________________。
①第一步反应的△H
②第二步反应的方程式为
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[
 ]的变化如图所示:
]的变化如图所示:
①图中T1、T2表示不同的反应温度,判断T1
②图中a=
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为
④T1温度下,该反应的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲醇是重要的有机化工原料,目前世界甲醇年产量超过2.1×107吨,在能源紧张的今天,甲醇的需求也在增大。
甲醇的合成方法是:i.CO(g)+2H2(g) CH3OH(g) ΔH=-90.1kJ·mol-1
CH3OH(g) ΔH=-90.1kJ·mol-1
另外:ii.2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
iii.2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
若混合气体中有二氧化碳存在时,还发生下列反应:
iv.CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH=+41.1kJ·mol-1
(1)甲醇的燃烧热为_______ kJ·mol-1。
(2)若反应在密闭恒容绝热容器中进行,反应(ⅳ)对合成甲醇反应中CO的转化率的影响是______ 。
a.增大 b.减小 c.无影响 d.无法判断
(3)如图是温度、压强与反应(ⅰ)中CO转化率的关系:

①由图象可知,较低温度时,CO转化率对______ (选填“温度”或“压强”)敏感。
②由图象可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400℃和10MPa的条件,其原因是______ 。
(4)在一容积为2L的密闭容器内加入2mol的CO和6mol的H2,在一定条件下发生反应i。该反应的逆反应速率与时间的关系如图所示:

①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是__________ 。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线__________ 。
甲醇的合成方法是:i.CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.1kJ·mol-1
CH3OH(g) ΔH=-90.1kJ·mol-1另外:ii.2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
iii.2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
若混合气体中有二氧化碳存在时,还发生下列反应:
iv.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH=+41.1kJ·mol-1(1)甲醇的燃烧热为
(2)若反应在密闭恒容绝热容器中进行,反应(ⅳ)对合成甲醇反应中CO的转化率的影响是
a.增大 b.减小 c.无影响 d.无法判断
(3)如图是温度、压强与反应(ⅰ)中CO转化率的关系:

①由图象可知,较低温度时,CO转化率对
②由图象可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400℃和10MPa的条件,其原因是
(4)在一容积为2L的密闭容器内加入2mol的CO和6mol的H2,在一定条件下发生反应i。该反应的逆反应速率与时间的关系如图所示:

①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线
您最近一年使用:0次
【推荐2】废气的综合处理与应用技术是科研人员的重要研究课题,CO、 、
、 是重要的大气污染气体。
是重要的大气污染气体。
 处理后的CO是制取新型能源二甲醚
处理后的CO是制取新型能源二甲醚 的原料。
的原料。
已知:




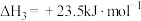
则CO和 反应生成气态二甲醚的热化学方程式为
反应生成气态二甲醚的热化学方程式为__________ 。
 温度为
温度为 时,在容积固定的密闭容器中发生反应:
时,在容积固定的密闭容器中发生反应: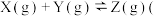 未配平
未配平 ,
, 时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为
时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为 、
、 时发生反应,Z的浓度随时间变化的关系如图b所示。
时发生反应,Z的浓度随时间变化的关系如图b所示。

则图a中反应达到平衡时,Y的转化率为________ ; 时,该反应的平衡常数为
时,该反应的平衡常数为________  保留3位有效数字
保留3位有效数字 ;该反应正反应的反应热
;该反应正反应的反应热
________  填“
填“ ”、“
”、“ ”或“
”或“ ”
” 。
。
 可用于合成甲醇,反应方程式为
可用于合成甲醇,反应方程式为 。CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在
。CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在________  ,压强为
,压强为 左右,选择此压强的理由是
左右,选择此压强的理由是______________ 。

 如图是某甲醇燃料电池工作的示意图:
如图是某甲醇燃料电池工作的示意图:

质子交换膜 只有质子能够通过
只有质子能够通过 左右两侧的溶液均为
左右两侧的溶液均为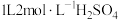 溶液。电极a上发生的电极反应为
溶液。电极a上发生的电极反应为_______ 。
 、
、 是重要的大气污染气体。
是重要的大气污染气体。 处理后的CO是制取新型能源二甲醚
处理后的CO是制取新型能源二甲醚 的原料。
的原料。已知:





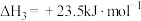
则CO和
 反应生成气态二甲醚的热化学方程式为
反应生成气态二甲醚的热化学方程式为 温度为
温度为 时,在容积固定的密闭容器中发生反应:
时,在容积固定的密闭容器中发生反应: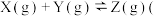 未配平
未配平 ,
,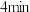 时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为
时达到平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为 、
、 时发生反应,Z的浓度随时间变化的关系如图b所示。
时发生反应,Z的浓度随时间变化的关系如图b所示。
则图a中反应达到平衡时,Y的转化率为
 时,该反应的平衡常数为
时,该反应的平衡常数为 保留3位有效数字
保留3位有效数字 ;该反应正反应的反应热
;该反应正反应的反应热
 填“
填“ ”、“
”、“ ”或“
”或“ ”
” 。
。 可用于合成甲醇,反应方程式为
可用于合成甲醇,反应方程式为 。CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在
。CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在 ,压强为
,压强为 左右,选择此压强的理由是
左右,选择此压强的理由是
 如图是某甲醇燃料电池工作的示意图:
如图是某甲醇燃料电池工作的示意图:
质子交换膜
 只有质子能够通过
只有质子能够通过 左右两侧的溶液均为
左右两侧的溶液均为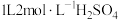 溶液。电极a上发生的电极反应为
溶液。电极a上发生的电极反应为
您最近一年使用:0次
【推荐3】研究CO2的利用对促进低碳社会的构建具有重要的意义。
I.已知某些化学键的键能数据如下
则CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH =
CH3OH(g) + H2O(g) ΔH = __________ kJ·mol-1
II.将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(l)
CH3OCH3(g) + 3H2O(l)
(1)该反应化学平衡常数表达式K =__________ 。
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图所示:

①该反应的ΔH__________ 0(填“>"或“<”)。
②若温度不变,减小反应投料比[n(H2)/n(CO2)],K值将____ (填“增大”、“减小”或“不变”)。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是__________ 。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
①P1__________ P3(填“>”“<”或“=”);
②P2下,III中CH3OCH3的平衡转化率为__________ 。
I.已知某些化学键的键能数据如下
| 化学键 | C=O | C—O | C—H | H—H | O—H |
| 键能/kJ·mol-1 | 745 | 351 | 415 | 436 | 462 |
则CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH =
CH3OH(g) + H2O(g) ΔH = II.将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)
 CH3OCH3(g) + 3H2O(l)
CH3OCH3(g) + 3H2O(l)(1)该反应化学平衡常数表达式K =
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图所示:

①该反应的ΔH
②若温度不变,减小反应投料比[n(H2)/n(CO2)],K值将
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
| P1 | P2 | P3 | |
| I.2.0 mol CO2 6.0 mol H2 | 0.10 mol | 0.04 mol | 0.02 mol |
| II.1.0 mol CO2 3.0 mol H2 | X1 | Y1 | Z1 |
| III.1.0 mol CH3OCH3 3.0 mol H2O | X2 | Y2 | Z2 |
①P1
②P2下,III中CH3OCH3的平衡转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】铁及其化合物在日常生活和生产中有广泛的应用。
(1)防止钢铁腐蚀造成浪费是科学家很关心的一个话题。
①下列各情况,其中Fe片腐蚀由快到慢的顺序是(用序号表示)_______ 。
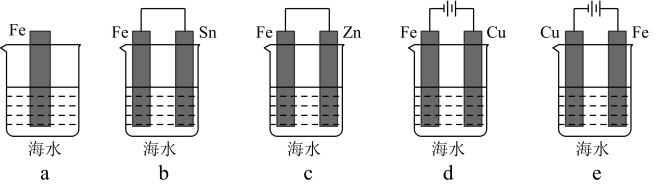
②利用如图装置,可以模拟铁的电化学防护,若X为碳棒,为减缓铁的腐蚀,开关K应设置于_______ 处。若X为锌,开关K置于M处,该电化学防护法称为_______ 。
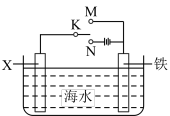
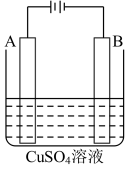
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
A电极对应的金属是_______ (写元素名称),B电极的电极反应式是_______ 。
(3) 是一种高效多功能水处理剂,应用前景非常看好,电解法制取原理如图所示,装置通电后,铁电极附近生成紫红色的
是一种高效多功能水处理剂,应用前景非常看好,电解法制取原理如图所示,装置通电后,铁电极附近生成紫红色的 ,镍电极有气泡产生。
,镍电极有气泡产生。

①离子交换膜为阴离子交换膜,阴极室中NaOH的浓度_______ (填写“变大”、“变小”或“不变”)
②阳极室中电极反应式是_______ 。
(4) (二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为
(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为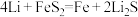 ,正极反应式是
,正极反应式是_______ 。
(1)防止钢铁腐蚀造成浪费是科学家很关心的一个话题。
①下列各情况,其中Fe片腐蚀由快到慢的顺序是(用序号表示)

②利用如图装置,可以模拟铁的电化学防护,若X为碳棒,为减缓铁的腐蚀,开关K应设置于

(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:

A电极对应的金属是
(3)
 是一种高效多功能水处理剂,应用前景非常看好,电解法制取原理如图所示,装置通电后,铁电极附近生成紫红色的
是一种高效多功能水处理剂,应用前景非常看好,电解法制取原理如图所示,装置通电后,铁电极附近生成紫红色的 ,镍电极有气泡产生。
,镍电极有气泡产生。
①离子交换膜为阴离子交换膜,阴极室中NaOH的浓度
②阳极室中电极反应式是
(4)
 (二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为
(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为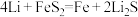 ,正极反应式是
,正极反应式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】“阳光”牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水,使用一段时间后Fe粉会变质。某校化学兴趣小组欲探究使用过的 “脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行了如下探究过程,请你参与实验并回答有关问题。
步骤⑴取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”中的铁已变质,发生了_______ 腐蚀,生成的铁锈主要成分是________ (填化学式);
步骤⑵将步骤⑴中的固体溶于水,过滤,将滤渣洗涤、干燥。该步骤的目的是_________ ;
步骤⑶ 取步骤⑵中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通入足量的澄清石灰水,得到干燥、纯净的沉淀20.0 g。据此计算8.0 g滤渣中活性炭的质量为_______________ ;
步骤⑷ 将步骤⑶中的另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全。为保证滤渣充分溶解,加入的稀H2SO4的体积应大于或等于__________ mL;
步骤⑸ 向步骤⑷中的混合物中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热,冷却、称量,得到6.86g固体。
结论:该“脱氧剂”中的Fe粉和活性炭质量之比为_______________ 。
步骤⑴取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”中的铁已变质,发生了
步骤⑵将步骤⑴中的固体溶于水,过滤,将滤渣洗涤、干燥。该步骤的目的是
步骤⑶ 取步骤⑵中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通入足量的澄清石灰水,得到干燥、纯净的沉淀20.0 g。据此计算8.0 g滤渣中活性炭的质量为
步骤⑷ 将步骤⑶中的另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全。为保证滤渣充分溶解,加入的稀H2SO4的体积应大于或等于
步骤⑸ 向步骤⑷中的混合物中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热,冷却、称量,得到6.86g固体。
结论:该“脱氧剂”中的Fe粉和活性炭质量之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】用如图所示装置分别进行实验,请回答下列问题:

(1)导管E的作用是:____________________ 、_________________ ;
(2)实验I烧瓶B中发生反应的化学方程式是________ ,产生的气体经验纯后点燃,现象是___________ ;
(3)实验Ⅱ剩余的NH3需吸收处理。以下各种尾气吸收装置中,不能防止倒吸的是___________ ;

(4)实验III的实验目的是验证生铁在潮湿空气中会发生吸氧腐蚀。则A中试剂可选用__________ (填序号);
a NaOH溶液 b C2H5OH c NaCl溶液 d 稀硫酸
能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_________ ;
(5)写出实验IV中发生反应的离子方程式_________ ;若读数时C管液面低于D管液面,则测出的镁铝合金中镁的质量分数将_______ (填“偏高”、“偏低”或“无影响”)。

| 实验 | A中试剂 | B中试剂 | C中液体 |
| I | 饱和食盐水 | 电石 | H2O |
| II | 浓氨水 | NaOH固体 | CCl4 |
| III | 生铁 | H2O | |
| IV | NaOH溶液 | 镁铝合金 | H2O |
(2)实验I烧瓶B中发生反应的化学方程式是
(3)实验Ⅱ剩余的NH3需吸收处理。以下各种尾气吸收装置中,不能防止倒吸的是

(4)实验III的实验目的是验证生铁在潮湿空气中会发生吸氧腐蚀。则A中试剂可选用
a NaOH溶液 b C2H5OH c NaCl溶液 d 稀硫酸
能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是
(5)写出实验IV中发生反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某化学实验兴趣小组同学分别做了以下探究实验。
Ⅰ.探究乙酸乙酯在不同温度、不同浓度NaOH溶液中的水解速率。取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率。
已知:① ;
;
②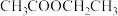 的沸点为77.1℃。
的沸点为77.1℃。
回答下列问题:
(1)
___________ ,
___________ ,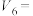
___________ 。
(2)实验中,可用饱和食盐水代替蒸馏水,以减小乙酸乙酯在水中的溶解度,使实验结果更准确,但不能用饱和 溶液代替蒸馏水,其原因为
溶液代替蒸馏水,其原因为___________ 。
(3)用油浴代替水浴,且当油浴温度超过100℃时,除乙酸乙酯的水解速率会加快外,还可能有___________ 。
Ⅱ.用稀硫酸与锌(足量)制取氢气的实验中,发现加入少量硫酸铜可以加快氢气的生成速率。为了进一步研究硫酸铜对氢气生成速率的影响,该同学设计了一系列实验。
(4)锌与硫酸铜反应的离子方程式为___________ 。
(5)该同学通过实验得出的结论为(假设其他条件均保持不变)
①当加入少量 固体时,生成氢气的速率会大大提高,原因为
固体时,生成氢气的速率会大大提高,原因为___________ 。
②但当加入的 固体超过一定量时,生成氢气的速率反而会下降,其原因可能为
固体超过一定量时,生成氢气的速率反而会下降,其原因可能为________ 。
Ⅰ.探究乙酸乙酯在不同温度、不同浓度NaOH溶液中的水解速率。取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率。
| 试管Ⅰ(55℃) | 试管Ⅱ(55℃) | 试管Ⅲ(55℃) | 试管Ⅳ(75℃) | |
| 乙酸乙酯的体积/mL | 1.5 |  |  |  |
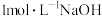 溶液的体积/mL 溶液的体积/mL | 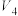 | 3.5 | 0 | 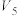 |
| 蒸馏水的体积/mL | 0 |  | 4.5 | 1.5 |
 ;
;②
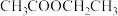 的沸点为77.1℃。
的沸点为77.1℃。回答下列问题:
(1)


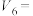
(2)实验中,可用饱和食盐水代替蒸馏水,以减小乙酸乙酯在水中的溶解度,使实验结果更准确,但不能用饱和
 溶液代替蒸馏水,其原因为
溶液代替蒸馏水,其原因为(3)用油浴代替水浴,且当油浴温度超过100℃时,除乙酸乙酯的水解速率会加快外,还可能有
Ⅱ.用稀硫酸与锌(足量)制取氢气的实验中,发现加入少量硫酸铜可以加快氢气的生成速率。为了进一步研究硫酸铜对氢气生成速率的影响,该同学设计了一系列实验。
(4)锌与硫酸铜反应的离子方程式为
(5)该同学通过实验得出的结论为(假设其他条件均保持不变)
①当加入少量
 固体时,生成氢气的速率会大大提高,原因为
固体时,生成氢气的速率会大大提高,原因为②但当加入的
 固体超过一定量时,生成氢气的速率反而会下降,其原因可能为
固体超过一定量时,生成氢气的速率反而会下降,其原因可能为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】电能与化学能的相互转化原理在实验、生产及生活中有着非常广泛的应用。
(1)某学习小组同学用锌片、石墨、ZnSO4溶液、NaBr-Br2溶液及盐桥等相关物品组装成一个双液电池(如图1所示),请在图中相应位置填上所用电极和溶液____ 。

(2)利用题下图所示装置可实现SO2的吸收,同时获得了硫黄、NaClO消毒液。

①甲池中碳纳米管上的电极反应式是______ 。
②图2装置乙池中的Y极可否改为与Mg电极相连,其理由是什么?______ 。
(3)以碱性CH4燃料电池为能源实现铁片镀铜的装置如图3所示。

①CH4发生的电极反应式是______ 。
②X电极是______ (填“铁片”中“铜片”)。
(1)某学习小组同学用锌片、石墨、ZnSO4溶液、NaBr-Br2溶液及盐桥等相关物品组装成一个双液电池(如图1所示),请在图中相应位置填上所用电极和溶液

(2)利用题下图所示装置可实现SO2的吸收,同时获得了硫黄、NaClO消毒液。

①甲池中碳纳米管上的电极反应式是
②图2装置乙池中的Y极可否改为与Mg电极相连,其理由是什么?
(3)以碱性CH4燃料电池为能源实现铁片镀铜的装置如图3所示。

①CH4发生的电极反应式是
②X电极是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】I.实验室利用反应:Zn+H2SO4=ZnSO4+H2↑制取氢气,其能量变化趋势如图所示:

(1)该反应为______ 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是______ (填字母)。
(3)若将上述反应设计成原电池,石墨棒为原电池某一极材料,则石墨棒为______ 极(填“正”或“负”)。石墨棒上产生的现象为______ 。
II.某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的物质的量随时间的变化曲线如图所示。回答下列问题:

(4)该反应的化学方程式为______ 。
(5)从开始至2min,用C表示的平均反应速率为______ 。
(6)在恒温恒容条件下,判断该反应达到化学平衡状态的标志是______ (填序号)。
①A、B、C的物质的量之比为3:1:3
②B的体积分数不再发生变化
③容器内的压强不再变化
④混合气体的密度不再变化

(1)该反应为
(2)若要使该反应的反应速率加快,下列措施可行的是
| A.改锌片为锌粉 | B.将稀硫酸改为98%的浓硫酸 |
| C.滴加几滴CuSO4溶液 | D.加入少量醋酸钠固体 |
II.某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的物质的量随时间的变化曲线如图所示。回答下列问题:

(4)该反应的化学方程式为
(5)从开始至2min,用C表示的平均反应速率为
(6)在恒温恒容条件下,判断该反应达到化学平衡状态的标志是
①A、B、C的物质的量之比为3:1:3
②B的体积分数不再发生变化
③容器内的压强不再变化
④混合气体的密度不再变化
您最近一年使用:0次



