工业上常利用含硫废水生产 Na2S2O3•5H2O,实验室可用如图装置(略去部分加持仪器)模拟生成过程。
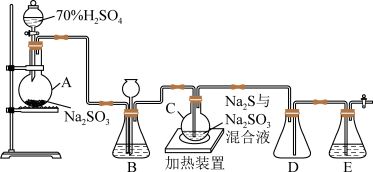
烧瓶C中发生反应如下 :
(I) Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
(II)2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
(III)S(s)+Na2SO3(aq) Na2S2O3(aq)
Na2S2O3(aq)
(1)仪器组装完成后,关闭两端活塞,向装置 B 中的长颈漏斗内注入液体至形成一段液注, 若____ 则整个装置气密性良好。 装置 D 的作用是_____
(2)装置 B 的作用之一是观察 SO2的生成速率,其中的液体最好选择_____
A.蒸馏水 B.饱和 Na2SO3溶液
C.饱和 NaHSO3溶液 D.饱和 NaHCO3 溶液
(3)为提高产品纯度,应使烧瓶 C 中 Na2S 和 Na2SO3恰好完全反应,则烧瓶 C 中 Na2S 和Na2SO3 物质的量之比_________
(4)经研究发现 SO2水溶液可以在 I-催化作用下发生歧化反应,可能的催化过程如下。将 ii 用离子方程式补充完整。i.SO2+4I-+4H+=S↓+2I2+2H2O ii.___________
(5)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取 0.214g KIO3 固体配成溶液,加入过量 KI 固体和 H2SO4溶液,再向其中加入 Na2S2O3与之反应,消耗 Na2S2O3溶液的体积为 24mL 时恰好完全反应。则 c(Na2S2O3)=________
(已知:IO3-+5I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-)

烧瓶C中发生反应如下 :
(I) Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
(II)2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
(III)S(s)+Na2SO3(aq)
 Na2S2O3(aq)
Na2S2O3(aq) (1)仪器组装完成后,关闭两端活塞,向装置 B 中的长颈漏斗内注入液体至形成一段液注, 若
(2)装置 B 的作用之一是观察 SO2的生成速率,其中的液体最好选择
A.蒸馏水 B.饱和 Na2SO3溶液
C.饱和 NaHSO3溶液 D.饱和 NaHCO3 溶液
(3)为提高产品纯度,应使烧瓶 C 中 Na2S 和 Na2SO3恰好完全反应,则烧瓶 C 中 Na2S 和Na2SO3 物质的量之比
(4)经研究发现 SO2水溶液可以在 I-催化作用下发生歧化反应,可能的催化过程如下。将 ii 用离子方程式补充完整。i.SO2+4I-+4H+=S↓+2I2+2H2O ii.
(5)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取 0.214g KIO3 固体配成溶液,加入过量 KI 固体和 H2SO4溶液,再向其中加入 Na2S2O3与之反应,消耗 Na2S2O3溶液的体积为 24mL 时恰好完全反应。则 c(Na2S2O3)=
(已知:IO3-+5I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-)
更新时间:2019-06-11 10:02:23
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
【推荐1】某研究性学习小组探究硫的化合物的制备和性质。
Ⅰ.制备二氧化硫
用70%的浓硫酸与 固体反应制备
固体反应制备 气体。
气体。
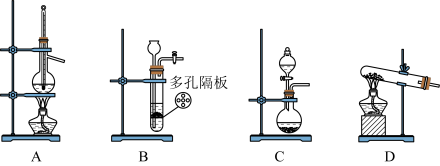
(1)制备 气体最合适的发生装置是
气体最合适的发生装置是_______ (填写字母)。
Ⅱ.制备硫代硫酸钠
已知:硫代硫酸钠易与酸反应。
反应原理: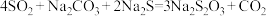
室温时,往 、
、 混合溶液中均匀通入
混合溶液中均匀通入 气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH值接近于7时,停止通入
气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH值接近于7时,停止通入 气体。
气体。
(2)制备 反应分三步进行
反应分三步进行
反应i: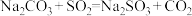 ;
;
反应ii: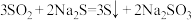 ;
;
反应iii的化学方程式为_______ 。
(3)当pH值接近于7时,停止通入 的原因是
的原因是_______ 。
Ⅲ.探究浓度对反应速率的影响
相同温度下,按下表中的体积将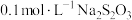 溶液、
溶液、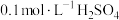 溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
通过实验绘制出的浑浊度随时间变化关系如图所示:
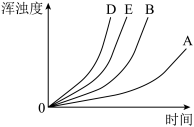
(4)①实验C、D、E探究_______ 溶液浓度对反应速率的影响。
②结合图像分析, 溶液、
溶液、 溶液二者相比,
溶液二者相比,_______ 溶液浓度的改变对化学反应速率的影响更大。
③请在答题卡相应的图中画出实验 对应的曲线
对应的曲线_______ 。
Ⅳ.探究性质
资料: 在酸性溶液中氧化
在酸性溶液中氧化 ,反应为:
,反应为: 。
。
向某浓度的过量 酸性溶液(含淀粉)中通入一定量后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
酸性溶液(含淀粉)中通入一定量后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
(5)某实验小组提出假设:t秒前生成了 ,但
,但 继续与溶液中的
继续与溶液中的 反应,且该反应速率较快,故溶液没有立刻变蓝,请写出
反应,且该反应速率较快,故溶液没有立刻变蓝,请写出 与
与 反应的离子方程式
反应的离子方程式_______ 。
(6)为验证该实验小组的假设合理,设计下面实验:
操作:向变蓝色的溶液中_______ ;现象:蓝色迅速消失,一段时间后再次变蓝。
Ⅰ.制备二氧化硫
用70%的浓硫酸与
 固体反应制备
固体反应制备 气体。
气体。
(1)制备
 气体最合适的发生装置是
气体最合适的发生装置是Ⅱ.制备硫代硫酸钠
已知:硫代硫酸钠易与酸反应。
反应原理:
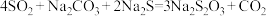
室温时,往
 、
、 混合溶液中均匀通入
混合溶液中均匀通入 气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH值接近于7时,停止通入
气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH值接近于7时,停止通入 气体。
气体。(2)制备
 反应分三步进行
反应分三步进行反应i:
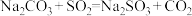 ;
;反应ii:
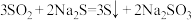 ;
;反应iii的化学方程式为
(3)当pH值接近于7时,停止通入
 的原因是
的原因是Ⅲ.探究浓度对反应速率的影响
相同温度下,按下表中的体积将
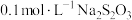 溶液、
溶液、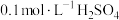 溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。| 实验标号 | 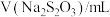 | 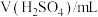 | V(蒸馏水)/mL |
| A | 1.5 | 3.5 | 10 |
| B | 2.5 | 3.5 | 9 |
| C | 3.5 | 3.5 | 8 |
| D | 3.5 | 2.5 | 9 |
| E | 3.5 | 1.5 | 10 |

(4)①实验C、D、E探究
②结合图像分析,
 溶液、
溶液、 溶液二者相比,
溶液二者相比,③请在答题卡相应的图中画出实验
 对应的曲线
对应的曲线Ⅳ.探究性质
资料:
 在酸性溶液中氧化
在酸性溶液中氧化 ,反应为:
,反应为: 。
。向某浓度的过量
 酸性溶液(含淀粉)中通入一定量后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
酸性溶液(含淀粉)中通入一定量后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。(5)某实验小组提出假设:t秒前生成了
 ,但
,但 继续与溶液中的
继续与溶液中的 反应,且该反应速率较快,故溶液没有立刻变蓝,请写出
反应,且该反应速率较快,故溶液没有立刻变蓝,请写出 与
与 反应的离子方程式
反应的离子方程式(6)为验证该实验小组的假设合理,设计下面实验:
操作:向变蓝色的溶液中
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】用如下图所示装置进行实验

(1)烧瓶B内发生反应的化学方程式是________________ 。在本实验中,往往选择质量分数75%左右的浓硫酸,试分析其原因________________ 。
(2)小试管C的作用是________________ 。
(3)广口瓶D内盛的试剂是____________ ,装置D的3个作用是:①_________ 、②_______ 、③_________ 。
(4)玻璃管E内发生反应的化学方程式是________________ 。
(5)装置F中U形管中所收集物质的成分是________________ 。
(6)若U形管内收集到的物质很少,分析其原因不可能是______________ (填序号)。
a、装置气密性不好
b、制得的SO2中混有少量H2S杂质使催化剂中毒
c、气流速度过快
(7)从U形管导出的尾气的处理方法是________________ ,相关反应的化学方程式为________________ 。

(1)烧瓶B内发生反应的化学方程式是
(2)小试管C的作用是
(3)广口瓶D内盛的试剂是
(4)玻璃管E内发生反应的化学方程式是
(5)装置F中U形管中所收集物质的成分是
(6)若U形管内收集到的物质很少,分析其原因不可能是
a、装置气密性不好
b、制得的SO2中混有少量H2S杂质使催化剂中毒
c、气流速度过快
(7)从U形管导出的尾气的处理方法是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】硫代硫酸钠晶体(Na2S2O3·5H2O)具有脱敏作用,临床上用于氰化物及腈类中毒,它又名“大苏打”、“海波”,易溶于水,难溶于乙醇,水溶液呈微弱的碱性,遇强酸发生剧烈反应。某化学兴趣小组通过查阅资料,对它的制备和性质进行了探究,研究过程如下:
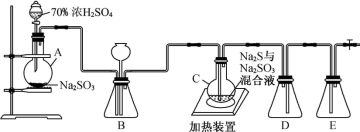
请回答下列问题:
Ⅰ.Na2S2O3的制备:已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
S(s)+Na2SO3(aq) Na2S2O3(aq)
Na2S2O3(aq)
(1)装置A中发生的化学反应方程式为___________ 。
(2)装置B中盛放浓硫酸,除干燥气体外,还起到的作用有___________ 。
(3)C装置中放入无水乙醇的目的是___________ 。
Ⅱ.测定产品(Na2S2O3·5H2O)的纯度。该小组同学称取m g该产品,用容量瓶配成250 mL溶液。另取c mol·L-1的K2Cr2O7标准溶液V mL,用硫酸酸化后加入过量KI,再加入几滴淀粉溶液,然后用硫代硫酸钠样品溶液滴定至蓝色褪去,且30 s不恢复原色。平行滴定3次所得测定数据如下表:
(4)已知滴定过程中发生的反应: 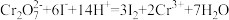 ;
; 。则样品纯度为
。则样品纯度为___________ (写出化简后表达式)。
Ⅲ.探究硫代硫酸钠(Na2S2O3)在化工上作脱氯剂的原理。下面是该兴趣小组利用制得的硫代硫酸钠样品模拟脱氯的实验装置,回答下列问题:

注:Ksp[BaS2O3]=6.96×10-11
(5)若要证明硫代硫酸钠可以作为脱氯剂,还需要补充的实验操作是___________ 。
(6)装置D作用是吸收Cl2,实验后检测到该溶液中含有ClO-、 等离子,则c(H+)-c(OH-)=
等离子,则c(H+)-c(OH-)=___________ ,若D中ClO-与 的物质的量之比为5︰1,则Cl2与NaOH的离子反应方程式为
的物质的量之比为5︰1,则Cl2与NaOH的离子反应方程式为___________ 。

请回答下列问题:
Ⅰ.Na2S2O3的制备:已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
S(s)+Na2SO3(aq)
 Na2S2O3(aq)
Na2S2O3(aq)(1)装置A中发生的化学反应方程式为
(2)装置B中盛放浓硫酸,除干燥气体外,还起到的作用有
(3)C装置中放入无水乙醇的目的是
Ⅱ.测定产品(Na2S2O3·5H2O)的纯度。该小组同学称取m g该产品,用容量瓶配成250 mL溶液。另取c mol·L-1的K2Cr2O7标准溶液V mL,用硫酸酸化后加入过量KI,再加入几滴淀粉溶液,然后用硫代硫酸钠样品溶液滴定至蓝色褪去,且30 s不恢复原色。平行滴定3次所得测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 消耗样品溶液体积/mL | 24.79 | 22.30 | 24.81 |
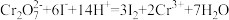 ;
; 。则样品纯度为
。则样品纯度为Ⅲ.探究硫代硫酸钠(Na2S2O3)在化工上作脱氯剂的原理。下面是该兴趣小组利用制得的硫代硫酸钠样品模拟脱氯的实验装置,回答下列问题:

注:Ksp[BaS2O3]=6.96×10-11
(5)若要证明硫代硫酸钠可以作为脱氯剂,还需要补充的实验操作是
(6)装置D作用是吸收Cl2,实验后检测到该溶液中含有ClO-、
 等离子,则c(H+)-c(OH-)=
等离子,则c(H+)-c(OH-)= 的物质的量之比为5︰1,则Cl2与NaOH的离子反应方程式为
的物质的量之比为5︰1,则Cl2与NaOH的离子反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】甲醚是重要的有机合成原料,甲醇制备甲醚的反应: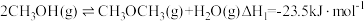 ;工业上常用CO2或CO催化氢化法合成CH3OH。回答下列问题:
;工业上常用CO2或CO催化氢化法合成CH3OH。回答下列问题:
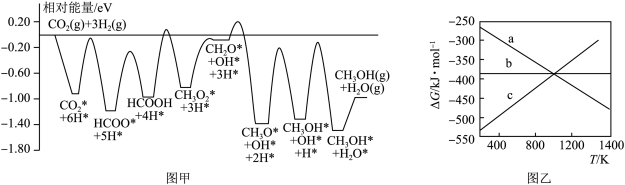
(1)CO2和H2在某催化剂表面合成CH3OH: ,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为
,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为___________ 。已知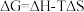 (△H、△S随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是
(△H、△S随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是___________ (填代号)。
(2)CO催化加氢法合成CH3OH,进而制备CH3OCH3的过程中涉及如下反应:
反应I: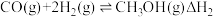
反应II: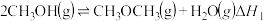
反应III: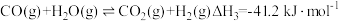
①在298K,101kPa时,CO(g)、H2(g)、CH3OH(g)的摩尔燃烧焓如下表:
则△H2=___________ 。
②一定温度下,向2L恒容密闭容器中充入2molCO(g)和4molH2(g)制备,初始压强为p0Pa,5min达到平衡时CO(g)的转化率为70%,c(CH3OH)=2c(CH3OCH3),且c(H2)=0.9mol⋅L-1.则0~5min内,v(CO)=___________ mol。L-1.min-1;反应I的平衡常数Kp=___________ (用p0表示);平衡后,保持温度和容器体积不变,向容器中再充入1molCO(g)和2molH2(g),重新达到平衡后,CH3OCH3(g)的物质的量分数___________ (填“增大”、“减小”或“不变”)。
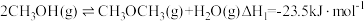 ;工业上常用CO2或CO催化氢化法合成CH3OH。回答下列问题:
;工业上常用CO2或CO催化氢化法合成CH3OH。回答下列问题:(1)CO2和H2在某催化剂表面合成CH3OH:
 ,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为
,反应历程如图甲所示,其中吸附在催化剂表面上的物种用*标注。该反应历程中活化能最小步骤的化学方程式为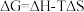 (△H、△S随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是
(△H、△S随温度的变化不大),随温度的变化关系如图乙所示,图中表示该反应的直线是
(2)CO催化加氢法合成CH3OH,进而制备CH3OCH3的过程中涉及如下反应:
反应I:
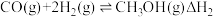
反应II:
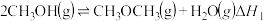
反应III:
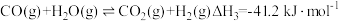
①在298K,101kPa时,CO(g)、H2(g)、CH3OH(g)的摩尔燃烧焓如下表:
| 物质 | CO(g) | H2(g) | CH3OH(g) |
| 摩尔燃烧焓(△H)/(kJ·mol-1) | -283.0 | -285.8 | -726.5 |
②一定温度下,向2L恒容密闭容器中充入2molCO(g)和4molH2(g)制备,初始压强为p0Pa,5min达到平衡时CO(g)的转化率为70%,c(CH3OH)=2c(CH3OCH3),且c(H2)=0.9mol⋅L-1.则0~5min内,v(CO)=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】目前,我国发电机装机容量已经突破4亿KW,其中绝大多数为燃煤机组,电厂每生产1千KWh的电力,排放2.1kgNOx。有人对氮氧化物的排放的控制,总结为“一石击五鸟”,包括生态系统问题、生态富营养化问题、臭氧问题、颗粒物灰霾问题、大气中氮氧化物问题。脱硝技术和吸收、转化是当今世界的主题。
(1)碱液吸收法:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO2+2NaOH=2NaNO2+H2O,NO2和NO混合气体要想完全被NaOH溶液吸收,则V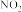 :VNO的范围为
:VNO的范围为____ 。
(2)汽车尾气“催化转化法”:现有的汽车尾气处理是把NO和CO转化为无毒可供大气循环的气体,通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染____ 。
(3)研究CO还原NOx对环境的治理有重要意义,相关的主要化学反应有:
I.NO2(g)+CO(g) CO2(g)+NO(g) △H1
CO2(g)+NO(g) △H1
II.2NO2(g)+4CO(g) N2(g)+4CO2(g) △H2<0
N2(g)+4CO2(g) △H2<0
III.2NO(g)+2CO(g) N2(g)+2CO2(g) △H3<0
N2(g)+2CO2(g) △H3<0
下列描述不正确的是____ 。
(4)SNCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
①已知:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H1=-1269.0kJ·mol-1;
2N2(g)+6H2O(g) △H1=-1269.0kJ·mol-1;
N2(g)+O2(g) 2NO(g) △H2=180.8kJ·mol-1
2NO(g) △H2=180.8kJ·mol-1
则反应4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g)△H=
4N2(g)+6H2O(g)△H=____ 。
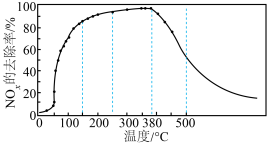
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应容器中反应10min时测得NOx的去除率随反应温度的变化曲线如图所示,请解释当反应温度高于380℃时NOx的去除率随温度升高先迅速下降后缓慢下降的原因____ 。
③请在图中画出反应8min时NOx的去除率随温度变化的曲线____ 。
(1)碱液吸收法:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO2+2NaOH=2NaNO2+H2O,NO2和NO混合气体要想完全被NaOH溶液吸收,则V
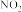 :VNO的范围为
:VNO的范围为(2)汽车尾气“催化转化法”:现有的汽车尾气处理是把NO和CO转化为无毒可供大气循环的气体,通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染
| 反应 | 25°C时的平衡常数 | 焓变 |
反应I:2NO(g) N2(g)+O2(g) N2(g)+O2(g) | K1=1×1030 | △H=-180.0kJ·mol-1 |
反应II:2CO2(g) 2CO(g)+O2(g) 2CO(g)+O2(g) | K2=4×10-92 | △H=566.0kJ·mol-1 |
(3)研究CO还原NOx对环境的治理有重要意义,相关的主要化学反应有:
I.NO2(g)+CO(g)
 CO2(g)+NO(g) △H1
CO2(g)+NO(g) △H1II.2NO2(g)+4CO(g)
 N2(g)+4CO2(g) △H2<0
N2(g)+4CO2(g) △H2<0III.2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H3<0
N2(g)+2CO2(g) △H3<0下列描述不正确的是
| A.在恒温恒容密闭容器中只进行反应I,若压强不变,能说明反应I达到平衡状态 |
| B.反应III△H<0,△S<0;该反应在低温下自发进行 |
| C.恒温条件下,增大CO的浓度能使反应III的平衡向正向移动,平衡常数不变 |
| D..上述反应达到平衡后,瞬间升温后,三个反应的逆反应速率均一直增大至达到新的平衡 |
(4)SNCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)①已知:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H1=-1269.0kJ·mol-1;
2N2(g)+6H2O(g) △H1=-1269.0kJ·mol-1;N2(g)+O2(g)
 2NO(g) △H2=180.8kJ·mol-1
2NO(g) △H2=180.8kJ·mol-1则反应4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g)△H=
4N2(g)+6H2O(g)△H=②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应容器中反应10min时测得NOx的去除率随反应温度的变化曲线如图所示,请解释当反应温度高于380℃时NOx的去除率随温度升高先迅速下降后缓慢下降的原因
③请在图中画出反应8min时NOx的去除率随温度变化的曲线

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】2024上海国际碳中和技术博览会以“中和科技、碳索未来”为主题,重点聚焦二氧化碳的捕、利用与封存(CCUS)等问题。回答下列问题:
I. 还原
还原 制取
制取 。发生的反应如下:
。发生的反应如下:
反应①:

反应②:

反应③:
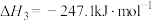
(1)经计算反应①
___________ ,该反应在___________ (填“高温”“低温”或“任何温度”)下能自发进行。
(2)在容积不变的密闭体系中仅发生反应②。实验发现,其他条件不变,在相同时间内,向反应②的平衡体系中投入一定量的CaO可以增大 的体积分数,对比实验的结果如图所示:
的体积分数,对比实验的结果如图所示:

微米CaO和纳米CaO对平衡影响不同的原因是___________ 。
II. 还原
还原 制取
制取 。反应原理为:
。反应原理为:
 。
。
(3) 催化加氢制
催化加氢制 的一种反应历程如图所示(吸附在催化剂表面的物质用“*”标注,如“
的一种反应历程如图所示(吸附在催化剂表面的物质用“*”标注,如“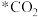 ”表示
”表示 吸附在催化剂表面)
吸附在催化剂表面)

该反应历程中决速步反应的化学方程式为___________ 。
(4)若 和
和 起始物质的量之比为1:3,该反应在有、无分子筛膜时甲醇的平衡产率随温度的变化如图所示[分子筛膜能选择性分离出
起始物质的量之比为1:3,该反应在有、无分子筛膜时甲醇的平衡产率随温度的变化如图所示[分子筛膜能选择性分离出 ]。有分子筛膜时,温度高于210℃后甲醇平衡产率随温度升高而降低的原因是
]。有分子筛膜时,温度高于210℃后甲醇平衡产率随温度升高而降低的原因是___________ 。

(5)一定条件下,向4L恒容密闭容器中充入 和
和 ,发生反应
,发生反应 。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
___________ 。(该反应标准平衡常数的表达式为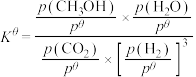 ,其中p为分压,分压=总压×物质的量分数,
,其中p为分压,分压=总压×物质的量分数,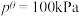 )
)
III. 和
和 电化学法制取HCOOH()。
电化学法制取HCOOH()。 (
(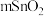 /CC)和CuO纳米片(CuONS/CF)为催化电极,工作原理如图所示。
/CC)和CuO纳米片(CuONS/CF)为催化电极,工作原理如图所示。

(6)CuO纳米片(CuONS/CF)表面发生的电极反应式为___________ ,若有 通过质子交换膜时,电解池中生成
通过质子交换膜时,电解池中生成 和HCOOH共
和HCOOH共___________ mol。
I.
 还原
还原 制取
制取 。发生的反应如下:
。发生的反应如下:反应①:


反应②:


反应③:

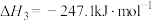
(1)经计算反应①

(2)在容积不变的密闭体系中仅发生反应②。实验发现,其他条件不变,在相同时间内,向反应②的平衡体系中投入一定量的CaO可以增大
 的体积分数,对比实验的结果如图所示:
的体积分数,对比实验的结果如图所示:
微米CaO和纳米CaO对平衡影响不同的原因是
II.
 还原
还原 制取
制取 。反应原理为:
。反应原理为:
 。
。(3)
 催化加氢制
催化加氢制 的一种反应历程如图所示(吸附在催化剂表面的物质用“*”标注,如“
的一种反应历程如图所示(吸附在催化剂表面的物质用“*”标注,如“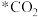 ”表示
”表示 吸附在催化剂表面)
吸附在催化剂表面)
该反应历程中决速步反应的化学方程式为
(4)若
 和
和 起始物质的量之比为1:3,该反应在有、无分子筛膜时甲醇的平衡产率随温度的变化如图所示[分子筛膜能选择性分离出
起始物质的量之比为1:3,该反应在有、无分子筛膜时甲醇的平衡产率随温度的变化如图所示[分子筛膜能选择性分离出 ]。有分子筛膜时,温度高于210℃后甲醇平衡产率随温度升高而降低的原因是
]。有分子筛膜时,温度高于210℃后甲醇平衡产率随温度升高而降低的原因是
(5)一定条件下,向4L恒容密闭容器中充入
 和
和 ,发生反应
,发生反应 。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
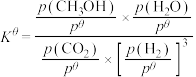 ,其中p为分压,分压=总压×物质的量分数,
,其中p为分压,分压=总压×物质的量分数,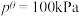 )
)III.
 和
和 电化学法制取HCOOH()。
电化学法制取HCOOH()。 (
( /CC)和CuO纳米片(CuONS/CF)为催化电极,工作原理如图所示。
/CC)和CuO纳米片(CuONS/CF)为催化电极,工作原理如图所示。
(6)CuO纳米片(CuONS/CF)表面发生的电极反应式为
 通过质子交换膜时,电解池中生成
通过质子交换膜时,电解池中生成 和HCOOH共
和HCOOH共
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】海沧校区某化学兴趣小组在求真楼103室制备碱式碳酸铜并检验。
I.小组成员按照下图流程进行碱式碳酸铜的制备。

(1)①Cu2+基态核外电子排布式为___________ 。
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,其中发生的化学反应的离子方程式为___________ 。而反应温度需低于80℃的原因是___________ 。
(2)步骤ⅲ中,检验滤渣是否洗涤干净的实验操作是___________ 。
Ⅱ.碱式碳酸铜的检验:同学们设计了如图装置,针对制得的蓝绿色固体进行检验。

(3)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯。装置A中发生反应的离子方程式为___________ ,C中盛装的试剂应是___________ 。
(4)若蓝绿色圈体的组成为xCuCO3·yCu(OH)2,实验能观察到的现象是___________ 。
(5)同学们查阅文献得知: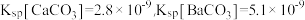 ,经讨论认为用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式会更好,其原因是
,经讨论认为用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式会更好,其原因是___________ (选填下列字母代号);
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(6)若蓝绿色固体的组成为xCuCO3·yCu(OH)2.取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g(F中已改为Ba(OH)2溶液)。则该蓝绿色固体的化学式为___________ 。
I.小组成员按照下图流程进行碱式碳酸铜的制备。

(1)①Cu2+基态核外电子排布式为
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,其中发生的化学反应的离子方程式为
(2)步骤ⅲ中,检验滤渣是否洗涤干净的实验操作是
Ⅱ.碱式碳酸铜的检验:同学们设计了如图装置,针对制得的蓝绿色固体进行检验。

(3)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯。装置A中发生反应的离子方程式为
(4)若蓝绿色圈体的组成为xCuCO3·yCu(OH)2,实验能观察到的现象是
(5)同学们查阅文献得知:
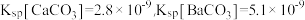 ,经讨论认为用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式会更好,其原因是
,经讨论认为用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式会更好,其原因是a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(6)若蓝绿色固体的组成为xCuCO3·yCu(OH)2.取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体,测得F中干燥后的沉淀质量为7.88g(F中已改为Ba(OH)2溶液)。则该蓝绿色固体的化学式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4•7H2O的流程如图:
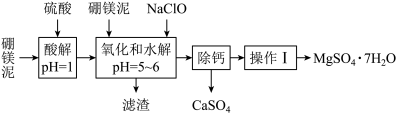
根据题意回答下列问题:
(1)实验中需用1.0mol•L-1的硫酸240mL,若用18.4mol•L-1的浓硫酸来配制,所需的仪器除了烧杯、量筒、玻璃棒,还需的玻璃仪器是_____ 。
(2)加入的NaClO可与Mn2+反应:Mn2++ClO—+H2O=MnO2↓+2H++Cl—,还有一种阳离子也会被NaClO氧化,该反应的离子方程式为_____ 。
(3)滤渣的主要成分中除含有Fe(OH)3、Al(OH)3外,还有_____ 。
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法:_____ 。
(5)已知MgSO4、CaSO4的溶解度如表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据表中数据,简要说明操作步骤:_____ 。“操作1”是将滤液继续_____ 、过滤、洗涤,便得到了MgSO4•7H2O。
(6)实验中提供的硼镁泥共10g,得到的MgSO4•7H2O为17.22g,则MgSO4•7H2O的产率为_____ 。

根据题意回答下列问题:
(1)实验中需用1.0mol•L-1的硫酸240mL,若用18.4mol•L-1的浓硫酸来配制,所需的仪器除了烧杯、量筒、玻璃棒,还需的玻璃仪器是
(2)加入的NaClO可与Mn2+反应:Mn2++ClO—+H2O=MnO2↓+2H++Cl—,还有一种阳离子也会被NaClO氧化,该反应的离子方程式为
(3)滤渣的主要成分中除含有Fe(OH)3、Al(OH)3外,还有
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法:
(5)已知MgSO4、CaSO4的溶解度如表:
| 温度/℃ | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)实验中提供的硼镁泥共10g,得到的MgSO4•7H2O为17.22g,则MgSO4•7H2O的产率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】利用钻渣[含Co(OH)2、Fe2O3、Al2O3、MnO等)可以来制取钻的氧化物和CoCl2·6H2O,工艺流程如图所示:
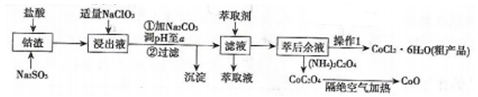
①部分阳离于以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
②CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
回答下列问题:
(1)浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等,浸出过程中Co(OH)3发生反应的离子方程式为________ 。
(2)流程中加入适量的NaClO3的作用是___________ 。若加入NaClO3过量,可能产生有毒气体,写出生成该有毒气体的离子方程式___________________ 。
(3)加入Na2CO3调节溶液的pH=a,a的范围最好是___________ 。沉淀的主要成分是______ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。向“滤液”中加入萃取剂的目的是________ ;其使用的最佳pH范围是________ 。
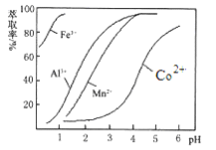
A. 2.0~2.5 B. 3.0~3.5 C. 4.0~4.5 D. 5.0~5.5
(5)“操作1”中包含3个基本实验操作,它们依次是______ 、______ 和过滤。
(6)隔绝空气加热CoC2O4生成CoO和碳的氧化物,对应的化学方程式为_______________ 。

①部分阳离于以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
②CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
回答下列问题:
(1)浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等,浸出过程中Co(OH)3发生反应的离子方程式为
(2)流程中加入适量的NaClO3的作用是
(3)加入Na2CO3调节溶液的pH=a,a的范围最好是
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。向“滤液”中加入萃取剂的目的是

A. 2.0~2.5 B. 3.0~3.5 C. 4.0~4.5 D. 5.0~5.5
(5)“操作1”中包含3个基本实验操作,它们依次是
(6)隔绝空气加热CoC2O4生成CoO和碳的氧化物,对应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】硒(Se)是一种新型半导体材料;银是一种物理化学性质优良的贵重金属,需求逐年上升。实验室模拟工业对富硒废料(含 、
、 )进行综合处理的一种工艺流程如下:
)进行综合处理的一种工艺流程如下:

(1)焙烧时应把废料于_______ 中(填仪器名称),为提高焙烧效率可采取的措施_______ (写一条即可)。
(2) 应选用
应选用_______ (填“浓”或“稀”)溶液,原因是_______ 。
(3)操作1的名称是_______ 。
(4)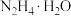 还原过程中产生了对环境友好的气体,其氧化剂为
还原过程中产生了对环境友好的气体,其氧化剂为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
(5)如图装置可以制备一水合肼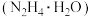 ,其阳极的电极反应式为
,其阳极的电极反应式为_______ 。

(6)有机溶剂为煤油与硫醚的混合物。对操作1中有机溶剂组成、浸出液酸度对萃取率的影响做如下探究,结果如图1、图2所示,则得出的结论为_______ 。(浸出液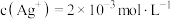 )
)

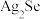 、
、 )进行综合处理的一种工艺流程如下:
)进行综合处理的一种工艺流程如下:
(1)焙烧时应把废料于
(2)
 应选用
应选用(3)操作1的名称是
(4)
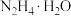 还原过程中产生了对环境友好的气体,其氧化剂为
还原过程中产生了对环境友好的气体,其氧化剂为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(5)如图装置可以制备一水合肼
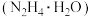 ,其阳极的电极反应式为
,其阳极的电极反应式为
(6)有机溶剂为煤油与硫醚的混合物。对操作1中有机溶剂组成、浸出液酸度对萃取率的影响做如下探究,结果如图1、图2所示,则得出的结论为
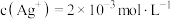 )
)
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】某校化学小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3质量分数的探究实验,他们提出下列实验方案:
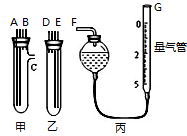
(1)小明同学用图中的发生、收集装置。甲、乙两试管各有两根导管,连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体。则稀硫酸应置于____ 中(填“甲”或“乙”);G管可以用化学实验室里的一种常用仪器代替,你认为这种仪器的名称是____ 。仪器甲、乙接口的连接方式如下:A连接___ ,C连接F;(填写接口的编号)
(2)小李同学用沉淀法测定Na2SO3的质量分数。
操作流程:

①操作Ⅱ的名称是_______ 。
②操作Ⅰ之前,为判断所加BaCl2溶液是否过量, 设计如下方案,其中最合理的是___ 。
A.取少量上层清液,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
B.待浊液澄清后,继续滴加BaCl2,若无沉淀产生则说明BaCl2已过量。
C.待浊液澄清后,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
③根据以上数据得出Na2SO3的质量分数为_____ 。
④小丽同学经认真分析,上述实验操作均正确,但发现实验结果与预期相差较大,请你推测可能的原因是______ ,验证方法__________ 。

(1)小明同学用图中的发生、收集装置。甲、乙两试管各有两根导管,连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体。则稀硫酸应置于
(2)小李同学用沉淀法测定Na2SO3的质量分数。
操作流程:

①操作Ⅱ的名称是
②操作Ⅰ之前,为判断所加BaCl2溶液是否过量, 设计如下方案,其中最合理的是
A.取少量上层清液,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
B.待浊液澄清后,继续滴加BaCl2,若无沉淀产生则说明BaCl2已过量。
C.待浊液澄清后,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
③根据以上数据得出Na2SO3的质量分数为
④小丽同学经认真分析,上述实验操作均正确,但发现实验结果与预期相差较大,请你推测可能的原因是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。实验室拟以下列方法制取CuCl:在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl。试回答以下问题:
(1)CuCl制备过程中需配制物质的量浓度为0.16mol·L-1的CuSO4溶液。
①配制950mL 0.16mol·L-1的CuSO4溶液应称取胆矾的质量为________ g。
②某学生实际配制CuSO4溶液的浓度为0.18mol·L-1,原因可能是________ 。
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时俯视刻度
(2)写出用上述方法制备CuCl的离子方程式_______________________________ 。
(3)在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。其中“于70℃真空干燥”的目的是____________ ; ______________________ (回答两点)。
(4)据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl。其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是________ 。
A.氧化产物是HO2 B.HO2在碱中能稳定存在
C.1mol O2 参加反应有1mol电子发生转移 D.Cu被氧化
(1)CuCl制备过程中需配制物质的量浓度为0.16mol·L-1的CuSO4溶液。
①配制950mL 0.16mol·L-1的CuSO4溶液应称取胆矾的质量为
②某学生实际配制CuSO4溶液的浓度为0.18mol·L-1,原因可能是
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时俯视刻度
(2)写出用上述方法制备CuCl的离子方程式
(3)在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。其中“于70℃真空干燥”的目的是
(4)据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl。其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.氧化产物是HO2 B.HO2在碱中能稳定存在
C.1mol O2 参加反应有1mol电子发生转移 D.Cu被氧化
您最近一年使用:0次



