运用所学知识,解决下列问题:
(1)AgNO3的水溶液呈______ (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_____ ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,目的是______ 。
(2)今有常温下五种溶液:NH4Cl溶液 CH3COONa溶液 (NH4)2SO4溶液 NH4HSO4溶液 NaOH溶液
①NH4Cl溶液的pH_____ 7(填“>”、“<”或“=”),升高温度可以_______ (填“促进”或“抑制”)NH4Cl的水解;
②pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH_______ NaOH溶液的pH(填“>”“=”或“<”);
③浓度相同的下列三种溶液:(A)NH4Cl溶液(B) (NH4)2SO4溶液(C)NH4HSO4 溶液,则c(NH4+)由大到小的顺序为____ >___ >____ (用序号填空)。
(3)蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合并加热,可得到无水AlCl3,试解释原因________ 。 (提示:SOCl2与水反应的化学方程式为SOCl2 +H2O = SO2↑+ 2HCl↑)
(1)AgNO3的水溶液呈
(2)今有常温下五种溶液:NH4Cl溶液 CH3COONa溶液 (NH4)2SO4溶液 NH4HSO4溶液 NaOH溶液
①NH4Cl溶液的pH
②pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH
③浓度相同的下列三种溶液:(A)NH4Cl溶液(B) (NH4)2SO4溶液(C)NH4HSO4 溶液,则c(NH4+)由大到小的顺序为
(3)蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合并加热,可得到无水AlCl3,试解释原因
更新时间:2019-07-04 20:24:57
|
相似题推荐
【推荐1】优化的NaFePO4复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是FeS2,含少量SiO2等杂质)为原料制备NaFePO4的流程如图所示。
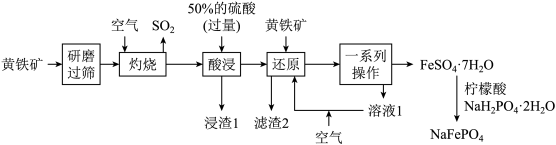
已知:“滤渣2”中不含硫单质。涉及离子的氢氧化物常温下的溶度积常数如表。(当离子的物质的量浓度≤10-5mol·L-1时,认为沉淀完全,lg4=0.6)
回答下列问题:
(1)“研磨”的目的是_______ 。
(2)“灼烧”时的大量尾气直接排放,会引起的主要环境问题为_______ (填一种)。
(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为_______ (答一条即可)。
(4)“浸渣1”的主要成分是_______ (填化学式) 。
(5)“还原”中FeS2与Fe3+反应的离子方程式为_______ ;通入空气的条件下, “溶液1”可在“还原”步骤中循环利用,则通入空气的目的是_______ 。
(6)“一系列操作”包括_______ 、_______ 、过滤、 洗涤和低温干燥。
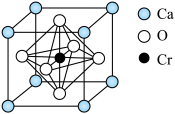
(7)铬与铁为同周期元素,某含铬化合物立方晶胞如图所示。晶体的化学式为_______ ;与Cr最近的氧原子的个数为_______ ;Ca 和Cr的最近距离为a nm,设NA为阿伏加德常数的值,则该晶体密度为_______ (填含 a、NA的表达式)g· cm-3。

已知:“滤渣2”中不含硫单质。涉及离子的氢氧化物常温下的溶度积常数如表。(当离子的物质的量浓度≤10-5mol·L-1时,认为沉淀完全,lg4=0.6)
| 离子 | Fe2+ | Fe3+ |
| Ksp | 8×10-16 | 4×0-38 |
(1)“研磨”的目的是
(2)“灼烧”时的大量尾气直接排放,会引起的主要环境问题为
(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为
(4)“浸渣1”的主要成分是
(5)“还原”中FeS2与Fe3+反应的离子方程式为
(6)“一系列操作”包括
(7)铬与铁为同周期元素,某含铬化合物立方晶胞如图所示。晶体的化学式为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】工业生产、生活中需要优质的水资源,可选用不同的化学物质进行预处理。
(1)FeCl3具有净水作用,但其溶液会腐蚀钢铁设备,除H+作用外,另一主要原因是_______________________ (用离子方程式表示)。
(2)NH4Fe(SO4)2用作工业废水的凝结剂,为检验其中的铁元素可选用的试剂是_____ 。相同条件下,0.1 mol/L NH4Fe(SO4)2中c(Fe3+)______ 0.1 mol/L FeCl3中c(Fe3+)。(填“=”、“<”或“>”)
(3)氯水可以杀菌消毒。氯水中存在多个平衡,含氯元素的平衡是____________ 。已知HClO的杀菌能力比ClO–强,氯水处理饮用水时,在夏季的杀菌效果比在冬季差,可能原因是_______________________ (一种原因即可)。
(4)在氯水中,下列关系正确的是_______ (选填编号)。
a.c(H+) = c(ClO–)+ c(Cl–) b.c(H+) = c(ClO–)+ c(Cl–)+ c(OH–)
c.c(HClO) < c(Cl–) d.c(Cl–) < c(OH–)
(5)工业上用ClO2除去水中的MnCl2,产物为MnO2和盐酸。写出该反应的化学方程式_____________________________ 。
(1)FeCl3具有净水作用,但其溶液会腐蚀钢铁设备,除H+作用外,另一主要原因是
(2)NH4Fe(SO4)2用作工业废水的凝结剂,为检验其中的铁元素可选用的试剂是
(3)氯水可以杀菌消毒。氯水中存在多个平衡,含氯元素的平衡是
(4)在氯水中,下列关系正确的是
a.c(H+) = c(ClO–)+ c(Cl–) b.c(H+) = c(ClO–)+ c(Cl–)+ c(OH–)
c.c(HClO) < c(Cl–) d.c(Cl–) < c(OH–)
(5)工业上用ClO2除去水中的MnCl2,产物为MnO2和盐酸。写出该反应的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】水体中氮含量过高会对水中生物构成安全威胁,氨氮硝氮是氮的主要存在形态。
(1)某工业氨氮废水的处理流程如下图所示:
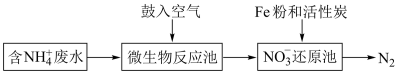
①写出“微生物反应池”中反应的离子方程式:___________ 。
②“NO 还原池”通过形成铁碳原电池对废水中的NO
还原池”通过形成铁碳原电池对废水中的NO 等进行处理,写出NO
等进行处理,写出NO 在正极发生的电极反应:
在正极发生的电极反应:___________ 。
(2)向氨氮废水中加入NaClO,可以将NH 最终氧化为N2。NaClO除去水中氨氮的反应过程如下:
最终氧化为N2。NaClO除去水中氨氮的反应过程如下:
i.ClO—+H2O OH-+HClO
OH-+HClO
ii.NH +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+
ii.NH3·H2O+HClO=NH2Cl+2H2O
iv.……
v.H++OH—=H2O
①写出反应iv的离子方程式:___________ 。
②废水中氨氮去除率与初始pH有关。保持其他条件不变,随初始pH的升高,溶液中c(HClO)___________ (填“增大”“不变”或“减小”,下同),c(NH3·H2O)___________ 。
③研究发现,保持其他条件相同,废水中氨氮去除率随温度的升高先升高后降低。当温度>35℃时,氨氮去除率随溶液温度升高而降低的原因可能是___________ (答一条)。
(3)利用双离子交换膜电解法可以处理含NH4NO3的工业废水,并获得氨水和硝酸,原理如图所示:
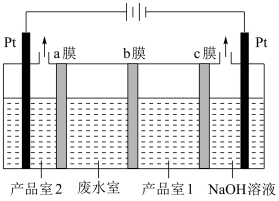
b膜属于___________ (填“阴”或“阳”)离子交换膜;为增强溶液的导电性,电解前产品室2中的溶液应是___________ 。
(1)某工业氨氮废水的处理流程如下图所示:

①写出“微生物反应池”中反应的离子方程式:
②“NO
 还原池”通过形成铁碳原电池对废水中的NO
还原池”通过形成铁碳原电池对废水中的NO 等进行处理,写出NO
等进行处理,写出NO 在正极发生的电极反应:
在正极发生的电极反应:(2)向氨氮废水中加入NaClO,可以将NH
 最终氧化为N2。NaClO除去水中氨氮的反应过程如下:
最终氧化为N2。NaClO除去水中氨氮的反应过程如下:i.ClO—+H2O
 OH-+HClO
OH-+HClOii.NH
 +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+ii.NH3·H2O+HClO=NH2Cl+2H2O
iv.……
v.H++OH—=H2O
①写出反应iv的离子方程式:
②废水中氨氮去除率与初始pH有关。保持其他条件不变,随初始pH的升高,溶液中c(HClO)
③研究发现,保持其他条件相同,废水中氨氮去除率随温度的升高先升高后降低。当温度>35℃时,氨氮去除率随溶液温度升高而降低的原因可能是
(3)利用双离子交换膜电解法可以处理含NH4NO3的工业废水,并获得氨水和硝酸,原理如图所示:

b膜属于
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】锗(Ge)是门捷列夫在1871年所预言的元素“亚硅”,高纯度的锗已成为目前重要的半导体材料,其化合物在治疗癌症方面也有着独特的功效。下图是以锗锌矿(主要成分为 、ZnS,另外含有少量的
、ZnS,另外含有少量的 等)为主要原料生产高纯度锗的工艺流程:
等)为主要原料生产高纯度锗的工艺流程:
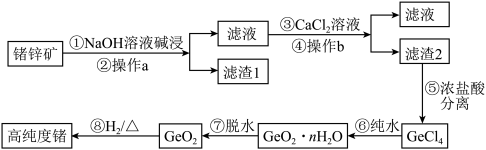
已知: 可溶于强碱溶液,生成锗酸盐。
可溶于强碱溶液,生成锗酸盐。 的熔点为
的熔点为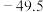 ℃,沸点为84℃,在水中或酸的稀溶液中易水解。
℃,沸点为84℃,在水中或酸的稀溶液中易水解。
(1)Ge位于ⅣA族,属于_______ 区, 晶体所属类别是
晶体所属类别是_______ 。
(2)步骤①NaOH溶液碱浸时发生的离子反应方程式为_______ 。
(3)步骤③沉锗过程中,当温度为90℃,pH为14时,加料量(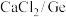 质量比)对沉锗的影响如表所示,选择最佳加料量为
质量比)对沉锗的影响如表所示,选择最佳加料量为_______ (填“10-15”“15-20”或“20-25”)。
(4)步骤⑤中选择浓盐酸而不选择稀盐酸的原因是_______ 。
(5)步骤⑥的化学反应方程式为_______ 。
(6)Ge元素的单质及其化合物都具有独特的优异性能。请回答下列问题:
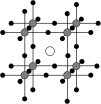
①量子化学计算显示含锗化合物 具有良好的光电化学性能。
具有良好的光电化学性能。 是
是 的量子化学计算模型,
的量子化学计算模型, 的晶体结构如图所示,若设定图中体心钙离子的分数坐标为
的晶体结构如图所示,若设定图中体心钙离子的分数坐标为 ,则分数坐标为
,则分数坐标为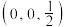 的离子是
的离子是_______ 。
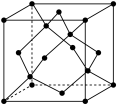
②晶体Ge是优良的半导体,可作高频率电流的检波和交流电的整流用。如图为Ge单晶的晶胞,设Ge原子半径为r pm,其中晶胞体对角线长度为8r pm,阿伏加德罗常数的值为 ,则该锗晶体的密度计算式为(不需化简)
,则该锗晶体的密度计算式为(不需化简)
_______  。(已知相对原子量:Ge 73)
。(已知相对原子量:Ge 73)
 、ZnS,另外含有少量的
、ZnS,另外含有少量的 等)为主要原料生产高纯度锗的工艺流程:
等)为主要原料生产高纯度锗的工艺流程:
已知:
 可溶于强碱溶液,生成锗酸盐。
可溶于强碱溶液,生成锗酸盐。 的熔点为
的熔点为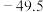 ℃,沸点为84℃,在水中或酸的稀溶液中易水解。
℃,沸点为84℃,在水中或酸的稀溶液中易水解。(1)Ge位于ⅣA族,属于
 晶体所属类别是
晶体所属类别是(2)步骤①NaOH溶液碱浸时发生的离子反应方程式为
(3)步骤③沉锗过程中,当温度为90℃,pH为14时,加料量(
 质量比)对沉锗的影响如表所示,选择最佳加料量为
质量比)对沉锗的影响如表所示,选择最佳加料量为| 编号 | 加料量(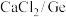 ) ) | 母液体积(mL) | 过滤后滤液含锗(mg/L) | 过滤后滤液pH | 锗沉淀率(%) |
| 1 | 10 | 500 | 76 | 8 | 93.67 |
| 2 | 15 | 500 | 20 | 8 | 98.15 |
| 3 | 20 | 500 | 2 | 11 | 99.78 |
| 4 | 25 | 500 | 1.5 | 12 | 99.85 |
(5)步骤⑥的化学反应方程式为
(6)Ge元素的单质及其化合物都具有独特的优异性能。请回答下列问题:
①量子化学计算显示含锗化合物
 具有良好的光电化学性能。
具有良好的光电化学性能。 是
是 的量子化学计算模型,
的量子化学计算模型, 的晶体结构如图所示,若设定图中体心钙离子的分数坐标为
的晶体结构如图所示,若设定图中体心钙离子的分数坐标为 ,则分数坐标为
,则分数坐标为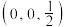 的离子是
的离子是
②晶体Ge是优良的半导体,可作高频率电流的检波和交流电的整流用。如图为Ge单晶的晶胞,设Ge原子半径为r pm,其中晶胞体对角线长度为8r pm,阿伏加德罗常数的值为
 ,则该锗晶体的密度计算式为(不需化简)
,则该锗晶体的密度计算式为(不需化简)
 。(已知相对原子量:Ge 73)
。(已知相对原子量:Ge 73)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】铁、铝是重要的金属材料,铁、铝及其化合物有非常重要的用途。
(1)下列说法正确的是__________________  填序号
填序号 。
。
①配制氯化铁溶液,先将 固体溶于较浓盐酸,再用蒸馏水稀释到所需的浓度
固体溶于较浓盐酸,再用蒸馏水稀释到所需的浓度
② 只能通过置换反应生成,
只能通过置换反应生成, 只能通过化合反应生成
只能通过化合反应生成
③利用氯水和KSCN溶液可以检验 中有无
中有无
④加热蒸干 溶液获得
溶液获得 固体
固体
⑤含a mol 的溶液和含
的溶液和含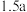 mol NaOH的溶液,无论正滴和反滴,生成
mol NaOH的溶液,无论正滴和反滴,生成 的质量相等
的质量相等
⑥由于金属铝性质稳定,所以Al在空气中能稳定存在
(2)高铁酸钾 是一种高效多功能水处理剂。其作用原理为
是一种高效多功能水处理剂。其作用原理为__________________
(3) 以铝土矿
以铝土矿 主要成分为
主要成分为 和
和 、
、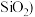 为原料制备铝的一种工艺流程如下:
为原料制备铝的一种工艺流程如下:
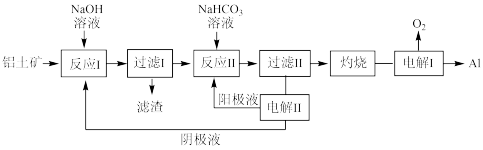
①滤渣主要成分为___________________________
②在实验室灼烧操作应选择的实验仪器为____________________________
③反应II中,加入 一段时间才有沉淀生成,写出加入少量
一段时间才有沉淀生成,写出加入少量 时发生反应的离子方程式
时发生反应的离子方程式____________________________________________
(4)已知 时
时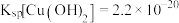
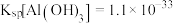 在
在 下,向浓度均为
下,向浓度均为 的
的 和
和 混合溶液中逐滴加入氨水,先生成
混合溶液中逐滴加入氨水,先生成________________ 沉淀 填化学式
填化学式 。
。
(1)下列说法正确的是
 填序号
填序号 。
。①配制氯化铁溶液,先将
 固体溶于较浓盐酸,再用蒸馏水稀释到所需的浓度
固体溶于较浓盐酸,再用蒸馏水稀释到所需的浓度②
 只能通过置换反应生成,
只能通过置换反应生成, 只能通过化合反应生成
只能通过化合反应生成③利用氯水和KSCN溶液可以检验
 中有无
中有无
④加热蒸干
 溶液获得
溶液获得 固体
固体⑤含a mol
 的溶液和含
的溶液和含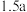 mol NaOH的溶液,无论正滴和反滴,生成
mol NaOH的溶液,无论正滴和反滴,生成 的质量相等
的质量相等⑥由于金属铝性质稳定,所以Al在空气中能稳定存在
(2)高铁酸钾
 是一种高效多功能水处理剂。其作用原理为
是一种高效多功能水处理剂。其作用原理为(3)
 以铝土矿
以铝土矿 主要成分为
主要成分为 和
和 、
、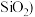 为原料制备铝的一种工艺流程如下:
为原料制备铝的一种工艺流程如下:
①滤渣主要成分为
②在实验室灼烧操作应选择的实验仪器为
③反应II中,加入
 一段时间才有沉淀生成,写出加入少量
一段时间才有沉淀生成,写出加入少量 时发生反应的离子方程式
时发生反应的离子方程式(4)已知
 时
时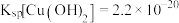
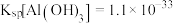 在
在 下,向浓度均为
下,向浓度均为 的
的 和
和 混合溶液中逐滴加入氨水,先生成
混合溶液中逐滴加入氨水,先生成 填化学式
填化学式 。
。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】电子工业中,可用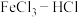 溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
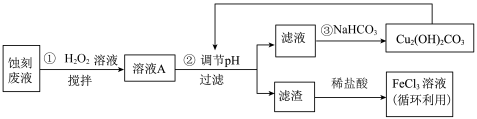
回答下列问题:
(1)把 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是___________ 。(填写化学式)
(2) 蚀刻液中加入盐酸的目的是
蚀刻液中加入盐酸的目的是___________ 。
(3)步骤①中加入 溶液的目的是(用离子方程式表示)
溶液的目的是(用离子方程式表示)___________ 。
(4)已知:生成氢氧化物沉淀的 如下表。
如下表。
根据表中数据推测调节 的范围是
的范围是___________ 。
(5)上述流程路线中,除 溶液外,还可用于循环利用的物质是
溶液外,还可用于循环利用的物质是___________ 。
(6)在 ,向浓度均为
,向浓度均为 的
的 溶液中逐滴加入氨水,若镁离子浓度为
溶液中逐滴加入氨水,若镁离子浓度为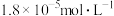 时溶液的
时溶液的 为
为___________ 。(已知 时
时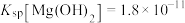 )。
)。
 溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
回答下列问题:
(1)把
 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是(2)
 蚀刻液中加入盐酸的目的是
蚀刻液中加入盐酸的目的是(3)步骤①中加入
 溶液的目的是(用离子方程式表示)
溶液的目的是(用离子方程式表示)(4)已知:生成氢氧化物沉淀的
 如下表。
如下表。| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
 的范围是
的范围是(5)上述流程路线中,除
 溶液外,还可用于循环利用的物质是
溶液外,还可用于循环利用的物质是(6)在
 ,向浓度均为
,向浓度均为 的
的 溶液中逐滴加入氨水,若镁离子浓度为
溶液中逐滴加入氨水,若镁离子浓度为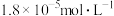 时溶液的
时溶液的 为
为 时
时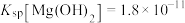 )。
)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】如图是工业制取菱镁矿MgCO3(含杂质Al2O3、FeCO3)制取镁的工艺流程
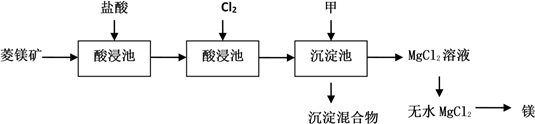
请回答有关问题:
(1)菱镁矿进入酸浸池前需要粉碎,目的是___________ 。
(2)氧化池通入Cl2的目的是氧化___________ (填化学式),工业上不选用硝酸做氧化剂的原因是___________ 和___________ 。
(3)物质甲可以是___________
A、MgO B、Mg(OH)2 C、NaOH溶液 D、稀氨水
(4)由MgCl2溶液制取无水MgCl2的操作方法___________ 。
(5)当Fe3+完全沉淀时,求最小pH___________ 。已知:氢氧化铁ksp=1.0×10-38,离子浓度小于1×10-5 mol/L认为沉淀完全

请回答有关问题:
(1)菱镁矿进入酸浸池前需要粉碎,目的是
(2)氧化池通入Cl2的目的是氧化
(3)物质甲可以是
A、MgO B、Mg(OH)2 C、NaOH溶液 D、稀氨水
(4)由MgCl2溶液制取无水MgCl2的操作方法
(5)当Fe3+完全沉淀时,求最小pH
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·3H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:
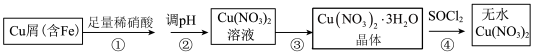
已知:SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。请回答:
(1)写出第②步调 pH适合的一种物质______ (填化学式),调 pH 后需进行的操作是_____ 。
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是将溶液转移至蒸发皿中,缓缓加热至______ 。
(3)第④步中发生反应的化学方程式是______ 。
(4)第④步,某同学设计的实验装置示意图(如图,夹持及控温装置省略)有一处不合理,请提出改进方案并说明理由_______ 。
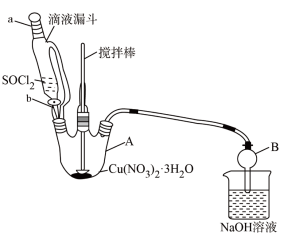
装置改进后,向仪器 A 中缓慢滴加 SOCl2时,需打开活塞_____ (填“a”“b”或“a 和 b”)。
(5)Cu(NO3)2·3H2O在170℃可失去结晶水变成Cu(NO3)2,若加热时间过长,Cu(NO3)2则会分解为一种黑色的固体,一种红棕色气体和另一种单质气体,写出反应的化学方程式:_______ 。
(6)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O+Cu2+=Cu(NH3)42++4H2O;Cu(NH3)42+对特定波长光的吸收程度(用吸光度A表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与 Cu2+标准溶液浓度关系如图所示:
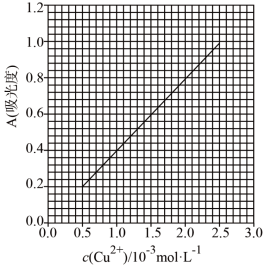
准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_______ (以质量分数表示)。

已知:SOCl2熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。请回答:
(1)写出第②步调 pH适合的一种物质
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是将溶液转移至蒸发皿中,缓缓加热至
(3)第④步中发生反应的化学方程式是
(4)第④步,某同学设计的实验装置示意图(如图,夹持及控温装置省略)有一处不合理,请提出改进方案并说明理由

装置改进后,向仪器 A 中缓慢滴加 SOCl2时,需打开活塞
(5)Cu(NO3)2·3H2O在170℃可失去结晶水变成Cu(NO3)2,若加热时间过长,Cu(NO3)2则会分解为一种黑色的固体,一种红棕色气体和另一种单质气体,写出反应的化学方程式:
(6)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O+Cu2+=Cu(NH3)42++4H2O;Cu(NH3)42+对特定波长光的吸收程度(用吸光度A表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与 Cu2+标准溶液浓度关系如图所示:

准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再进行吸收滴定来测定含量。实验装置如图所示。
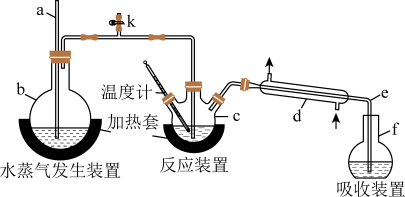
(1)装置c的名称是___________ 。玻璃管a的作用为___________ 。
(2)实验步骤:①连接好实验装置,检查装置气密性;②往c中加入mg氟化稀土样品和 一定体积的高氯酸,f中盛有滴加酚酞的NaOH溶液。加热装置b、c。
①下列物质可代替高氯酸的是___________ 。(填序号)。
A.硫酸B.盐酸C.硝酸D.磷酸
②水蒸气发生装置b的作用是___________ 。
(3)定量测定:将f中得到的馏出液配成100mL溶液,取其中20mL加入V1mL amol·L-1La(NO3)3溶液,得到LaF3沉淀(不考虑其他沉淀的生成),再用cmol·L-1EDTA 标准溶液滴定剩余La3+(La+与 EDTA 按1:1配合),消耗 EDTA 标准溶液 V2mL,则氟化稀土样品中氟的质量分数为___________ 。
(4)问题讨论:
若观察到f中溶液红色褪去,可采用最简单的补救措施是:___________ 。否则会使实验结果偏低。实验中除有HF 气体外,可能还有少量 SiF4(易水解)气体生成。若有SiF4生成,实验结果将_____ 。(填“偏高”“偏低”或“不受影响”)。理由是_____ 。

(1)装置c的名称是
(2)实验步骤:①连接好实验装置,检查装置气密性;②往c中加入mg氟化稀土样品和 一定体积的高氯酸,f中盛有滴加酚酞的NaOH溶液。加热装置b、c。
①下列物质可代替高氯酸的是
A.硫酸B.盐酸C.硝酸D.磷酸
②水蒸气发生装置b的作用是
(3)定量测定:将f中得到的馏出液配成100mL溶液,取其中20mL加入V1mL amol·L-1La(NO3)3溶液,得到LaF3沉淀(不考虑其他沉淀的生成),再用cmol·L-1EDTA 标准溶液滴定剩余La3+(La+与 EDTA 按1:1配合),消耗 EDTA 标准溶液 V2mL,则氟化稀土样品中氟的质量分数为
(4)问题讨论:
若观察到f中溶液红色褪去,可采用最简单的补救措施是:
您最近一年使用:0次



