用水逐步稀释0.1 mol/L的氨水,若温度保持不变,则始终保持增大趋势的是
| A.c(OH-) | B.c(NH4+)/c(NH3·H2O) | C.c(NH3·H2O) | D.c(NH4+) |
10-11高二·内蒙古巴彦淖尔·期中 查看更多[1]
(已下线)2011-2012学年内蒙古巴彦淖尔市中学高二期中考试化学试卷
更新时间:2016-12-09 02:38:54
|
相似题推荐
单选题
|
较易
(0.85)
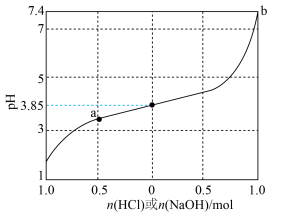
【推荐1】缓冲溶液是指加少量水稀释或外加少量酸、碱,自身pH不发生显著变化的溶液。1L含1mol乳酸(HLac)和1mol乳酸钠(NaLac)的溶液就是一种缓冲溶液,该溶液的pH为3.85。下图是此缓冲溶液的pH随通入HCl(g)或加入NaOH(s)的物质的量变化的示意图(溶液体积保持1L),已知lg3=0.48。下列说法错误的是
A.此缓冲溶液中(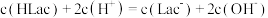 |
| B.通过计算可得出,a点溶液的pH约为3.37 |
| C.根据图像可以判断,b点溶液已失去缓冲能力 |
D.当加入NaOH,且横坐标为0.5时,对应溶液中(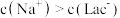 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】浓度均为0.1mol/L的NaOH溶液与氨水相比较,下列结论正确的是( )
| A.中和HCl的物质的量相同 | B.两溶液中所含的OH-数目相同 |
| C.NaOH溶液中c(H+)小 | D.氨水中c(OH-)大 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】室温下,向0.1 mol/L氨水中逐滴加入盐酸,下列描述不正确的是
| A.pH逐渐减小 | B.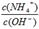 增大 增大 |
| C.水的电离程度会不断增大 | D.Kw不变 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】如图所示,烧杯中的溶液为2 mol·L-1CH3COOH溶液,接通直流电源。分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )


| A.加入固体NaOH | B.加水稀释 | C.加入金属Na | D.通入HCl气体 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】如图所示,烧杯中的溶液为2 mol·L-1CH3COOH溶液,接通直流电源。分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )


| A.加入固体NaOH | B.加水稀释 | C.加入金属Na | D.通入HCl气体 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】用水稀释0.1 mol·L-1氨水时,溶液中随水量的增加而减小的是 ( )。
| A.c(OH-)/c(NH3·H2O) |
| B.c(NH3·H2O)/c(OH-) |
| C.n(OH-)和c(H+) |
| D.c(H+)和c(OH-)的乘积 |
您最近一年使用:0次

 的值减小
的值减小

