ClO2是一种杀菌效率高、二次污染小的水处理剂。实验室可以通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2+K2SO4+2CO2+2H2O,
(1)双线桥表示氧化还原,线桥上标明得失电子、发生的反应。_______
(2)若1mo KClO3参加反应时有_______ mol电子转移。
(3)若生成标准状况下的CO2的体积是44.8L,则参加反应的还原剂的物质的量是多少mol?(要求有规范的过程)_______ 。
(1)双线桥表示氧化还原,线桥上标明得失电子、发生的反应。
(2)若1mo KClO3参加反应时有
(3)若生成标准状况下的CO2的体积是44.8L,则参加反应的还原剂的物质的量是多少mol?(要求有规范的过程)
更新时间:2019-12-04 17:45:15
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】实验室可以用高锰酸钾与浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
请完成下列问题:
(1)在上述方程式中用双线桥法标注电子转移情况____________ 。
(2)浓盐酸在该反应中表现了____________ (选填“氧化性”、“还原性”或“酸性”)。
(3)若15.8g KMnO4与足量的浓盐酸充分反应,则有______ mol HCl被氧化,产生的Cl2在标准状况下的体积为__________ L。
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
请完成下列问题:
(1)在上述方程式中用双线桥法标注电子转移情况
(2)浓盐酸在该反应中表现了
(3)若15.8g KMnO4与足量的浓盐酸充分反应,则有
您最近一年使用:0次
【推荐2】饮用水中的NO 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO 的浓度,可以在碱性条件下用铝粉将NO
的浓度,可以在碱性条件下用铝粉将NO 还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素__ ,还原产物是__ 。
(2)用“双线桥法”表示反应中电子转移的方向和数目:__ 。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4LN2,转移_ mol电子。
(4)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中HCl表现出的性质是__ 。
(5)取300mL0.2mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量是__ mol。
 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO 的浓度,可以在碱性条件下用铝粉将NO
的浓度,可以在碱性条件下用铝粉将NO 还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:(1)上述反应中,被氧化的元素
(2)用“双线桥法”表示反应中电子转移的方向和数目:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4LN2,转移
(4)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中HCl表现出的性质是
(5)取300mL0.2mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量是
您最近一年使用:0次
【推荐3】I.有200 mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol·L-1,c(Cl-)为1.3mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol·L-1NaOH溶液的体积为___________________ mL
II.焊接铜件时常用的焊药为氯化铵,其作用是消除焊接处的氧化铜。其反应式为 NH4C1+ CuO→Cu+CuCl2+ N2↑+ H2O
(1)配平,并用双线桥法标出电子转移情况。:____________
(2)该反应中,氧化剂和还原剂的物质的量之比为:___________ 。
(3)若反应中电子转移了0.3mol,则产生的气体在标准状况下的体积为_______ L。
II.焊接铜件时常用的焊药为氯化铵,其作用是消除焊接处的氧化铜。其反应式为 NH4C1+ CuO→Cu+CuCl2+ N2↑+ H2O
(1)配平,并用双线桥法标出电子转移情况。:
(2)该反应中,氧化剂和还原剂的物质的量之比为:
(3)若反应中电子转移了0.3mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】实验室里用二氧化锰与浓盐酸反应来制取适量的氯气。现用100mL的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6升,计算:
(1)理论上需要参加反应的二氧化锰_______ 克?
(2)浓盐酸的物质的量浓度为_____________ ?
(3)被氧化的HCl的质量为______________ 克?
(1)理论上需要参加反应的二氧化锰
(2)浓盐酸的物质的量浓度为
(3)被氧化的HCl的质量为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室中常用下列反应制取氯气:MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2 H2O
MnCl2 + Cl2↑+ 2 H2O
(1)用双线桥或单线桥的方式表示该反应电子转移的方向和数目:________
(2)该反应中还原剂是________ ;
(3)标准状况下,收集到2.24 L Cl2时,被氧化的还原剂的物质的量为_____ mol,转移电子的物质的量为____ mol。
 MnCl2 + Cl2↑+ 2 H2O
MnCl2 + Cl2↑+ 2 H2O(1)用双线桥或单线桥的方式表示该反应电子转移的方向和数目:
(2)该反应中还原剂是
(3)标准状况下,收集到2.24 L Cl2时,被氧化的还原剂的物质的量为
您最近一年使用:0次

 和
和 的混合气体。将混合气体通入装有足量碱石灰的干燥管,剩余气体在标准状况下的体积为26.88L。请回答:
的混合气体。将混合气体通入装有足量碱石灰的干燥管,剩余气体在标准状况下的体积为26.88L。请回答: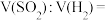
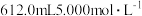 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硫酸溶液的浓度为
全部转化成沉淀,则原硫酸溶液的浓度为 。
。


