某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2.
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2+FeS+H2SO4=MnSO4+Fe2(SO4)3+S+H2O_____
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO2和Zn.
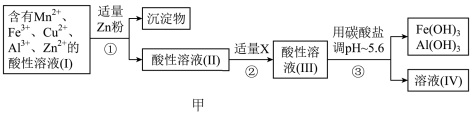
a、操作①中加Zn粉后发生反应的离子方程式为______ .
b、操作②中加入适量X的作用是什么______ ;X的首选物的化学式是: ______ .
c、操作③中所加碳酸盐的化学式是______ .
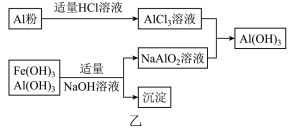
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如图乙的有关流程图.
a、AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为______ .若总共得到nmol Al(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为 ______ 、 ______ .
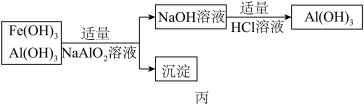
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量?______ .
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2+FeS+H2SO4=MnSO4+Fe2(SO4)3+S+H2O
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO2和Zn.



a、操作①中加Zn粉后发生反应的离子方程式为
b、操作②中加入适量X的作用是什么
c、操作③中所加碳酸盐的化学式是
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如图乙的有关流程图.
a、AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量?
更新时间:2019-12-08 15:04:41
|
相似题推荐
解答题-工业流程题
|
较易
(0.85)
名校
【推荐1】镍电池的电极活性材料为多组分合金(主要成分为镍、钴,还含有铝、铁等),可重新回收利用。利用废镍电池资源化生产醋酸钴晶体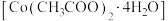 的工艺流程如下。
的工艺流程如下。
②部分金属阳离子沉淀的pH如下表。
请回答下列问题:
(1)“浸取”时可以提高浸取率的操作有___________ (任写1条)。
(2)“调pH”时溶液的pH范围是___________ ,所得滤渣1的主要成分为___________ (填化学式)。
(3)“氧化分离”操作控制溶液pH=2,加入NaClO发生反应的离子方程式为___________ 。
(4)“溶解1”操作中加入H2O2的作用为___________ ,“沉钴”操作过程中发生反应的离子方程式为___________ 。
(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为___________ 。
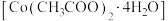 的工艺流程如下。
的工艺流程如下。
②部分金属阳离子沉淀的pH如下表。
| 沉淀物 |  |  | 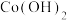 | Co(OH)3 |  |  |
| 开始沉淀pH | 2.2 | 7.4 | 7.6 | 0.1 | 4.0 | 7.6 |
| 完全沉淀pH | 3.2 | 8.9 | 9.2 | 1.1 | 5.2 | 9.2 |
(1)“浸取”时可以提高浸取率的操作有
(2)“调pH”时溶液的pH范围是
(3)“氧化分离”操作控制溶液pH=2,加入NaClO发生反应的离子方程式为
(4)“溶解1”操作中加入H2O2的作用为
(5)“溶解2”操作后得到醋酸钴晶体,要使该醋酸钴晶体的纯度更高,所采取的实验操作名称应为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
【推荐2】碲(Te)为第ⅥA元素,其单质凭借优良的性能成为制作合金添加剂、半导体、光电元件的主体材料,并被广泛应用于冶金、航空航天、电子等领域。可从精炼铜的阳极泥(主要成分为 )中回收碲。工艺流程图如下:
)中回收碲。工艺流程图如下:
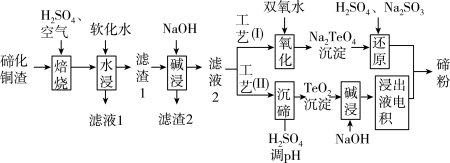
(1)“焙烧”后,碲主要以 形式存在,写出相应反应的化学方程式:
形式存在,写出相应反应的化学方程式:___________ 。
(2)为了选择最佳的焙烧工艺,进行了温度和硫酸加入量的条件试验,结果如下表所示:
则焙烧工艺中应选择的适宜条件为___________ 。
(3)滤渣1在碱浸时发生的化学方程式为___________ 。
(4)工艺(Ⅰ)中,“还原”时发生的总的离子方程式为___________ 。
(5)由于工艺(Ⅰ)中“氧化”对溶液和物料条件要求高,有研究者采用工艺(Ⅱ)获得碲,则“电积”过程中,阴极的电极反应式为___________ 。
(6)工业生产中,滤渣2经硫酸酸浸后得滤液3和滤渣3。
①滤液3与滤液1合并。进入铜电积系统。该处理措施的优点为___________ 。
②滤渣3中若含Au和Ag,可用___________ 将二者分离。(填字母)
A.王水 B.浓氢氧化钠溶液 C.稀硝酸 D.浓盐酸
 )中回收碲。工艺流程图如下:
)中回收碲。工艺流程图如下:
(1)“焙烧”后,碲主要以
 形式存在,写出相应反应的化学方程式:
形式存在,写出相应反应的化学方程式:(2)为了选择最佳的焙烧工艺,进行了温度和硫酸加入量的条件试验,结果如下表所示:
| 温度/℃ | 硫酸加入量(理论量倍数) | 浸出率/% | |
| Cu | Te | ||
| 450 | 1.25 | 77.3 | 2.63 |
| 460 | 1.00 | 80.29 | 2.81 |
| 1.25 | 89.86 | 2.87 | |
| 1.50 | 92.31 | 7.70 | |
| 500 | 1.25 | 59.83 | 5.48 |
| 550 | 1.25 | 11.65 | 10.63 |
(3)滤渣1在碱浸时发生的化学方程式为
(4)工艺(Ⅰ)中,“还原”时发生的总的离子方程式为
(5)由于工艺(Ⅰ)中“氧化”对溶液和物料条件要求高,有研究者采用工艺(Ⅱ)获得碲,则“电积”过程中,阴极的电极反应式为
(6)工业生产中,滤渣2经硫酸酸浸后得滤液3和滤渣3。
①滤液3与滤液1合并。进入铜电积系统。该处理措施的优点为
②滤渣3中若含Au和Ag,可用
A.王水 B.浓氢氧化钠溶液 C.稀硝酸 D.浓盐酸
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
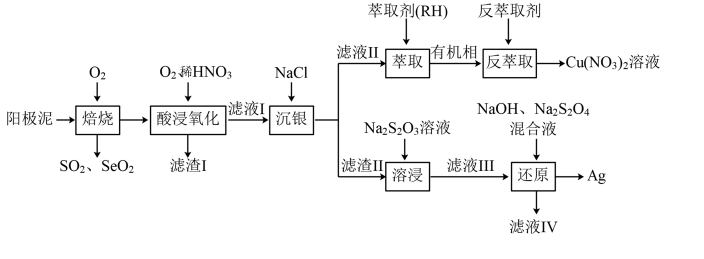
【推荐3】从一种阳极泥(主要成分为Cu、Ag、Pt、Au、Ag2Se、Cu2S)中回收重金属的工艺流程如图所示:
已知: 在碱性条件下很稳定。回答下列问题:
在碱性条件下很稳定。回答下列问题:
(1)Cu2S焙烧为CuO,该过程中还原剂与氧化剂的物质的量之比为_______ 。
(2)“滤渣I”的主要成分是_______ (填化学式);加快“酸浸氧化”速率的措施有_______ (填写一条即可)。
(3)萃取与反萃取的原理为:2RH+Cu2+ R2Cu+2H+。实验室进行萃取操作的专用玻璃仪器是
R2Cu+2H+。实验室进行萃取操作的专用玻璃仪器是_______ (填名称);该流程中的“反萃取剂”最好选用_______ (填标号)。
A.乙醇 B.HNO3溶液 C.盐酸 D.NaOH 溶液
(4)已知:Ag++2
 [Ag(S2O3)2]3− K=2.80×1013
[Ag(S2O3)2]3− K=2.80×1013
AgCl(s) Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10
Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10
①“溶浸”过程中,滤渣II被Na2S2O3溶液溶解的反应为:AgCl+2
 [Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为
[Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为_______ ;
②“滤液IV”可返回溶浸工序循环使用,循环多次后,即使调控Na2S2O3溶液浓度,银的浸出率仍会降低。试从化学平衡的角度解释可能的原因:_______ 。
(5)请从环保角度对该工艺流程提出合理的优化建议:_______ (写出一条即可)。

已知:
 在碱性条件下很稳定。回答下列问题:
在碱性条件下很稳定。回答下列问题:(1)Cu2S焙烧为CuO,该过程中还原剂与氧化剂的物质的量之比为
(2)“滤渣I”的主要成分是
(3)萃取与反萃取的原理为:2RH+Cu2+
 R2Cu+2H+。实验室进行萃取操作的专用玻璃仪器是
R2Cu+2H+。实验室进行萃取操作的专用玻璃仪器是A.乙醇 B.HNO3溶液 C.盐酸 D.NaOH 溶液
(4)已知:Ag++2

 [Ag(S2O3)2]3− K=2.80×1013
[Ag(S2O3)2]3− K=2.80×1013AgCl(s)
 Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10
Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10①“溶浸”过程中,滤渣II被Na2S2O3溶液溶解的反应为:AgCl+2

 [Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为
[Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为②“滤液IV”可返回溶浸工序循环使用,循环多次后,即使调控Na2S2O3溶液浓度,银的浸出率仍会降低。试从化学平衡的角度解释可能的原因:
(5)请从环保角度对该工艺流程提出合理的优化建议:
您最近一年使用:0次
【推荐1】为了除去粗盐中的Ca2+、Mg2+、SO 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是_____________
(1)过滤;(2)加过量的NaOH溶液;(3)加适量HCl;(4)加过量的Na2CO3溶液;(5)加过量的BaCl2溶液
 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是(1)过滤;(2)加过量的NaOH溶液;(3)加适量HCl;(4)加过量的Na2CO3溶液;(5)加过量的BaCl2溶液
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】氯化钠既是我们日常生活中不可缺少的调味品,也是一种重要的化工原料。某化学兴趣小组进行粗盐(主要含有泥沙、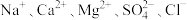 )提纯实验。
)提纯实验。
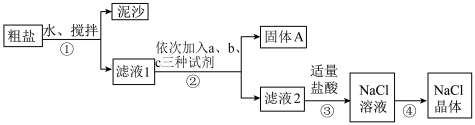
Ⅰ.甲同学的操作步骤如图所示:
已知: 不溶于稀盐酸和稀硝酸。
不溶于稀盐酸和稀硝酸。
依据所学知识回答下列问题:
(1)操作①所用的玻璃仪器包括烧杯、___________ ;操作(4)的名称是___________ 。
(2)从产品纯度考虑,试剂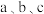 可以分别为
可以分别为___________ (填标号);加入盐酸时发生反应生成 的离子方程式为
的离子方程式为___________ 。
A. 溶液、
溶液、 溶液、
溶液、 溶液
溶液
B. 溶液、
溶液、 溶液、
溶液、 溶液
溶液
C. 溶液、
溶液、 溶液、
溶液、 溶液
溶液
Ⅱ.乙同学对甲同学的实验进行评价,提出了一些猜想,并设计实验进行验证:
供选择的试剂:稀盐酸、 溶液、
溶液、 溶液。
溶液。
(3)完成上述表格中:①_______ ;②_______ ;③_______ ;④________ 。
(4)根据乙同学的实验,请对甲同学的实验设计进行评价:___________ 。
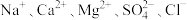 )提纯实验。
)提纯实验。Ⅰ.甲同学的操作步骤如图所示:

已知:
 不溶于稀盐酸和稀硝酸。
不溶于稀盐酸和稀硝酸。依据所学知识回答下列问题:
(1)操作①所用的玻璃仪器包括烧杯、
(2)从产品纯度考虑,试剂
 可以分别为
可以分别为 的离子方程式为
的离子方程式为A.
 溶液、
溶液、 溶液、
溶液、 溶液
溶液B.
 溶液、
溶液、 溶液、
溶液、 溶液
溶液C.
 溶液、
溶液、 溶液、
溶液、 溶液
溶液Ⅱ.乙同学对甲同学的实验进行评价,提出了一些猜想,并设计实验进行验证:
| 猜想 | 验证的方法 | 现象 | 结论 |
猜想1:固体A中含 | 取少量固体A于试管中,先加入足量①______,再加入②________ | 有气泡产生,无白色沉淀 | ③_____ |
猜想2:最后制得的 晶体中还含有 晶体中还含有 | 取少量提纯后的 晶体于试管中,加入适量的蒸馏水溶解,滴入稀 晶体于试管中,加入适量的蒸馏水溶解,滴入稀 和 和 溶液 溶液 | ④______ | 猜想2成立 |
 溶液、
溶液、 溶液。
溶液。(3)完成上述表格中:①
(4)根据乙同学的实验,请对甲同学的实验设计进行评价:
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】海水中富含大量的氯化钠,将海水蒸发可得粗盐,精制后得到精制食盐,不仅可食用,还可用作工业生产的原料。
Ⅰ.粗盐中除了含有泥沙之外,还含有少量Ca2+、Mg2+、SO 等杂质离子,某同学设计如图实验方案提纯粗盐,请根据下图回答下列问题。
等杂质离子,某同学设计如图实验方案提纯粗盐,请根据下图回答下列问题。
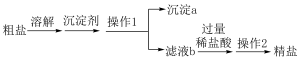
(1)粗盐溶解后加入沉淀剂:①过量的Na2CO3溶液 ②过量的BaCl2溶液 ③过量的NaOH溶液,加入沉淀剂的顺序正确的是___________ (填序号)。
a.①②③ b.②①③ c.③①②
(2)操作1中用到的玻璃仪器有玻璃棒、烧杯、___________ (填仪器名称);玻璃棒作用是___________ 。沉淀a的主要成分是碳酸钙、碳酸钡、___________ (填化学式)。
(3)操作2后可得到精盐,操作名称是___________ 。
(4)检验滤液b中是否含有SO 的实验操作:
的实验操作:___________ 。
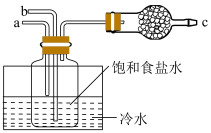
Ⅱ. 我国近代化学工业的奠基人侯德榜先生,设计出“侯氏制碱法”,提高了食盐的转化率,缩短了生产流程,减少了对环境的污染。工艺流程如图所示:

(5)氨化和碳酸化过程在如图所示装置中进行,对应的总化学方程式为___________ ,a导管应通入的气体是___________ (填化学式),仪器c中盛放的药品___________ 。
Ⅰ.粗盐中除了含有泥沙之外,还含有少量Ca2+、Mg2+、SO
 等杂质离子,某同学设计如图实验方案提纯粗盐,请根据下图回答下列问题。
等杂质离子,某同学设计如图实验方案提纯粗盐,请根据下图回答下列问题。
(1)粗盐溶解后加入沉淀剂:①过量的Na2CO3溶液 ②过量的BaCl2溶液 ③过量的NaOH溶液,加入沉淀剂的顺序正确的是
a.①②③ b.②①③ c.③①②
(2)操作1中用到的玻璃仪器有玻璃棒、烧杯、
(3)操作2后可得到精盐,操作名称是
(4)检验滤液b中是否含有SO
 的实验操作:
的实验操作:Ⅱ. 我国近代化学工业的奠基人侯德榜先生,设计出“侯氏制碱法”,提高了食盐的转化率,缩短了生产流程,减少了对环境的污染。工艺流程如图所示:

(5)氨化和碳酸化过程在如图所示装置中进行,对应的总化学方程式为

您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X_______
(2)上述实验流程中①②③步均要进行的实验操作是_______ (填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液后发生反应的离子方程式:_______ 、_______ 。
(4)(本小题两空均填化学式)按此实验方案得到的溶液3中肯定含有_______ 杂质。为了解决这个问题,可以向溶液3中加入适量的_______ 。
(5)在①步操作中如何证明加的BaCl2溶液已过量?_______ 。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X
(2)上述实验流程中①②③步均要进行的实验操作是
(3)上述实验流程中加入过量Na2CO3溶液后发生反应的离子方程式:
(4)(本小题两空均填化学式)按此实验方案得到的溶液3中肯定含有
(5)在①步操作中如何证明加的BaCl2溶液已过量?
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
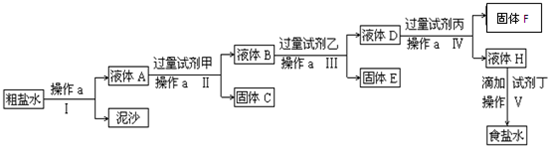
【推荐3】电解法制烧碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下:
请回答以下问题:
(1)操作a的名称是____________ 。
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的沉淀,则试剂甲为________ 溶液。试剂乙为_________ ,固体F为_______________________ 。
(3)在第Ⅴ步中,加入试剂丁直到溶液无明显变化时,写出此过程的化学方程式_____________________________________ 、____________________________________ 。

请回答以下问题:
(1)操作a的名称是
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的沉淀,则试剂甲为
(3)在第Ⅴ步中,加入试剂丁直到溶液无明显变化时,写出此过程的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】三氯化硼 是一种重要的化工原料。实验室制备
是一种重要的化工原料。实验室制备 的原理为
的原理为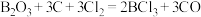 ,某实验小组利用干燥的氯气和下列装置(装置可重复使用,略去夹持装置)制备
,某实验小组利用干燥的氯气和下列装置(装置可重复使用,略去夹持装置)制备 并验证反应中有
并验证反应中有 生成。已知:
生成。已知: 的熔点为
的熔点为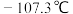 ,沸点为
,沸点为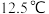 ,遇水水解生成
,遇水水解生成 和
和 ,请回答下列问题:
,请回答下列问题:
实验:制备 并验证产物
并验证产物
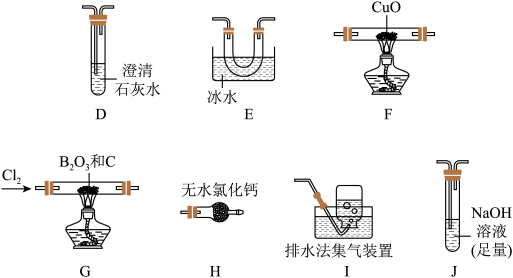
(1)该实验装置中合理的连接顺序为G→_______ →F→D→I。其中装置E的作用是_______ 。
(2)装置J中发生反应的化学方程式为_______ 。
 是一种重要的化工原料。实验室制备
是一种重要的化工原料。实验室制备 的原理为
的原理为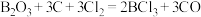 ,某实验小组利用干燥的氯气和下列装置(装置可重复使用,略去夹持装置)制备
,某实验小组利用干燥的氯气和下列装置(装置可重复使用,略去夹持装置)制备 并验证反应中有
并验证反应中有 生成。已知:
生成。已知: 的熔点为
的熔点为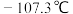 ,沸点为
,沸点为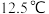 ,遇水水解生成
,遇水水解生成 和
和 ,请回答下列问题:
,请回答下列问题:实验:制备
 并验证产物
并验证产物

(1)该实验装置中合理的连接顺序为G→
(2)装置J中发生反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
【推荐2】以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
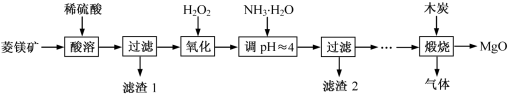
(1)MgCO3与稀硫酸反应的离子方程式为_______ 。
(2)加入H2O2氧化时,发生反应的化学方程式为_______ 。
(3)滤渣2 的成分是_______ (填化学式)。

(1)MgCO3与稀硫酸反应的离子方程式为
(2)加入H2O2氧化时,发生反应的化学方程式为
(3)滤渣2 的成分是
您最近一年使用:0次
【推荐3】知识的梳理和感悟是有效学习的方法之一。山大附中高二化学兴趣小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(所有电极均为石墨)。电解所用的氯化钠溶液需精制,除去有影响的Ca2+、Mg2+、NH4+、SO42﹣及泥沙,其精制流程如下:
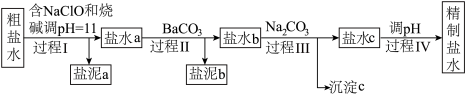
已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如表。
②Ksp(BaSO4)=1.1×10﹣10,Ksp(BaCO3)=2.6×10﹣9,Ksp(CaCO3)=5.0×10﹣9
(1)盐泥a除泥沙外,还含有___________ (填化学式)。
(2)过程I中,NaClO的作用是将NH4+转化为N2,反应的离子方程式为________________ 。
(3)过程Ⅲ中,沉淀c主要成分的化学式为_____ 。
(4)过程Ⅳ调pH目的是除去___________ (填离子符号)
(5)利用图1装置电解精制氯化钠一段时间后,气球b中的气体是_____ (填化学式)

(6)利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分NaClO,则c为电源的_____ 极;该发生器中反应的总离子方程式为_______________ 。
(7)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图是目前已开发出用电解法制取ClO2的新工艺。
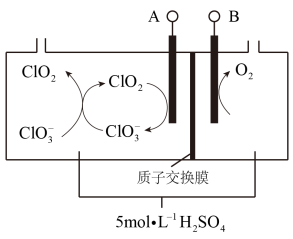
①阴极发生的反应有:_______________ 、__________________________ 。
②当阳极产生标准状况下112 mL气体时,通过阳离子交换膜离子的物质的量为_____ 。

已知:①Ca2+、Mg2+开始形成相应氢氧化物沉淀的pH如表。
| Ca(OH)2 | Mg(OH)2 | |
| pH | ≥11.5 | ≥9.2 |
②Ksp(BaSO4)=1.1×10﹣10,Ksp(BaCO3)=2.6×10﹣9,Ksp(CaCO3)=5.0×10﹣9
(1)盐泥a除泥沙外,还含有
(2)过程I中,NaClO的作用是将NH4+转化为N2,反应的离子方程式为
(3)过程Ⅲ中,沉淀c主要成分的化学式为
(4)过程Ⅳ调pH目的是除去
(5)利用图1装置电解精制氯化钠一段时间后,气球b中的气体是

(6)利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分NaClO,则c为电源的
(7)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图是目前已开发出用电解法制取ClO2的新工艺。

①阴极发生的反应有:
②当阳极产生标准状况下112 mL气体时,通过阳离子交换膜离子的物质的量为
您最近一年使用:0次



