短周期元素X、Y、Z、W在周期表中的位置关系如图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
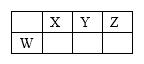
(1)X元素在元素周期表中的位置________ 。
(2)X、Y、Z元素的简单气态氢化物中,稳定性最差的是________ (用分子式表示)。
(3)Y、Z、W三种元素对应的离子中,半径由大到小的顺序____________ (用离子符号表示)。
(4)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式_______________ 。关于该电池的下列说法,正确的是_________ 。

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(5)X2Z42-能被酸性KMnO4氧化,请填写相应的离子,并给予配平:
_____ ______ +______ MnO4- + ________ H+ = ______ CO2 + _______ Mn2++______ H2O

(1)X元素在元素周期表中的位置
(2)X、Y、Z元素的简单气态氢化物中,稳定性最差的是
(3)Y、Z、W三种元素对应的离子中,半径由大到小的顺序
(4)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(5)X2Z42-能被酸性KMnO4氧化,请填写相应的离子,并给予配平:
更新时间:2019-12-09 15:57:41
|
相似题推荐
【推荐1】(一)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:

(1)第一步反应是_________ (填“放热”或“吸热”)反应。
(2)1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是___________ 。
(二)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质化学式为___________ 。
②正极的电极反应式是_______________ 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
pH=4.5时,NO3-的去除率低。其原因是_______________ 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_________ 。
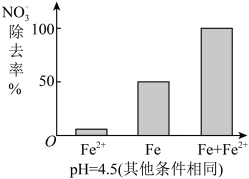
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________ 解释加入Fe2+提高NO3-去除率的原因:________ 。

(1)第一步反应是
(2)1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是
(二)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质化学式为
②正极的电极反应式是
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是

②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:
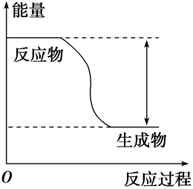
(1)该反应为____ 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是____ (填字母)。
A.改铁片为铁粉 B.滴加少量CuSO4溶液
C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_______ 极(填“正”或“负”)。铜片上产生的现象为________ ,该极上发生的电极反应为_______ 。2min后铁片的质量减少1.4 g,则导线中流过的电子为____ mol。

(1)该反应为
(2)若要使该反应的反应速率加快,下列措施可行的是
A.改铁片为铁粉 B.滴加少量CuSO4溶液
C.升高温度 D.将稀硫酸改为98%的浓硫酸
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
您最近一年使用:0次
【推荐3】I.化学电源在生产生活中有着广泛的应用,请回答下列问题。
(1)根据构成原电池的本质判断,下列化学反应方程式正确且能够设计原电池的是_______
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关实验现象,下列说法正确的是:_______

II.以氨气替代氢气研发氨燃料电池是当前科研的一个热点。
(3)氨燃料电池使用的电解质溶液是2mol/L的KOH溶液,电池反应为:4NH3 + 3O2 = 2N2 + 6H2O,该电池负极的电极反应为:_______
(4)以上述氨燃料电池接下图A.B两极(C、D、E、F都是惰性电极)。电源接通后,F极附近溶液呈红色,请回答:甲池中电极C名称为:_______ ,乙池中发生的离子反应方程式为:_______ ,丙装置是验证外加电流法对钢铁设备的保护(电解液为盐酸酸化的氯化钠溶液),钢铁应该接在_______ 处(填G或H)。为证明铁被保护,可先取少量的电解后的溶液于试管中,向溶液中加入_______ 溶液观察颜色变化。

(1)根据构成原电池的本质判断,下列化学反应方程式正确且能够设计原电池的是_______
| A.KOH + HCl =KCl + H2O | B.Cu + FeCl3 = FeCl2 + CuCl2 |
| C.Na2O + H2O = 2NaOH | D.Fe+ H2SO4=FeSO4 +H2↑ |

| A.图I中温度计的示数高于图II的示数 |
| B.图I和图II中温度计的示数相等,且均高于室温 |
| C.图I和图II中的气泡均产生于锌棒表面 |
| D.图II中产生气体的速率比I慢 |
II.以氨气替代氢气研发氨燃料电池是当前科研的一个热点。
(3)氨燃料电池使用的电解质溶液是2mol/L的KOH溶液,电池反应为:4NH3 + 3O2 = 2N2 + 6H2O,该电池负极的电极反应为:
(4)以上述氨燃料电池接下图A.B两极(C、D、E、F都是惰性电极)。电源接通后,F极附近溶液呈红色,请回答:甲池中电极C名称为:

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】T、U、V、W、X、Y、Z是元素周期表中前四周期元素,它们在元素周期表中的位置关系如图所示。请回答:

(1)地壳中含量最四的元素在元素周期表中的位置为___________ 。
(2) 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(3)位于Y下一周期的同主族元素的原子序数为___________ 。
(4)单质密度:W___________ (填“>”“<”或“=”,下同)Z;原子半径:X___________ Y;最简单氢化物的稳定性:U___________ V。
(5)常温下X的单质能溶于氢氧化钠溶液,写出反应的化学方程式:___________ 。

(1)地壳中含量最四的元素在元素周期表中的位置为
(2)
 与
与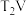 反应的化学方程式为
反应的化学方程式为(3)位于Y下一周期的同主族元素的原子序数为
(4)单质密度:W
(5)常温下X的单质能溶于氢氧化钠溶液,写出反应的化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20。其中只有X、Z是金属元素;V和Z元素原子的最外层都只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子的L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。
回答下列问题:
(1)V的一种核素中质子数为中子数的 ,则该核素的名称为
,则该核素的名称为________ ,常用于制造________ 。
(2)W元素在周期表中的位置为_______________________________ 。
(3)X元素的离子结构示意图为________ 。
(4)Z的最高价氧化物对应水化物的化学式为:_________________________ 。
回答下列问题:
(1)V的一种核素中质子数为中子数的
 ,则该核素的名称为
,则该核素的名称为(2)W元素在周期表中的位置为
(3)X元素的离子结构示意图为
(4)Z的最高价氧化物对应水化物的化学式为:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质既可以与盐酸反应,又可以与NaOH溶液反应放出H2,且E的阳离子与A的阴离子核外电子层结构完全相同。
回答下列问题:
(1)A与E形成的化合物的化学式是__________________ 。
(2)B的最高价氧化物化学式为_____________ ,C的元素名称为 __________ ,D的单质与水反应的方程式为___________________ 。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是________________________ ,有关反应的离子方程式 为____________ ____________ 。

回答下列问题:
(1)A与E形成的化合物的化学式是
(2)B的最高价氧化物化学式为
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】下表是元素周期表的一部分,针对①~⑩元素在表中的位置,回答下列问题:
(1)⑨元素在元素周期表中的位置为_______ 。
(2)在①、②、③、④四种元素中,其离子半径按由大到小的顺序排列为_______ (用离子符号表示)。
(3)②、⑥、⑦元素所形成气态氢化物的稳定性由强到弱的顺序是_______ (用化学式表示)。
(4)⑤的最高价氧化物与⑧的最高价氧化物对应的水化物反应的离子方程式_______ 。
(5)元素⑦与⑩相比,非金属性较强的是_______ (用元素符号表示),请从原子结构的角度作出解释:_______ ;用一个化学方程式证明你的观点:_______ 。
(6)下列有关元素周期表的叙述中,错误的是_______。
| ① | ② | ||||||||||||||||
| ③ | ④ | ⑤ | ⑥ | ⑦ | |||||||||||||
| ⑧ | ⑨ | ⑩ | |||||||||||||||
(2)在①、②、③、④四种元素中,其离子半径按由大到小的顺序排列为
(3)②、⑥、⑦元素所形成气态氢化物的稳定性由强到弱的顺序是
(4)⑤的最高价氧化物与⑧的最高价氧化物对应的水化物反应的离子方程式
(5)元素⑦与⑩相比,非金属性较强的是
(6)下列有关元素周期表的叙述中,错误的是_______。
| A.在金属与非金属分界线附近寻找半导体材料 |
| B.人们在过渡元素中寻找催化剂 |
| C.元素②的最高价氧化物对应的水化物的酸性是最强的 |
| D.以上十种元素中,元素⑧的金属性最强 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】国家卫生健康委员会发布公告称,富硒酵母、二氧化硅、硫黄等6种食品添加剂新品种安全性已通过审查,这些食品添加剂包括食品营养强化剂、风味改良剂、结构改善剂、防腐剂,用于食品生产中,丰富舌尖上的营养和美味。氧、硫、硒为同主族元素,请回答下列问题:
(1)富硒酵母是一种新型添加剂,其中硒元素在周期表中的位置为__________________ 。
(2)下列说法正确的是______。
(3)短周期元素d、e、f、g、h、x都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示:
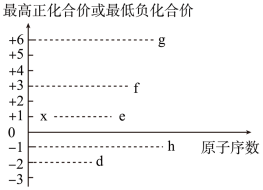
①由x、h、d三种元素组成的化合物的电子式为__________ 。
②d、e、f、g、h元素形成的简单离子中半径最大的是_____ (用化学式表示),其结构示意图为______ 。
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是__________ (填化学式),此化合物可将碱性工业废水中的 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为____________________________ 。
(1)富硒酵母是一种新型添加剂,其中硒元素在周期表中的位置为
(2)下列说法正确的是______。
A.热稳定性: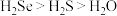 | B.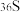 与 与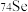 的中子数之和为60 的中子数之和为60 |
C.酸性: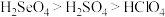 | D.还原性: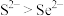 |

①由x、h、d三种元素组成的化合物的电子式为
②d、e、f、g、h元素形成的简单离子中半径最大的是
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是
 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、C、D、E为原子序数依次增大的5种短周期主族元素,其中仅含有一种金属元素,A单质是自然界中密度最小的气体,A和D最外层电子数相同;B元素原子结构示意图为 ;C和E在周期表中相邻,且E的质子数是C的2倍。请回答下列问题:
;C和E在周期表中相邻,且E的质子数是C的2倍。请回答下列问题:
(1)B位于第____________ 周期_____________ 族;
(2)E的离子结构示意图是_________________ ;DA中含有______________ 。(填化学键类型)
(3)用电子式表示BC2的形成过程________________________________________ ;(用具体元素表示)
(4)C、D、E三种元素简单离子的离子半径由大到小的顺序是______________________ 。(用具体离子符号表示)
 ;C和E在周期表中相邻,且E的质子数是C的2倍。请回答下列问题:
;C和E在周期表中相邻,且E的质子数是C的2倍。请回答下列问题: (1)B位于第
(2)E的离子结构示意图是
(3)用电子式表示BC2的形成过程
(4)C、D、E三种元素简单离子的离子半径由大到小的顺序是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】联合国大会将2019年定为“化学元素周期表国际年”,高度体现了元素周期表的重要性。部分元素在周期表中的位置如下:
(1)2021年2月22日,嫦娥五号采样返回器带回的月壤公开亮相,对月壤中化学元素的分析有助于认识月球表面环境。
①月壤中含有较丰富的质量数为3的a,它可以作为未来核聚变的重要原料之一,a的这种核素表示为_______ 。
②经分析,月壤中含有大量的元素d和h,原子半径d_______ h,元素h在周期表中的位置为_______ 。
(2)e和f的单质都是化学家戴维通过电解的方法首次制得。e的单质与水反应的化学方程式为_______ ,f与i形成离子键的过程为_______ 。
(3)d和i两种元素的简单氢化物中,熔沸点较高的氢化物的电子式为_______ ,导致该氢化物熔沸点偏高的原因是_______ 。
(4)《天工开物》记载,“凡火药,以硝石、硫磺为主,草木灰为辅”,由c、d、j三种元素组成的化合物是硝石的主要成分,化学式为_______ 。实验室按照下图操作配制该溶液,所得溶液浓度_______ (填“偏大”或“偏小”)。

(5)元素b与g的性质相似,可以预测b与g的单质或化合物也可能具有相似的性质。请用化学方程式表示你的预测_______ 。(任写一条)
| a | |||||||||||||||||
| b | c | d | |||||||||||||||
| e | f | g | h | i | |||||||||||||
| j |
①月壤中含有较丰富的质量数为3的a,它可以作为未来核聚变的重要原料之一,a的这种核素表示为
②经分析,月壤中含有大量的元素d和h,原子半径d
(2)e和f的单质都是化学家戴维通过电解的方法首次制得。e的单质与水反应的化学方程式为
(3)d和i两种元素的简单氢化物中,熔沸点较高的氢化物的电子式为
(4)《天工开物》记载,“凡火药,以硝石、硫磺为主,草木灰为辅”,由c、d、j三种元素组成的化合物是硝石的主要成分,化学式为

(5)元素b与g的性质相似,可以预测b与g的单质或化合物也可能具有相似的性质。请用化学方程式表示你的预测
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语 回答下列问题:
(1)原子半径最小的元素是___ (填元素名称),写出⑥的离子结构示意图___ 。
(2)③的单质的电子式为__ 。
(3)以上9种元素中最高价氧化物对应水化物酸性最强的是___ (填化学式)。
(4)⑤与⑦形成的化合物中,化学键类型为___ 。
(5)②与④形成的原子个数比为1:2的化合物的结构式为____ 。
(6)③、④、⑥的原子半径由大到小的顺序为___ (用元素符号回答)。
(7)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:

a.溶液B的作用是___ 。
b.上述实验中,能说明②和⑧非金属性强弱的化学方程式是___ 。
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(2)③的单质的电子式为
(3)以上9种元素中最高价氧化物对应水化物酸性最强的是
(4)⑤与⑦形成的化合物中,化学键类型为
(5)②与④形成的原子个数比为1:2的化合物的结构式为
(6)③、④、⑥的原子半径由大到小的顺序为
(7)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:

a.溶液B的作用是
b.上述实验中,能说明②和⑧非金属性强弱的化学方程式是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】现有 、
、 、
、 、
、 、
、 、
、 、
、 七种短周期元素,原子序数依次增大。已知
七种短周期元素,原子序数依次增大。已知 与
与 、
、 与
与 分别同主族,
分别同主族, 、
、 、
、 同周期;
同周期; 、
、 的最外层电子数之和与
的最外层电子数之和与 的最外层电子数相等,
的最外层电子数相等, 与
与 形成的化合物常温下为液态,
形成的化合物常温下为液态, 分别与
分别与 、
、 形成的气体分子电子总数相等,
形成的气体分子电子总数相等, 有多种同素异形体,其中一种是目前已知自然界中最硬的物质,可做首饰品或做切削工具。请回答下列问题:
有多种同素异形体,其中一种是目前已知自然界中最硬的物质,可做首饰品或做切削工具。请回答下列问题:
(1) 在周期表中的位置是
在周期表中的位置是_______ 。
(2)灼烧 的化合物,焰色为
的化合物,焰色为_______ 色, 和
和 形成的一种化合物与
形成的一种化合物与 发生氧化还原反应,该反应的离子方程式为
发生氧化还原反应,该反应的离子方程式为_______ 。
(3) 和
和 的简单气态氢化物中稳定性较强的是
的简单气态氢化物中稳定性较强的是_______ (填化学式), 、
、 、
、 的简单离子半径由大到小的顺序为
的简单离子半径由大到小的顺序为_______ (用离子符号表示)。
(4)下列能说明 和G非金属性强弱的事实是
和G非金属性强弱的事实是_______ (填序号)。
① 的单质能与
的单质能与 的简单气态氢化物反应得到
的简单气态氢化物反应得到
②酸性:
③ 的单质与
的单质与 反应得到
反应得到 ,
, 的单质与
的单质与 反应得到
反应得到
④常温下, 的单质为固体,
的单质为固体, 的单质为气体
的单质为气体
 、
、 、
、 、
、 、
、 、
、 、
、 七种短周期元素,原子序数依次增大。已知
七种短周期元素,原子序数依次增大。已知 与
与 、
、 与
与 分别同主族,
分别同主族, 、
、 、
、 同周期;
同周期; 、
、 的最外层电子数之和与
的最外层电子数之和与 的最外层电子数相等,
的最外层电子数相等, 与
与 形成的化合物常温下为液态,
形成的化合物常温下为液态, 分别与
分别与 、
、 形成的气体分子电子总数相等,
形成的气体分子电子总数相等, 有多种同素异形体,其中一种是目前已知自然界中最硬的物质,可做首饰品或做切削工具。请回答下列问题:
有多种同素异形体,其中一种是目前已知自然界中最硬的物质,可做首饰品或做切削工具。请回答下列问题:(1)
 在周期表中的位置是
在周期表中的位置是(2)灼烧
 的化合物,焰色为
的化合物,焰色为 和
和 形成的一种化合物与
形成的一种化合物与 发生氧化还原反应,该反应的离子方程式为
发生氧化还原反应,该反应的离子方程式为(3)
 和
和 的简单气态氢化物中稳定性较强的是
的简单气态氢化物中稳定性较强的是 、
、 、
、 的简单离子半径由大到小的顺序为
的简单离子半径由大到小的顺序为(4)下列能说明
 和G非金属性强弱的事实是
和G非金属性强弱的事实是①
 的单质能与
的单质能与 的简单气态氢化物反应得到
的简单气态氢化物反应得到
②酸性:

③
 的单质与
的单质与 反应得到
反应得到 ,
, 的单质与
的单质与 反应得到
反应得到
④常温下,
 的单质为固体,
的单质为固体, 的单质为气体
的单质为气体
您最近一年使用:0次



