在压强为0.1MPa、10L恒容的密闭容器中,将2molCO与5molH2的混合气体在催化剂作用下能生成甲醇CO(g)+2H2(g)=CH3OH(g)△H<0请回答下列问题:
(1)该反应的熵变ΔS_________________ 0(填“>”、“<”或“=”).
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为_________________ mol
②反应的平衡常数K=_________________ ;
③反应0-5min在区间的平均反应速率v(H2)=_________________
(3)向反应器中再分别充入下列气体,能使CO转化率增大的是_________________
A.CO B.H2 C.CH3OH D.He
(1)该反应的熵变ΔS
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为
②反应的平衡常数K=
③反应0-5min在区间的平均反应速率v(H2)=
(3)向反应器中再分别充入下列气体,能使CO转化率增大的是
A.CO B.H2 C.CH3OH D.He
更新时间:2019-12-10 16:20:59
|
相似题推荐
【推荐1】在100℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2⇌ N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为__________ mol·L−1·s−1。
(2)n3________ (填“>”“<”或“=”)n4;该反应的平衡常数K的数值为___________ (精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______ mol·L−1。
(4)上述(3)达到平衡后N2O4的转化率为______________ ,混合气体的平均摩尔质量为______________ 。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2⇌N2O4的平衡常数将_______________ (填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将______________ (填“向左移动”“向右移动”或“不移动”)。
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为
(2)n3
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是
(4)上述(3)达到平衡后N2O4的转化率为
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2⇌N2O4的平衡常数将
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】在一定温度下,将4.0molSO2与2.0molO2的混合气体充入容积为2L的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),经过2min达到平衡状态,SO2的平衡转化率为90.0%。
2SO3(g),经过2min达到平衡状态,SO2的平衡转化率为90.0%。
(1)0~2min内O2的平均反应速率v(O2)=___ 。
(2)该温度下此反应的化学平衡常数的值K=___ 。
(3)在相同温度下,某容器内c(SO2)=c(O2)=c(SO3)=1.0mol·L-1,则此时反应速率v正___ v逆(填“>”、“<”或“=”)。
(4)在一定温度下,下列措施可以提高SO2转化率的是___ (填字母)。
A.增大SO2的浓度
B.容积不变,充入氖气
C.增大O2的浓度
D.容积不变,再充入4.0molSO2与2.0molO2
 2SO3(g),经过2min达到平衡状态,SO2的平衡转化率为90.0%。
2SO3(g),经过2min达到平衡状态,SO2的平衡转化率为90.0%。(1)0~2min内O2的平均反应速率v(O2)=
(2)该温度下此反应的化学平衡常数的值K=
(3)在相同温度下,某容器内c(SO2)=c(O2)=c(SO3)=1.0mol·L-1,则此时反应速率v正
(4)在一定温度下,下列措施可以提高SO2转化率的是
A.增大SO2的浓度
B.容积不变,充入氖气
C.增大O2的浓度
D.容积不变,再充入4.0molSO2与2.0molO2
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】已知A(g) +B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K=_____________ ,△H_____ 0(填“<” “>”或 “=”);
(2)830℃时,向体积为10L的密闭容器中充入0.2mol的A和0.2mol的B,如反应初始到10s内A的平均反应速率v(A)=0.001 mol·L-1·s-1,则10s时c(D)=_____ 。此时,该反应是否处于平衡状态:___ (填“是”或“否”)。达到平衡时A的转化率为__________ ,如果这时向该密闭容器中充入1mol氦气,A的转化率__________ (填“变大”、“变小”或“不变”)。
(3)可用于判断该反应达到平衡状态的依据为________ (填选项符号):
a、压强不随时间改变 b、气体的密度不再发生改变
c、c(D)不随时间改变 d、单位时间内生成A和C的物质的量相等
(4)1000℃时反应C(g)+D(g) A(g) +B(g)的平衡常数的值为
A(g) +B(g)的平衡常数的值为___________ 。
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/0C | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.1 | 1.0 | 0.5 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=
(2)830℃时,向体积为10L的密闭容器中充入0.2mol的A和0.2mol的B,如反应初始到10s内A的平均反应速率v(A)=0.001 mol·L-1·s-1,则10s时c(D)=
(3)可用于判断该反应达到平衡状态的依据为
a、压强不随时间改变 b、气体的密度不再发生改变
c、c(D)不随时间改变 d、单位时间内生成A和C的物质的量相等
(4)1000℃时反应C(g)+D(g)
 A(g) +B(g)的平衡常数的值为
A(g) +B(g)的平衡常数的值为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐1】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________ (用K1、K2表示)。
(2)反应③的ΔH_________ 0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正_____ v逆(填“>”、“=”或“<”)。
(4)500℃时2L密闭容器中投入a mol H2、b mol CO发生反应①;测得平衡时H2(g)、CO2(g)的浓度(mol·L-1)分别为0.2、0.1则:
①a=______ ,b=_________ ,平衡时H2的转换率为________ (保留一位有效数字)。
②若向平衡后的容器中再投入a mol H2、b mol CO,达平衡后,CH3OH的体积分数与原平衡相比______________ (填“增大”、“减小”或“不变”)
| 化学反应 | 平衡常数 | 温度/℃ | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)  H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | ||
(2)反应③的ΔH
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正
(4)500℃时2L密闭容器中投入a mol H2、b mol CO发生反应①;测得平衡时H2(g)、CO2(g)的浓度(mol·L-1)分别为0.2、0.1则:
①a=
②若向平衡后的容器中再投入a mol H2、b mol CO,达平衡后,CH3OH的体积分数与原平衡相比
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】830 K时,在密闭容器中发生下列可逆反应: CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH<0 。请回答下列问题:
(1)若起始时c(CO) =2 mol·L-1,c(H2O) =3 mol·L-1,4 s后达到平衡,此时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____ ;用H2O表示的化学反应速率为_____ 。
(2)在相同温度下,若起始时c(CO) =1 mol·L-1,c(H2O) =2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,此时v(正)______ v(逆) (填“大于”“小于”或“等于”)。
(3)若降低温度,该反应的K值可能为______ 。
a.1 b.2 c.0.5
(1)若起始时c(CO) =2 mol·L-1,c(H2O) =3 mol·L-1,4 s后达到平衡,此时CO的转化率为60%,则在该温度下,该反应的平衡常数K=
(2)在相同温度下,若起始时c(CO) =1 mol·L-1,c(H2O) =2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,此时v(正)
(3)若降低温度,该反应的K值可能为
a.1 b.2 c.0.5
您最近一年使用:0次


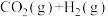 在密闭容器中建立了平衡。当温度为749 K时,
在密闭容器中建立了平衡。当温度为749 K时,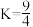 ,问:
,问:

