醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
 H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )| A.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)增大 |
| B.0.1 mol·L-1的醋酸溶液,由水电离出来的c(H+)=1.0×10-13 mol·L-1 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
更新时间:2019-12-21 11:44:59
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】常温下,下列各溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c( )+c(H+)+c(H2CO3) )+c(H+)+c(H2CO3) |
B.将pH=6的H2SO4稀释1000倍后,c(H+)=2c( ) ) |
| C.浓度分别为0.1 mol·L-1和0.01 mol·L-1的CH3COOH溶液中:c(CH3COO-)前者是后者的10倍 |
| D.NaA溶液的pH=8,c(Na+)-c(A-)=9.9×10-7 mol·L-1 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述错误的是
H++CH3COO-,下列叙述错误的是
 H++CH3COO-,下列叙述错误的是
H++CH3COO-,下列叙述错误的是| A.向溶液中加少量的CH3COONa固体,平衡逆向移动,c(CH3COO-)增大 |
| B.0.10mol/L的CH3COOH溶液中加少量水,平衡正向移动,导电性增强 |
| C.通入少量NH3气体,c(H+)减小、c(OH-)增加 |
| D.25℃时,加入少量浓醋酸,平衡正向移动,醋酸的电离程度减弱 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
 CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )| A.加入水时,平衡向右移动,CH3COOH电离常数增大 |
| B.加入少量CH3COONa固体,平衡向右移动 |
| C.加入少量NaOH固体,平衡向右移动,c(H+)减小 |
| D.加入少量pH=5的硫酸,溶液中c(H+)增大 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】常温下,加水稀释冰醋酸,再此过程中始终增大的是
| A.溶液的导电能力 | B.醋酸的电离度 |
C.溶液的 值 值 | D.醋酸的电离平衡常数 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】在醋酸的电离平衡CH3COOH CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是
CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是
 CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是
CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是| A.加入NaOH(s) |
| B.通入HCl气体 |
| C.加蒸馏水 |
| D.升高温度 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】在100 mL 0.1 mol·L-1的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度也增大,可采用的方法是
| A.升高一定的温度 |
| B.加入100 mL 0.1 mol·L-1的醋酸溶液 |
| C.加入少量的0.5 mol·L-1的硫酸 |
| D.加入少量的1 mol·L-1的NaOH溶液 |
您最近一年使用:0次


 溶液中存在电离平衡:
溶液中存在电离平衡: ,下列说法正确的是
,下列说法正确的是 的
的 固体(忽略溶解热效应),平衡向右移动,水电离程度也随之增大
固体(忽略溶解热效应),平衡向右移动,水电离程度也随之增大 固体,平衡向左移动,
固体,平衡向左移动,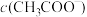 下降
下降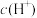 不变
不变

