常温下,下列各溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c( )+c(H+)+c(H2CO3) )+c(H+)+c(H2CO3) |
B.将pH=6的H2SO4稀释1000倍后,c(H+)=2c( ) ) |
| C.浓度分别为0.1 mol·L-1和0.01 mol·L-1的CH3COOH溶液中:c(CH3COO-)前者是后者的10倍 |
| D.NaA溶液的pH=8,c(Na+)-c(A-)=9.9×10-7 mol·L-1 |
20-21高三上·天津·期中 查看更多[4]
天津地区2021届高三上学期期中考试模拟测化学试题江西省鹰潭市贵溪市实验中学2020--2021学年高二上学期第二次月考化学试题(已下线)小题必刷29 弱电解质的电离平衡——2021年高考化学一轮复习小题必刷(通用版本)山西省沁县中学2020-2021学年高二上学期第二次月考化学试题
更新时间:2020-11-13 09:00:18
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】现有pH=5的CH3COOH溶液10 mL,要使pH增大3,可采取的方法有( )
| A.向溶液中加水稀释至10 L | B.加入一定量的NaOH固体 |
| C.加入一定量pH=8的NaOH溶液 | D.加入一定浓度的盐酸 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】已知K2HPO4溶液中水解程度大于电离程度,对于平衡HPO +H2O
+H2O H3O++PO
H3O++PO ,欲使溶液中c(HPO
,欲使溶液中c(HPO )、c(PO
)、c(PO )、c(H3O+)三种离子浓度均减少,可采用的方法是
)、c(H3O+)三种离子浓度均减少,可采用的方法是
 +H2O
+H2O H3O++PO
H3O++PO ,欲使溶液中c(HPO
,欲使溶液中c(HPO )、c(PO
)、c(PO )、c(H3O+)三种离子浓度均减少,可采用的方法是
)、c(H3O+)三种离子浓度均减少,可采用的方法是| A.加水 | B.加热 |
| C.加消石灰 | D.加AgNO3 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】下列推断正确的是
| A.pH=6.5的溶液一定显酸性 |
| B.0.1mol•L-1的Na2CO3溶液中:c(CO32-)+c(HCO3-)=0.1mol•L-1 |
| C.常温下,等体积的0.2 mol•L-1的盐酸与0.2 mol•L-1的氢氧化钡溶液混合,所得溶液的pH=13 |
| D.常温下某溶液中水电离出的c(OH-)=l×10-12mol•L-1,该溶液pH 一定等于2 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】下列有关电解质溶液中粒子浓度关系正确的是
A. 的 的 溶液: 溶液: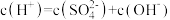 |
B.含有 和 和 固体的悬浊液: 固体的悬浊液: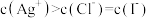 |
C. 和 和 混合溶液: 混合溶液: |
D. 与 与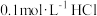 溶液等体积混合( 溶液等体积混合( 为二元弱酸): 为二元弱酸):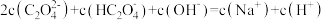 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐3】氯气与水的反应是一个典型的可逆反应,若该反应达到平衡后,只改变某一条件,则下列叙述正确的是( )
A.通入少量 时, 时, 减小 减小 |
B.通入少量 时,溶液的漂白性明显增强 时,溶液的漂白性明显增强 |
C.加入少量固体NaOH时,溶液中一定有c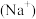 =c =c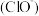 +c +c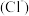 |
| D.加入少量水时溶液中水的电离平衡正向移动 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】25℃时,下列说法正确的是
| A.向Na2C2O4溶液中加水,溶液中所有离子浓度都减小 |
| B.pH=3的醋酸溶液和pH=4的醋酸溶液,醋酸浓度前者是后者的10倍 |
C.浓度均为 的三种溶液:NaClO、 的三种溶液:NaClO、 、 、 pH依次增大 pH依次增大 |
D.pH=1的HA溶液和 的MOH溶液等体积混合后,恰好完全反应,则HA为强酸 的MOH溶液等体积混合后,恰好完全反应,则HA为强酸 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】常温下,向25mL0.1mol/L的MOH溶液中,逐滴滴加0.1mol/L的醋酸溶液,其pH变化情况如图所示。则下列说法中一定不正确 的是


| A.MOH可以溶解Al(OH)3 |
| B.B点对应的体积a大于25mL |
| C.C点时,有c(CH3COO-)>c(M+) |
| D.D点时,有c(CH3COOH)>c(CH3COO-) |
您最近一年使用:0次

 盐酸和
盐酸和 ,稀释过程中溶液
,稀释过程中溶液 的变化如图所示。下列说法正确的是
的变化如图所示。下列说法正确的是
 醋酸溶液中:
醋酸溶液中:
 不变
不变


 ,
, 由大到小排序正确的是
由大到小排序正确的是

