辉铜矿主要成分为Cu2S,软锰矿主要成分MnO2,它们都含有少量Fe2O3、SiO2等杂质。工业上综合利用这两种矿物制备硫酸铜、硫酸锰和硫单质的主要工艺流程如下:
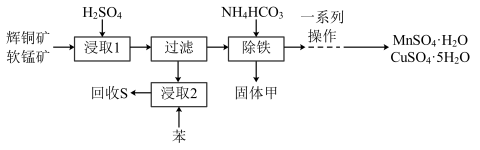
(1)浸取2过程中温度控制在500C~600C之间的原因是__________________ 。
(2)硫酸浸取时,Fe3+对MnO2氧化Cu2S起着重要催化作用,该过程可能经过两岁反应完成,将其补充完整:
①_____________________________ (用离子方程式表示)
②MnO2+2Fe2++4H+= Mn2++2Fe3++2H2O
(3)固体甲是一种碱式盐,为测定甲的化学式,进行以下实验:
步骤1:取19.2 g固体甲,加足量的稀盐酸溶解,将所得溶液分为A、B两等份;
步骤2:向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下)过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得4.80g红棕色固体残渣:
步骤3:向B中加入足量的BaCl2溶液,过滤、洗涤、干燥,可得9.32g固体残渣。
则固体甲的化学式为_________________
(4)相关物质的溶解度如下图,从除铁后的溶液中通过一系列的操作分别获得硫酸铜、硫酸锰晶体,请给出合理的操作顺序(从下列操作中选取,按先后次序列出字母,操作可重复使用):溶液→( ) →( )→( ) →(A) →( ) →( ) →( ),_____________
A.蒸发溶剂 B.趁热过滤 C.冷却结晶 D.过滤
E.将溶液蒸发至溶液表面出现晶膜 F.将溶液蒸发至容器底部出现大量晶体


(1)浸取2过程中温度控制在500C~600C之间的原因是
(2)硫酸浸取时,Fe3+对MnO2氧化Cu2S起着重要催化作用,该过程可能经过两岁反应完成,将其补充完整:
①
②MnO2+2Fe2++4H+= Mn2++2Fe3++2H2O
(3)固体甲是一种碱式盐,为测定甲的化学式,进行以下实验:
步骤1:取19.2 g固体甲,加足量的稀盐酸溶解,将所得溶液分为A、B两等份;
步骤2:向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下)过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得4.80g红棕色固体残渣:
步骤3:向B中加入足量的BaCl2溶液,过滤、洗涤、干燥,可得9.32g固体残渣。
则固体甲的化学式为
(4)相关物质的溶解度如下图,从除铁后的溶液中通过一系列的操作分别获得硫酸铜、硫酸锰晶体,请给出合理的操作顺序(从下列操作中选取,按先后次序列出字母,操作可重复使用):溶液→( ) →( )→( ) →(A) →( ) →( ) →( ),
A.蒸发溶剂 B.趁热过滤 C.冷却结晶 D.过滤
E.将溶液蒸发至溶液表面出现晶膜 F.将溶液蒸发至容器底部出现大量晶体

更新时间:2019-12-24 10:32:44
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】回收废旧电池,既可以减轻重金属对环境的污染,又可以变废为宝。对废弃的锂电池正极材料LiCoO2进行氯化处理以回收Li、Co等金属的工艺路线如图: 的电离常数
的电离常数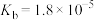 ,
, 的电离常数
的电离常数 、
、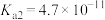 、
、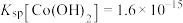 、
、 。
。
回答下列问题:
(1)写出一条提高焙烧效率的措施:_______ 。
(2)若烧渣是LiCl、 和
和 的混合物,写出焙烧时发生反应的化学方程式:
的混合物,写出焙烧时发生反应的化学方程式:_______ 。
(3)简述洗涤滤饼3的操作:_______ 。
(4)现有pH相同的以下三种溶液。
a.NaOH溶液 b.Na2CO3溶液 c.氨水
①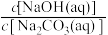
_______ (填“>”、“<”或“=”)1。
②三种溶液中由水电离出的 的浓度的关系是
的浓度的关系是_______ (用a、b、c表示)。
(5)Co2+完全沉淀时(溶液中离子浓度小于 时可认为沉淀完全),溶液的pH最小值约为
时可认为沉淀完全),溶液的pH最小值约为_______ 。
(6)煅烧滤饼2时发生反应的化学方程式为_______ ,得到的 的组成类似于
的组成类似于 ,则
,则 中
中 与
与 的个数比为
的个数比为_______ 。

 的电离常数
的电离常数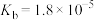 ,
, 的电离常数
的电离常数 、
、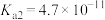 、
、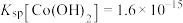 、
、 。
。回答下列问题:
(1)写出一条提高焙烧效率的措施:
(2)若烧渣是LiCl、
 和
和 的混合物,写出焙烧时发生反应的化学方程式:
的混合物,写出焙烧时发生反应的化学方程式:(3)简述洗涤滤饼3的操作:
(4)现有pH相同的以下三种溶液。
a.NaOH溶液 b.Na2CO3溶液 c.氨水
①
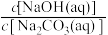
②三种溶液中由水电离出的
 的浓度的关系是
的浓度的关系是(5)Co2+完全沉淀时(溶液中离子浓度小于
 时可认为沉淀完全),溶液的pH最小值约为
时可认为沉淀完全),溶液的pH最小值约为(6)煅烧滤饼2时发生反应的化学方程式为
 的组成类似于
的组成类似于 ,则
,则 中
中 与
与 的个数比为
的个数比为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】合成氨工业产生的钻钼废催化剂(主要成分MoS2、CoO、Fe2O3等)是一种相当宝贵的二次资源。用碱浸法处理钻钼废催化剂的工艺流程如图:
i.氧化钼(MoO3):熔点795℃。易升华(即使在低于熔点情况下,也有显著的升华现象)。
ii.钼酸(H2MoO4):难溶于水和酸的黄色晶体,可通过酸化钼酸盐溶液而制得。
(1)焙烧:
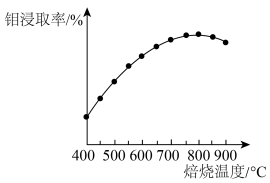
①将废催化剂在空气中焙烧可生成氧化钼,写出反应的化学方程式_______ 。
②解释钼浸取率随焙烧温度变化的原因是_______ 。
碱浸时杂质钴元素以Co(OH)2的形式浸出,加入双氧水可将其氧化为Co(OH)3沉淀。写出反应的化学方程式_______ 。
(3)酸沉:
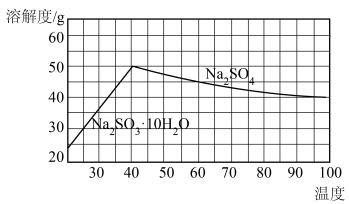
传统工艺中酸沉多在不锈钢离心机中进行。文献记载,选用浓硝酸比用硫酸和盐酸效果更佳,可避免Mo(VI)还原成低价态,利用了浓硝酸的_______ 性。
(4)从母液中获得无水Na2SO4的操作是_______ 。

i.氧化钼(MoO3):熔点795℃。易升华(即使在低于熔点情况下,也有显著的升华现象)。
ii.钼酸(H2MoO4):难溶于水和酸的黄色晶体,可通过酸化钼酸盐溶液而制得。
(1)焙烧:
①将废催化剂在空气中焙烧可生成氧化钼,写出反应的化学方程式
②解释钼浸取率随焙烧温度变化的原因是
碱浸时杂质钴元素以Co(OH)2的形式浸出,加入双氧水可将其氧化为Co(OH)3沉淀。写出反应的化学方程式
(3)酸沉:
传统工艺中酸沉多在不锈钢离心机中进行。文献记载,选用浓硝酸比用硫酸和盐酸效果更佳,可避免Mo(VI)还原成低价态,利用了浓硝酸的
(4)从母液中获得无水Na2SO4的操作是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】某工业废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。若取这种废液来制取较纯净的氯化钾晶体及液溴(Br2)可设计如下流程:
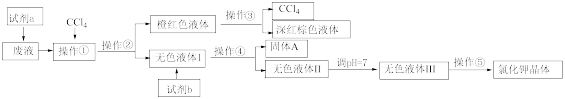
可供试剂a、b的选择试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2、KMnO4(H+)溶液、稀HNO3。
(1)试剂a应该选用________ ;
(2)操作①、②、③、④、⑤的名称是_____ (选填字母编号)。
a.萃取、过滤、分液、过滤、蒸发结晶 b.萃取、分液、蒸馏、过滤、蒸发结晶
c.分液、萃取、过滤、过滤、蒸发结晶 d.萃取、分液、分液、过滤、蒸发结晶
(3)除去无色液体I中的Ca2+、Mg2+、SO42-离子,选出b所代表的试剂,按滴加顺序依次是_______ (填写化学式)。
(4)调节pH的作用是________ ,操作方法是_________ 。
(5)操作⑤中用到的瓷质仪器名称是_____ 。
(6)如果用电解氯化钾溶液来制取氢气和氯气,再使氢气与氯气反应生成氯化氢,将生成的氯化氢用水吸收制得盐酸。为了制得100吨35%的盐酸,理论上需氯化钾_________ 吨。

可供试剂a、b的选择试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2、KMnO4(H+)溶液、稀HNO3。
(1)试剂a应该选用
(2)操作①、②、③、④、⑤的名称是
a.萃取、过滤、分液、过滤、蒸发结晶 b.萃取、分液、蒸馏、过滤、蒸发结晶
c.分液、萃取、过滤、过滤、蒸发结晶 d.萃取、分液、分液、过滤、蒸发结晶
(3)除去无色液体I中的Ca2+、Mg2+、SO42-离子,选出b所代表的试剂,按滴加顺序依次是
(4)调节pH的作用是
(5)操作⑤中用到的瓷质仪器名称是
(6)如果用电解氯化钾溶液来制取氢气和氯气,再使氢气与氯气反应生成氯化氢,将生成的氯化氢用水吸收制得盐酸。为了制得100吨35%的盐酸,理论上需氯化钾
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,又称保险粉,是一种白色粉末,易溶于水,但不溶于乙醇,在碱性介质中稳定。
(1)Na2S2O4中S元素的化合价为____ 。
(2)连二亚硫酸钠在潮湿空气中极不稳定,易分解并引起燃烧,甚至发生爆炸,反应的化学方程式为:2Na2S2O4=Na2S2O3+Na2SO3+___ 。保存“保险粉”时常加入少量Na2CO3固体,目的是___ 。
(3)Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,当氧化剂和还原剂的物质的量之比为1:2时,反应产物的化学式为____ 。
(4)工业上可用如图装置电解NaHSO3和NaCl溶液制Na2S2O4。总反应为:2NaHSO3+2NaCl Na2S2O4+2NaOH+C12↑
Na2S2O4+2NaOH+C12↑

①惰性电极a连接电源的____ (填“正极”或“负极”),其电极反应式为____ ;
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是____ 。
向银离子的乙二胺四乙酸(EDTA)配合物溶液中,滴加用NaOH碱化的连二亚硫酸钠溶液可生成纳米级银粉,该方法能用来测定Na2S2O4纯度,其反应原理可简单表示为:2Ag++S2O42-+4OH-=2Ag↓+2SO32-+2H2O。现取5.000g粗产品用上述方法测定纯度,将制得纳米级银过滤、洗涤、干燥、称量,其质量为4.320g。计算粗产品中连二亚硫酸钠的质量分数为____ 。测得连二亚硫酸钠的纯度比实际值小,若排除实验过程中的操作误差,分析可能的原因是____ 。
(1)Na2S2O4中S元素的化合价为
(2)连二亚硫酸钠在潮湿空气中极不稳定,易分解并引起燃烧,甚至发生爆炸,反应的化学方程式为:2Na2S2O4=Na2S2O3+Na2SO3+
(3)Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,当氧化剂和还原剂的物质的量之比为1:2时,反应产物的化学式为
(4)工业上可用如图装置电解NaHSO3和NaCl溶液制Na2S2O4。总反应为:2NaHSO3+2NaCl
 Na2S2O4+2NaOH+C12↑
Na2S2O4+2NaOH+C12↑
①惰性电极a连接电源的
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是
向银离子的乙二胺四乙酸(EDTA)配合物溶液中,滴加用NaOH碱化的连二亚硫酸钠溶液可生成纳米级银粉,该方法能用来测定Na2S2O4纯度,其反应原理可简单表示为:2Ag++S2O42-+4OH-=2Ag↓+2SO32-+2H2O。现取5.000g粗产品用上述方法测定纯度,将制得纳米级银过滤、洗涤、干燥、称量,其质量为4.320g。计算粗产品中连二亚硫酸钠的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】请选择适当的化学试剂和实验用品,用如图所示的装置进行实验(C中盛放的是过氧化钠),证明过氧化钠可在呼吸面具和潜水艇中做供氧剂。

(1)A是实验室中制取CO2的装置,其中仪器m的名称是___________ ,写出A中发生反应的离子方程式 ___________ ;过氧化钠中阴阳离子个数比为 ___________ 。
(2)装置B中,加入的试剂是NaHCO3溶液,加入该试剂的目的是___________ 。
(3)写出C中发生反应主要的化学方程式:___________ 。加入该试剂的目的是 ___________ 。
(4)装置D中,加入的试剂是___________ 。
(5)能证明“过氧化钠可在呼吸面具和潜水艇中做供氧剂”的实验现象有___________ 。
A.C装置中的淡黄色固体变为白色
B.D装置中无明显现象
C.F中收集到无色气体,该气体可以使带火星的木条复燃

(1)A是实验室中制取CO2的装置,其中仪器m的名称是
(2)装置B中,加入的试剂是NaHCO3溶液,加入该试剂的目的是
(3)写出C中发生反应主要的化学方程式:
(4)装置D中,加入的试剂是
(5)能证明“过氧化钠可在呼吸面具和潜水艇中做供氧剂”的实验现象有
A.C装置中的淡黄色固体变为白色
B.D装置中无明显现象
C.F中收集到无色气体,该气体可以使带火星的木条复燃
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】乙烯是重要有机化工原料。结合以下路线回答:

已知:2CH3CHO+O2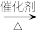 2CH3COOH
2CH3COOH
(1)反应①的反应类型是____ ,B的官能团是____ 。
(2)F是一种高分子,可用于制作食品袋,其结构简式为____ 。
(3)G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E反应制取G,装置如图1所示。

i.关于该实验的说法错误的是____ (填序号)。
a.甲中加入几片碎瓷片可以防止暴沸
b.乙中导管不伸入液面下是为了防止倒吸
c.甲中加入过量D,可使E的转化率达到100%
d.实验结束,乙中液体上层为无色透明的油状液体
e.乙中的饱和Na2CO3溶液可以用NaOH代替
ii.反应⑥的化学方程式是____ ,反应类型是____ 。
iii.分离出试管乙中油状液体的方法是____ 。
制法二:工业上用CH2=CH2和E直接反应获得G。
iv.直接反应获得G的化学反应方程式是____ 。
v.与制法一相比,制法二的优点是____ 。
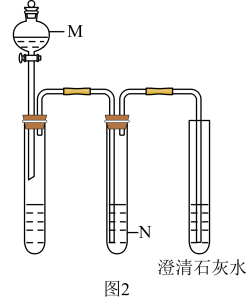
(4)采用装置如图2证明乙酸的酸性强于碳酸。试剂M、N分别是:____ 、____ 。

已知:2CH3CHO+O2
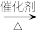 2CH3COOH
2CH3COOH(1)反应①的反应类型是
(2)F是一种高分子,可用于制作食品袋,其结构简式为
(3)G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E反应制取G,装置如图1所示。

i.关于该实验的说法错误的是
a.甲中加入几片碎瓷片可以防止暴沸
b.乙中导管不伸入液面下是为了防止倒吸
c.甲中加入过量D,可使E的转化率达到100%
d.实验结束,乙中液体上层为无色透明的油状液体
e.乙中的饱和Na2CO3溶液可以用NaOH代替
ii.反应⑥的化学方程式是
iii.分离出试管乙中油状液体的方法是
制法二:工业上用CH2=CH2和E直接反应获得G。
iv.直接反应获得G的化学反应方程式是
v.与制法一相比,制法二的优点是
(4)采用装置如图2证明乙酸的酸性强于碳酸。试剂M、N分别是:

您最近一年使用:0次



