金属镓是一种广泛用于电子和通信领域的重要金属,其化学性质与铝相似。
(1)工业上提纯镓的方法有很多,其中以电解精炼法为主。具体原理如下:以待提纯的粗镓(含有Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子的氧化性顺序为Zn2+<Ga3+<Fe2+<Cu2+电解精炼镓时阳极泥的成分为________ 。
②GaO2— 在阴极放电的电极反应式为______ 。
(2)工业上利用固态Ga与NH3在高温条件下合成固态半导体材料氮化镓(GaN),同时有氢气生成。反应过程中每生成3 mol H2,放出30.8 kJ的热量。
①该反应的热化学方程式为______ 。
②一定条件下,一定量的Ga与NH3进行上述反应,下列叙述符合事实且可作为判断反应已达到平衡状态的标志的是______ (填字母)。
A. 恒温恒压下,混合气体的密度不变
B. 断裂3 mol H—H键,同时断裂2 mol N—H键
C. 恒温恒压下,反应达到平衡时,向反应体系中加入 2 mol H2,NH3的消耗速率等于原平衡时NH3的消耗速率
D. 恒温恒容下, NH3 与H2的物质的量浓度之比为2︰3
(1)工业上提纯镓的方法有很多,其中以电解精炼法为主。具体原理如下:以待提纯的粗镓(含有Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子的氧化性顺序为Zn2+<Ga3+<Fe2+<Cu2+电解精炼镓时阳极泥的成分为
②GaO2— 在阴极放电的电极反应式为
(2)工业上利用固态Ga与NH3在高温条件下合成固态半导体材料氮化镓(GaN),同时有氢气生成。反应过程中每生成3 mol H2,放出30.8 kJ的热量。
①该反应的热化学方程式为
②一定条件下,一定量的Ga与NH3进行上述反应,下列叙述符合事实且可作为判断反应已达到平衡状态的标志的是
A. 恒温恒压下,混合气体的密度不变
B. 断裂3 mol H—H键,同时断裂2 mol N—H键
C. 恒温恒压下,反应达到平衡时,向反应体系中加入 2 mol H2,NH3的消耗速率等于原平衡时NH3的消耗速率
D. 恒温恒容下, NH3 与H2的物质的量浓度之比为2︰3
更新时间:2020-01-11 04:26:07
|
相似题推荐
【推荐1】Ⅰ:在一定温度下,体积为2L的密闭容器中,NO2(红棕色)
和N2O4(无色)之间发生反应: N2O4(g) 2NO2 (g),如图所示。
2NO2 (g),如图所示。

(1)曲线____ (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)若升高温度,则v(正)____ ,v(逆)____ (填“加快”或“减慢”)。
(3)上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3 mol·L-1·min-1,乙中v (N2O4)=0.2 mol·L-1·min-1,则______ 中反应更快(填“甲”或“乙”)。
(4)在0到1 min(图中X与Y交点所对应的横坐标)内用X表示该反应的速率是____ ,该反应达最大限度时,Y的转化率_____ ,反应开始时与反应达平衡状态时的压强之比为___ 。
(5)下列描述能表示反应达平衡状态的是______ 。
A.容器中X与Y的物质的量相等
B.容器内气体的颜色不再改变
C.容器的压强保持一定
D. v正(X)=2v逆(Y)
Ⅱ:利用H2和CO2在一定条件下可以合成乙烯:6H2+2CO2 CH2=CH2+4H2O。已知:4.4 g CO2与H2完全转化为CH2=CH2和H2O(g)共放出6.39 kJ的热量,写出该反应的热化学方程式:
CH2=CH2+4H2O。已知:4.4 g CO2与H2完全转化为CH2=CH2和H2O(g)共放出6.39 kJ的热量,写出该反应的热化学方程式: __________________________________ 。
Ⅲ:甲烷碱性燃料电池采用氢氧化钾溶液做电解质溶液,写出该电池负极的电极反应式:______________ 。
和N2O4(无色)之间发生反应: N2O4(g)
 2NO2 (g),如图所示。
2NO2 (g),如图所示。
(1)曲线
(2)若升高温度,则v(正)
(3)上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3 mol·L-1·min-1,乙中v (N2O4)=0.2 mol·L-1·min-1,则
(4)在0到1 min(图中X与Y交点所对应的横坐标)内用X表示该反应的速率是
(5)下列描述能表示反应达平衡状态的是
A.容器中X与Y的物质的量相等

B.容器内气体的颜色不再改变
C.容器的压强保持一定
D. v正(X)=2v逆(Y)
Ⅱ:利用H2和CO2在一定条件下可以合成乙烯:6H2+2CO2
 CH2=CH2+4H2O。已知:4.4 g CO2与H2完全转化为CH2=CH2和H2O(g)共放出6.39 kJ的热量,写出该反应的热化学方程式:
CH2=CH2+4H2O。已知:4.4 g CO2与H2完全转化为CH2=CH2和H2O(g)共放出6.39 kJ的热量,写出该反应的热化学方程式: Ⅲ:甲烷碱性燃料电池采用氢氧化钾溶液做电解质溶液,写出该电池负极的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】I.镓是一种低熔点、 高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业。回答下列问题:
(1)镓(Ga)的原子结构示意图为 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是_______
(2)GaAs的熔点为1238℃,且熔融状态不导电, 据此判断,该化合物是_______ (填“共价化合物”或“离子化合物”)。
(3)已知As与Ga同周期,As与N同主族。下列事实不能用元素周期律解释的是_______ (填标序号);
a.原子半径:Ca>As b.热稳定性:NH3>AsH3
c.碱性: Ga(OH)3>Al(OH)3,d.酸性: H3AsO4>H3AsO3
II.利用反应4HCl+O2 2Cl2+2H2O, 可实现氯的循环利用,已知:该反应中,2 molHCl被氧化时,放出57.8 kJ的热量。请回答下列有关问题:
2Cl2+2H2O, 可实现氯的循环利用,已知:该反应中,2 molHCl被氧化时,放出57.8 kJ的热量。请回答下列有关问题:

(4)4 mol HCl被氧化时,放出_______ kJ的热量。
(5)根据图示的能量转化关系判断,生成16gCH3OH(l)_______ (填“吸收”或“放出”)_______ J能量。

(1)镓(Ga)的原子结构示意图为
 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是(2)GaAs的熔点为1238℃,且熔融状态不导电, 据此判断,该化合物是
(3)已知As与Ga同周期,As与N同主族。下列事实不能用元素周期律解释的是
a.原子半径:Ca>As b.热稳定性:NH3>AsH3
c.碱性: Ga(OH)3>Al(OH)3,d.酸性: H3AsO4>H3AsO3
II.利用反应4HCl+O2
 2Cl2+2H2O, 可实现氯的循环利用,已知:该反应中,2 molHCl被氧化时,放出57.8 kJ的热量。请回答下列有关问题:
2Cl2+2H2O, 可实现氯的循环利用,已知:该反应中,2 molHCl被氧化时,放出57.8 kJ的热量。请回答下列有关问题:
(4)4 mol HCl被氧化时,放出
(5)根据图示的能量转化关系判断,生成16gCH3OH(l)

您最近一年使用:0次
【推荐3】硅有望成为未来的新能源。回答下列问题:
(1)硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)ΔH=-989.32kJ·mol-1。有关键能数据如下表所示:
已知1molSi中含2molSi—Si键,1molSiO2中含4molSi—O键,表中x=______ 。
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等。硅光电池是一种把_______ 能转化为_________ 能的装置。
(3)下列对硅作为未来新能源的认识错误的是_________ (填标号)。
A.硅是固体燃料,便于运输、贮存
B.硅的来源丰富,易于开采且可再生
C.硅燃烧放出的热量大,其燃烧产物对环境污染程度低且易控制
D.自然界中存在大量的单质硅
(4)工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在制备纯硅的反应过程中________ (填“吸收”或“放出”)的热量为_______ kJ。
(1)硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)ΔH=-989.32kJ·mol-1。有关键能数据如下表所示:
| 化学键 | Si—O | O=O | Si—Si |
| 键能/(kJ·mol-1) | x | 498.8 | 176 |
已知1molSi中含2molSi—Si键,1molSiO2中含4molSi—O键,表中x=
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等。硅光电池是一种把
(3)下列对硅作为未来新能源的认识错误的是
A.硅是固体燃料,便于运输、贮存
B.硅的来源丰富,易于开采且可再生
C.硅燃烧放出的热量大,其燃烧产物对环境污染程度低且易控制
D.自然界中存在大量的单质硅
(4)工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在制备纯硅的反应过程中
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】CH3OH是一种绿色能源,也是一种化工原料。回答下列问题:
Ⅰ.合成甲醇。
工业上常用CO和H2制备CH3OH,反应原理是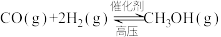
 。
。
(1)已知:①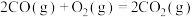
 kJ⋅mol
kJ⋅mol
②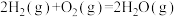
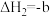 kJ⋅mol
kJ⋅mol
③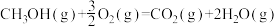
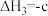 kJ⋅mol
kJ⋅mol
上述反应的
___________ kJ⋅mol (用含a、b、c的代数式表示)。
(用含a、b、c的代数式表示)。
(2)在恒温恒容密闭容器中充入1 mol 和1 mol
和1 mol  合成
合成 。下列情况表明该反应一定达到平衡状态的是___________(填字母)。
。下列情况表明该反应一定达到平衡状态的是___________(填字母)。
(3)向体积相同的甲、乙恒容密闭容器中均充入1 mol 和3 mol
和3 mol  同时发生反应合成
同时发生反应合成 ,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。
,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。___________ (填“高于”或“低于”)乙,判断依据是___________ 。
②
___________ (填“>”“<”或“=”)0,判断依据是___________ 。
③若容器体积为1 L,甲容器中0~4 min内用H2表示的平均反应速率为___________ mol⋅L ⋅min
⋅min 。
。
Ⅱ.可用于合成有机物。
近日,中国科学院大连化学物理研究所丁云杰团队利用Rh单核配合物催化剂以和CO为原料合成了CH3COOH,相关反应为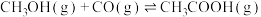 、
、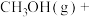
 。
。
(4)以CH3OH和CO为原料,从原子利用率分析,合成___________ (填“CH3COOH”或“CH3COOCH3”)是最理想的绿色化学工艺。
(5)一定温度下,总压强保持1.5a kPa,向反应器中充入1 mol 和1 mol
和1 mol  ,在一定条件下合成
,在一定条件下合成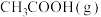 和
和 。达到平衡时,
。达到平衡时, 的转化率为60%,
的转化率为60%,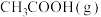 的选择性为80%,(
的选择性为80%,( 的选择性
的选择性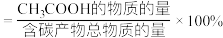 )。该温度下合成
)。该温度下合成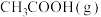 反应的平衡常数
反应的平衡常数
___________  (用含a的代数式表示,
(用含a的代数式表示, 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
Ⅰ.合成甲醇。
工业上常用CO和H2制备CH3OH,反应原理是
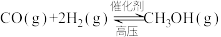
 。
。(1)已知:①
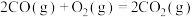
 kJ⋅mol
kJ⋅mol
②
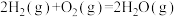
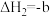 kJ⋅mol
kJ⋅mol
③
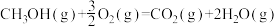
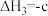 kJ⋅mol
kJ⋅mol
上述反应的

 (用含a、b、c的代数式表示)。
(用含a、b、c的代数式表示)。(2)在恒温恒容密闭容器中充入1 mol
 和1 mol
和1 mol  合成
合成 。下列情况表明该反应一定达到平衡状态的是___________(填字母)。
。下列情况表明该反应一定达到平衡状态的是___________(填字母)。| A.气体压强不随时间变化 | B.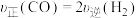 |
| C.气体密度不随时间变化 | D.气体平均摩尔质量不随时间变化 |
(3)向体积相同的甲、乙恒容密闭容器中均充入1 mol
 和3 mol
和3 mol  同时发生反应合成
同时发生反应合成 ,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。
,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。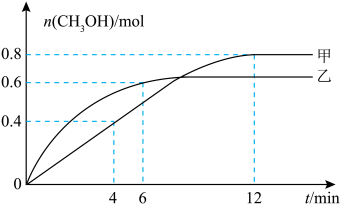
②

③若容器体积为1 L,甲容器中0~4 min内用H2表示的平均反应速率为
 ⋅min
⋅min 。
。Ⅱ.可用于合成有机物。
近日,中国科学院大连化学物理研究所丁云杰团队利用Rh单核配合物催化剂以和CO为原料合成了CH3COOH,相关反应为
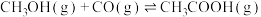 、
、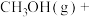
 。
。(4)以CH3OH和CO为原料,从原子利用率分析,合成
(5)一定温度下,总压强保持1.5a kPa,向反应器中充入1 mol
 和1 mol
和1 mol  ,在一定条件下合成
,在一定条件下合成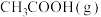 和
和 。达到平衡时,
。达到平衡时, 的转化率为60%,
的转化率为60%,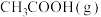 的选择性为80%,(
的选择性为80%,( 的选择性
的选择性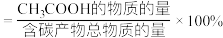 )。该温度下合成
)。该温度下合成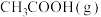 反应的平衡常数
反应的平衡常数
 (用含a的代数式表示,
(用含a的代数式表示, 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。

(1)a点正反应速率_______ (填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________ 。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)求平衡时CO2的转化率____________ 。
(4)在恒温恒容的条件下,下列能说明该反应已经达到平衡状态的是_______ 。
A.K不变 B.容器内压强保持不变
C.v正(H2)=3v正(CO2) D.容器内的密度保持不变
(5)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_________ ,曲线Ⅲ对应的实验条件改变是______ 。
A.升高温度
B.增大压强
C.加入的催化剂
D.降低温度
E.减小压强
 CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
(1)a点正反应速率
(2)下列时间段平均反应速率最大的是
A.0~1min B.1~3min C.3~8min D.8~11min
(3)求平衡时CO2的转化率
(4)在恒温恒容的条件下,下列能说明该反应已经达到平衡状态的是
A.K不变 B.容器内压强保持不变
C.v正(H2)=3v正(CO2) D.容器内的密度保持不变
(5)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是
A.升高温度
B.增大压强
C.加入的催化剂
D.降低温度
E.减小压强
您最近一年使用:0次
【推荐3】 、CO、
、CO、 等都是重要的能源,也是重要的化工原料。
等都是重要的能源,也是重要的化工原料。
(1)25℃,101kPa时, 完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:___________ 。
(2)水煤气中的CO和 在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和
在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和 ,一定温度下发生反应:
,一定温度下发生反应: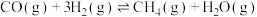 。测得CO和
。测得CO和 的转化率随时间变化如图所示:
的转化率随时间变化如图所示:___________ ,6min时, 的转化率为
的转化率为___________ 。
②下列叙述中能说明上述反应达到化学平衡状态的是___________ (填字母)。
a.容器中混合气体的密度保持不变 b.容器中混合气体的总压强保持不变
c.容器中 d.单位时间内每消耗1molCO,同时生成
d.单位时间内每消耗1molCO,同时生成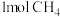
e.容器中混合气体的平均相对分子质量保持不变
(3)甲烷燃料电池装置如图,通入氧气的电极为电池的___________ (填“正极”或“负极”)。通入 一端电极反应方程式为:
一端电极反应方程式为:___________ 。
 、CO、
、CO、 等都是重要的能源,也是重要的化工原料。
等都是重要的能源,也是重要的化工原料。(1)25℃,101kPa时,
 完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:(2)水煤气中的CO和
 在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和
在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和 ,一定温度下发生反应:
,一定温度下发生反应: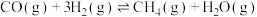 。测得CO和
。测得CO和 的转化率随时间变化如图所示:
的转化率随时间变化如图所示:
 的转化率为
的转化率为②下列叙述中能说明上述反应达到化学平衡状态的是
a.容器中混合气体的密度保持不变 b.容器中混合气体的总压强保持不变
c.容器中
 d.单位时间内每消耗1molCO,同时生成
d.单位时间内每消耗1molCO,同时生成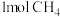
e.容器中混合气体的平均相对分子质量保持不变
(3)甲烷燃料电池装置如图,通入氧气的电极为电池的
 一端电极反应方程式为:
一端电极反应方程式为: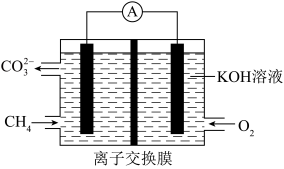
您最近一年使用:0次
【推荐1】当今,世界多国相继规划了碳达峰、碳中和的时间节点,我国提出争取2030年“碳达峰”,2060年“碳中和”。因此,研发二氧化碳利用技术、降低空气中二氧化碳含量成为热点。
(1)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
则:反应Ⅱ的ΔH2=___________ kJ·mol-1
(2)若反应II在一绝热恒容密闭容器中进行,下面能说明反应已达到平衡状态的是________ 。
a、v(CO)=v(H2O) b、总压强不变
c、平衡常数不变 d、容器内n(CO2)/n(H2O)的值保持不变
(3)①对于反应Ⅰ,不同温度对CO2的转化率及催化剂的催化效率影响如图所示,下列有关说法正确的是___________ 。

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的平衡产率增大
C.M点时平衡常数比N点时平衡常数大
D.若反应在较低的温度下进行,可以提高CO2的平衡转化率,符合勒沙特列原理
②若在2L密闭容器中充入3molH2和1molCO2只发生反应Ⅰ,250℃时反应的平衡常数K=___________ L2/mol2,若要进一步提高甲醇的体积分数,可采取的措施有___________ (写一条即可)。
(4)研究表明,在电解质水溶液中,CO2气体可被电化学还原。写出CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为___________ 。
(1)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1则:反应Ⅱ的ΔH2=
(2)若反应II在一绝热恒容密闭容器中进行,下面能说明反应已达到平衡状态的是
a、v(CO)=v(H2O) b、总压强不变
c、平衡常数不变 d、容器内n(CO2)/n(H2O)的值保持不变
(3)①对于反应Ⅰ,不同温度对CO2的转化率及催化剂的催化效率影响如图所示,下列有关说法正确的是

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的平衡产率增大
C.M点时平衡常数比N点时平衡常数大
D.若反应在较低的温度下进行,可以提高CO2的平衡转化率,符合勒沙特列原理
②若在2L密闭容器中充入3molH2和1molCO2只发生反应Ⅰ,250℃时反应的平衡常数K=
(4)研究表明,在电解质水溶液中,CO2气体可被电化学还原。写出CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
您最近一年使用:0次
【推荐2】2030年“碳达峰”、2060年实现“碳中和”的国际承诺使CO2的回收及综合利用越来越受到我国科学家的重视。请根据如下信息回答相应问题:
(1)若用CO2和H2制取甲醇,反应的能量变化如下图所示:
根据上图可知用CO2和H2制取甲醇的热化学方程式为_______ 。
(2)在2L恒容密闭容器中分别投入2molCO2和6molH2制取甲醇。温度一定时(水为气态),下列说法能说明该反应达到平衡状态的是_______。
(3)在2L恒容密闭容器a和b中分别投入2molCO2和6molH2,在不同温度下(水为气态)制取甲醇,各容器中甲醇的物质的量与时间的关系如下图所示。

①Ta_______ Tb (填“>”“<”或“=”)。若其他条件不变,改变一个条件反应由曲线b变为曲线c,则改变的条件是_______ 。
②容器b中0~10 min氢气的平均反应速率v(H2)为_______ mol·L-1·min。 用平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数。该反应达到平衡时体系的总压强为p,则容器b中反应平衡常数Kp=_______ (用含 p的计算式表示,不必化简)。
(4)一种利用光电驱动协同转化去除H2S和CO2的装置如图所示,石墨烯电极A的电极反应式为_______ 。
(1)若用CO2和H2制取甲醇,反应的能量变化如下图所示:

根据上图可知用CO2和H2制取甲醇的热化学方程式为
(2)在2L恒容密闭容器中分别投入2molCO2和6molH2制取甲醇。温度一定时(水为气态),下列说法能说明该反应达到平衡状态的是_______。
| A.混合气体的密度不再改变 | B.混合气体的压强不再改变 |
C. (CO2)=2 (CO2)=2 (H2) (H2) | D.CO2 和H2的物质的量之比不再改变 |

①Ta
②容器b中0~10 min氢气的平均反应速率v(H2)为
(4)一种利用光电驱动协同转化去除H2S和CO2的装置如图所示,石墨烯电极A的电极反应式为

您最近一年使用:0次
【推荐3】甲烷水蒸气重整和水气变换是传统的制氢方法,反应如下 :
①CH4(g)+H2O(g)⇌CO(g)+3H2 (g) △H1= 206kJ•mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2= - 4 1 kJ•mol-1
近期报道,用二氧化碳作为氧化剂和甲烷重整制氢的新反应路线如下,可生成适宜 H2/ CO 的合成气。
③CH4 (g)+CO2 (g)⇌2CO(g)+2H2(g) △H3
(1)下列措施最有利于提高反应③CH4的平衡转化率条件是______________ 。
A. 升高温度,同时对原料气进行加压 B. 降低温度,同时对原料气进行加压
C. 升高温度,同时用氩气稀释原料气 D. 降低温度,同时用氩气稀释原料气
(2)重整反应器中以上三个反应都在发生,不同反应条件下达到平衡时的进程如下:

I.根据图1,在_________ ( 填写反应条件)时CO2的转化率为负值,主要原因:一是 CO2稳定性较高,低浓度时难以和甲烷反应;二是 ___________ 。
II.根据图,2随着反应温度和反应物中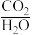 的提高,体系中反应
的提高,体系中反应____ 填①、②、③)逐渐占据主导。若 850℃、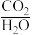 为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=
为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=__ 。
(3)固体氧化物电解池(传导O2-)将CO2和H2O 转化为n(H2):n(CO)=1的合成气并联产高纯度O2,写出电解池阴极反应式__________________ 。
①CH4(g)+H2O(g)⇌CO(g)+3H2 (g) △H1= 206kJ•mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2= - 4 1 kJ•mol-1
近期报道,用二氧化碳作为氧化剂和甲烷重整制氢的新反应路线如下,可生成适宜 H2/ CO 的合成气。
③CH4 (g)+CO2 (g)⇌2CO(g)+2H2(g) △H3
(1)下列措施最有利于提高反应③CH4的平衡转化率条件是
A. 升高温度,同时对原料气进行加压 B. 降低温度,同时对原料气进行加压
C. 升高温度,同时用氩气稀释原料气 D. 降低温度,同时用氩气稀释原料气
(2)重整反应器中以上三个反应都在发生,不同反应条件下达到平衡时的进程如下:

I.根据图1,在
II.根据图,2随着反应温度和反应物中
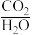 的提高,体系中反应
的提高,体系中反应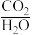 为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=
为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=(3)固体氧化物电解池(传导O2-)将CO2和H2O 转化为n(H2):n(CO)=1的合成气并联产高纯度O2,写出电解池阴极反应式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】电解精炼铜的阳极泥中含有 、
、 、
、 、
、 、
、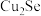 、
、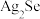 、
、 等,从其中提取
等,从其中提取 、
、 、
、 、
、 的单质的流程如图所示,回答下列问题:
的单质的流程如图所示,回答下列问题:
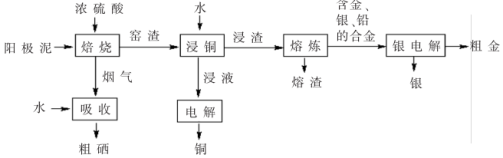
(1)粗铜中含有 、
、 两种元素的单质,但在阳极泥中几乎检测不到,原因是
两种元素的单质,但在阳极泥中几乎检测不到,原因是___________ 。
(2)已知阳极泥进行“硫酸化(隔绝空气)焙烧”,烟气中含有 ,
, 等。
等。
①写出“焙烧”过程中 与浓硫酸反应的化学方程式:
与浓硫酸反应的化学方程式:___________ 。
②将 、
、 通入水中即可生成单质硒,该反应的离子方程式为
通入水中即可生成单质硒,该反应的离子方程式为___________ 。
③实验室中将粗硒从溶液中分离出来的操作为___________ 。
(3)用惰性电极电解“浸液”时,溶液中发生的总反应离子方程式为___________ 。
(4)“银电解”时,阳极材料是___________ 。
(5)上述流程中,可以循环利用的物质是___________ (填写化学式)。
 、
、 、
、 、
、 、
、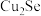 、
、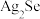 、
、 等,从其中提取
等,从其中提取 、
、 、
、 、
、 的单质的流程如图所示,回答下列问题:
的单质的流程如图所示,回答下列问题:
(1)粗铜中含有
 、
、 两种元素的单质,但在阳极泥中几乎检测不到,原因是
两种元素的单质,但在阳极泥中几乎检测不到,原因是(2)已知阳极泥进行“硫酸化(隔绝空气)焙烧”,烟气中含有
 ,
, 等。
等。①写出“焙烧”过程中
 与浓硫酸反应的化学方程式:
与浓硫酸反应的化学方程式:②将
 、
、 通入水中即可生成单质硒,该反应的离子方程式为
通入水中即可生成单质硒,该反应的离子方程式为③实验室中将粗硒从溶液中分离出来的操作为
(3)用惰性电极电解“浸液”时,溶液中发生的总反应离子方程式为
(4)“银电解”时,阳极材料是
(5)上述流程中,可以循环利用的物质是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】某工厂从含硫酸钡、氧化铜、氧化亚铁、氧化铝和少量氧化银的废渣中回收金属的工艺流程如图所示:

(1)滤渣①的化学式为___________ ,是___________ (填“强”“弱”或“非”)电解质。
(2)用滤渣②作粗铜电解精炼铜时,粗铜作___________ (填“阳”或“阴”)极。
(3)加入过量铁粉,被还原的金属阳离子有___________ 。过氧化钠的电子式为___________ 。
(4)滤液④的溶质是___________ 。B电解方程式为___________ 。
(5)写出滤渣③生成A的化学方程式:___________ 。

(1)滤渣①的化学式为
(2)用滤渣②作粗铜电解精炼铜时,粗铜作
(3)加入过量铁粉,被还原的金属阳离子有
(4)滤液④的溶质是
(5)写出滤渣③生成A的化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜(甲醚具有可燃性,是一种常用的燃料)。
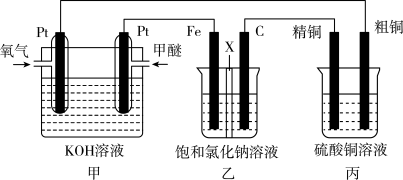
根据要求回答相关问题
(1)装置甲中通入燃料甲醚的一极是________ (填“正极”或“负极”),写出正极的电极反应式:________ 。
(2)装置乙中Fe为________ 极(填“阳极”或“阴极”),石墨电极(C)的电极反应式为:________ 。
(3)如果粗铜中含有锌、银等杂质,丙装置的阳极泥中含有________ ,反应一段时间后,硫酸铜溶液浓度将________ (填“增大”、“减小”或“不变”)。
(4)当装置甲中消耗0.05mol O2时,装置乙中溶液的pH为________ (溶液体积为200mL不变)。

根据要求回答相关问题
(1)装置甲中通入燃料甲醚的一极是
(2)装置乙中Fe为
(3)如果粗铜中含有锌、银等杂质,丙装置的阳极泥中含有
(4)当装置甲中消耗0.05mol O2时,装置乙中溶液的pH为
您最近一年使用:0次



