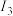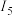A、B、C、D、E是元素周期表中五种常见元素,其原子序数依次增大。详细信息见表:
请回答下列问题:
(1)D的价电子排布式可表示为__ 。
(2)BC3-的空间构型为__ (用文字描述)。
(3)根据等电子原理,AC分子的结构式为__ 。
(4)1molAC2中σ键、π键数目之比为__ 。
(5)A、B、C的第一电离能由大到小顺序为__ 。
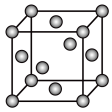
(6)E为__ 堆积金属,已知E原子的半径为acm,阿伏加 德罗常数的值为NA,则E晶体的密度是__ g·cm-3。(列出算式即可)。
(7)E晶胞结构如图所示,E晶体中每个E原子周围距离最近的E原子数目为__ ;E2S为半导体材料,在其立方晶胞内部有4个S原子,其余S原子位于面心和顶点,则该晶胞中有__ 个E原子。
(8)将E单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,写出该反应的离子方程式__ 。
| ① | A的一种核素在考古时常用来鉴定一些文物的年代 |
| ② | B的氧化物是导致光化学烟雾的主要物质之一 |
| ③ | C的某一种单质是空气的主要成分之一 |
| ④ | D的基态原子核外有6个原子轨道处于半充满状态 |
| ⑤ | E能形成红色的E2O和黑色的EO两种氧化物 |
(1)D的价电子排布式可表示为
(2)BC3-的空间构型为
(3)根据等电子原理,AC分子的结构式为
(4)1molAC2中σ键、π键数目之比为
(5)A、B、C的第一电离能由大到小顺序为
(6)E为
(7)E晶胞结构如图所示,E晶体中每个E原子周围距离最近的E原子数目为

(8)将E单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,写出该反应的离子方程式
更新时间:2020-03-15 11:22:33
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】金、银、铜、铁、铝和钛均是人类大量生产和使用的金属。试回答与上述金属原子结构有关的问题。
(1)上述金属中属于主族元素的有_______ 。
(2)钛被称为继铁、铝之后的第三金属。基态钛原子价电子的轨道表示式为_______ 。Ti元素形成的化合物中,Ti呈现的最高价态为_______ 价。
(3)基态金原子的价电子排布式为5d106s1,试判断金在元素周期表中位于第_______ 周期第_______ 族。
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因:_______ 。
(1)上述金属中属于主族元素的有
(2)钛被称为继铁、铝之后的第三金属。基态钛原子价电子的轨道表示式为
(3)基态金原子的价电子排布式为5d106s1,试判断金在元素周期表中位于第
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铁、钛、镍等过渡元素在工业生产和科学研究中具有重要作用,请回答下列问题。
(1)有机铁肥[Fe(H2NCONH2)6](NO3)3的名称叫三硝酸六尿素合铁,是一种配合物,它的中心离子Fe3+的价电子排布式为___________ ;它所含非金属元素的电负性由小到大的顺序是___________ 。
(2)钛被称为继铁、铝之后的“第三金属”,也叫“未来金属”。
①钛位于周期表的___________ 区,基态Ti原子的电子占据了___________ 个原子轨道。
②工业上可用TiCl4(常温下呈液态)与Mg高温下反应制备钛单质,同时生成MgCl2,详细解释TiCl4熔点比MgCl2低很多的原因:___________ 。
(3)镍与CO生成的配合物Ni(CO)4中,易提供孤电子对的成键原子是_____ (填元素名称);1 mol Ni(CO)4中含有的σ键数目为___________ ;写出与CO互为等电子体的一种阴离子的化学式___________ 。
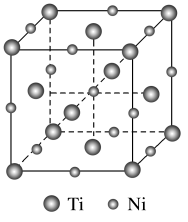
(4)镍钛记忆合金用于飞机和宇宙飞船。已知一种镍钛合金的晶胞结构如图所示,其中Ti原子采用面心立方最密堆积方式,该合金中与Ti原子距离最近且相等的Ni原子个数为___________ ;若合金的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是___________ pm(用含ρ和NA的计算式表示,不必化简)。
(1)有机铁肥[Fe(H2NCONH2)6](NO3)3的名称叫三硝酸六尿素合铁,是一种配合物,它的中心离子Fe3+的价电子排布式为
(2)钛被称为继铁、铝之后的“第三金属”,也叫“未来金属”。
①钛位于周期表的
②工业上可用TiCl4(常温下呈液态)与Mg高温下反应制备钛单质,同时生成MgCl2,详细解释TiCl4熔点比MgCl2低很多的原因:
(3)镍与CO生成的配合物Ni(CO)4中,易提供孤电子对的成键原子是
(4)镍钛记忆合金用于飞机和宇宙飞船。已知一种镍钛合金的晶胞结构如图所示,其中Ti原子采用面心立方最密堆积方式,该合金中与Ti原子距离最近且相等的Ni原子个数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:
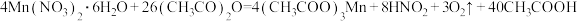 。
。
(1)Mn3+基态价层电子排布图为________ 。
(2)Mn(NO3)2·6H2O中非金属元素第一电离能从大到小的顺序________ 。从电子云重叠的方式看N中存在的化学键类型有________ 。
(3)与NO 互为等电子体的一种分子的化学式为
互为等电子体的一种分子的化学式为________ 。
(4)1molCH3COOH中含有的σ键数目为________ 。CH3COOH分子通过氢键形成环状二聚物,写出含氢键表示的环状二聚物的结构简式________ 。
(5)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为________ 。镁铝合金密度为ρg/cm3,则该晶胞的边长为________ nm(阿伏加德罗常数的值为NA)。

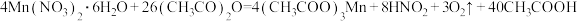 。
。(1)Mn3+基态价层电子排布图为
(2)Mn(NO3)2·6H2O中非金属元素第一电离能从大到小的顺序
(3)与NO
 互为等电子体的一种分子的化学式为
互为等电子体的一种分子的化学式为(4)1molCH3COOH中含有的σ键数目为
(5)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】已知W、X、Y、Z、M、N是原子序数依次递增的前四周期元素。其元素性质或原子结构特征如下:
请回答下列问题:
(1)元素M的核外电子排布式为__________ ;元素N的价层电子的轨道表示式为__________ 。
(2)化合物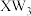 的VSEPR模型名称为
的VSEPR模型名称为__________ ,
(3)元素W和Y可以形成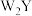 、
、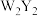 、
、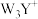 等微粒。
等微粒。
①下列说法不正确的是__________ 。
A.物质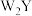 难以分解,主要是因为分子间存在氢键
难以分解,主要是因为分子间存在氢键
B.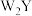 的空间结构为直线型
的空间结构为直线型
C.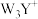 的中心原子采用
的中心原子采用 杂化
杂化
D.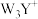 中W—Y—W键角比
中W—Y—W键角比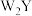 中的大
中的大
②物质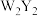 能与水混溶,却不溶于
能与水混溶,却不溶于 ,原因是
,原因是__________ 。
(4)下表是W—N元素中某种元素的部分电离能,由此可判断该元素是__________ 。
元素 | 元素性质或原子结构特征 |
W | 是宇宙中含量最多的元素 |
X | 元素原子最高能级的不同轨道都有电子,且自旋方向相同 |
Y | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都低于同周期相邻元素 |
Z | 价层电子数等于其电子层数 |
M | 其价电子中,在不同形状的原子轨道中运动的电子数相等 |
N | 核电荷数为25 |
(1)元素M的核外电子排布式为
(2)化合物
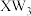 的VSEPR模型名称为
的VSEPR模型名称为(3)元素W和Y可以形成
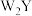 、
、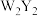 、
、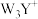 等微粒。
等微粒。①下列说法不正确的是
A.物质
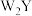 难以分解,主要是因为分子间存在氢键
难以分解,主要是因为分子间存在氢键B.
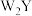 的空间结构为直线型
的空间结构为直线型C.
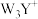 的中心原子采用
的中心原子采用 杂化
杂化D.
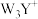 中W—Y—W键角比
中W—Y—W键角比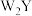 中的大
中的大②物质
 能与水混溶,却不溶于
能与水混溶,却不溶于 ,原因是
,原因是(4)下表是W—N元素中某种元素的部分电离能,由此可判断该元素是
元素 | 电离能/(kJ/mol) | ||||
|
|
|
|
| |
某种元素 | 578 | 1817 | 2745 | 11575 | 14830 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】氮化镓(GaN)材料是第三代半导体的代表,通常以GaCl3为镓源,NH3为氮源制备,具有出色的抗击穿能力,能耐受更高的电子密度。
(1)基态Ga价电子排布图为___________ 。
(2)Ga、N和O的第一电离能由小到大的顺序为___________ ,NO 的空间构型为
的空间构型为___________ ,与其互为等电子体的微粒有___________ (任写一种)
(3)GaCl3熔点为77.9℃,气体在270℃左右以二聚物存在,GaF3熔点1000℃,GaCl3二聚体的结构式为___________ ,其熔点低于GaF3的原因为___________ 。
(4)与镓同主族的B具有缺电子性,硼砂(四硼酸钠Na2B4O7·10H2O)中B4O 是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应写成[B4O5(OH)4]2-的形式,结构如图所示,则该离子存在的作用力有
是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应写成[B4O5(OH)4]2-的形式,结构如图所示,则该离子存在的作用力有___________ ,B原子的杂化方式为___________ 。
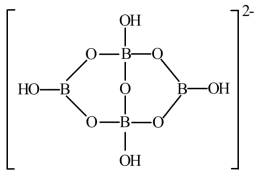
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键 F.配位键
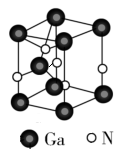
(5)氮化镓的晶胞如图所示,Ga原子与N原子半径分别为a pm和b pm,阿伏加德罗常数的值为NA,晶胞密度为c g/cm3,则该晶胞的空间利用率为___________ (已知空间利用率为晶胞内原子体积占晶胞体积的百分比)。
(1)基态Ga价电子排布图为
(2)Ga、N和O的第一电离能由小到大的顺序为
 的空间构型为
的空间构型为(3)GaCl3熔点为77.9℃,气体在270℃左右以二聚物存在,GaF3熔点1000℃,GaCl3二聚体的结构式为
(4)与镓同主族的B具有缺电子性,硼砂(四硼酸钠Na2B4O7·10H2O)中B4O
 是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应写成[B4O5(OH)4]2-的形式,结构如图所示,则该离子存在的作用力有
是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应写成[B4O5(OH)4]2-的形式,结构如图所示,则该离子存在的作用力有
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键 F.配位键
(5)氮化镓的晶胞如图所示,Ga原子与N原子半径分别为a pm和b pm,阿伏加德罗常数的值为NA,晶胞密度为c g/cm3,则该晶胞的空间利用率为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为_____________ ,CO有多种等电子体,其中常见的一种分子是__________ 。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有_____ 个δ键,C原子的杂化方式为__________ 。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是__________ ,形成的化学键是___________ 。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
写出A原子的电子排布图_______________ ,Al原子的第一电离能_____ (填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是_________________ 。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】2020年1月9日,南京大学物理学院高力波教授团队,探索出了一种可控生长超平整石墨烯的方法,该方法有望推广到新材料、新能源等重要研究领域。
(1)如图图1和图2所示,科学家可以用特殊的胶带将石墨不断地粘撕得到石墨烯,是因为___ 。

(2)石墨烯中碳原子的杂化方式为___ ,12g石墨烯中含有___ 个如图所示的六元环。
(3)石墨晶体中碳碳键的键长___ 金刚石晶体中碳碳键的键长(填“>”“<”或“=”),原因是___ 。
(4)如图图2和图3中,石墨烯转化为氧化石墨烯时,1号C与其相邻C原子间键能的变化是___ (填“变大”、“变小”、“不变”)。
(5)曹原等研制得了具有超导特性的双层石墨烯新材料,手机一旦装上石墨烯电池,充电时间将被缩短为16分钟。将石墨烯逐层叠起来就是石墨,如图图4是石墨晶体的六方晶胞结构。
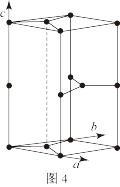

①在下列四边形内画出石墨晶胞沿c轴的投影___ (用“”标出碳原子位置)。
②如果石墨晶胞中最近的两个碳原子之间的距离为apm,层间距为bpm,那么石墨晶体的密度为___ g·cm-3(列出计算式即可))。
(1)如图图1和图2所示,科学家可以用特殊的胶带将石墨不断地粘撕得到石墨烯,是因为

(2)石墨烯中碳原子的杂化方式为
(3)石墨晶体中碳碳键的键长
(4)如图图2和图3中,石墨烯转化为氧化石墨烯时,1号C与其相邻C原子间键能的变化是
(5)曹原等研制得了具有超导特性的双层石墨烯新材料,手机一旦装上石墨烯电池,充电时间将被缩短为16分钟。将石墨烯逐层叠起来就是石墨,如图图4是石墨晶体的六方晶胞结构。


①在下列四边形内画出石墨晶胞沿c轴的投影
②如果石墨晶胞中最近的两个碳原子之间的距离为apm,层间距为bpm,那么石墨晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
(1)F2通入稀NaOH溶液中可生成OF2,OF2空间结构为___________ 。
(2)在BF3分子中B原子的杂化轨道类型为___________ 。
(3)钠在火焰上灼烧产生的黄光是一种___________ (填字母)。
A.吸收光谱 B.发射光谱
(4)已知(CN)2是直线形分子,且有对称性,其中π键与σ键的个数比为___________ 。
(5)基态S原子价电子排布式___________ ;S原子的核外电子运动状态有___________ 种。
(1)F2通入稀NaOH溶液中可生成OF2,OF2空间结构为
(2)在BF3分子中B原子的杂化轨道类型为
(3)钠在火焰上灼烧产生的黄光是一种
A.吸收光谱 B.发射光谱
(4)已知(CN)2是直线形分子,且有对称性,其中π键与σ键的个数比为
(5)基态S原子价电子排布式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】碳、氟、钛及其化合物用途非常广泛,回答下列问题:
(1)氢氟酸需贮存在聚四氟乙烯容器中。聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______ 方法区分晶体、准晶体和非晶体。
(2)CO2分子中σ键、π键数目之比为_____ ,与CO2互为等电子体的离子的化学式为______ (只写一种)。
(3)下图是邻羟基苯甲酸和对羟基苯甲酸的结构简式,已知它们的沸点相差很大,其沸点较高的是_______ ,原因是_______ 。

(4) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。
① 由
由 和
和 构成,
构成, 的空间构型是
的空间构型是_______
② 熔点是-25℃,沸点136.4℃,可溶于苯或
熔点是-25℃,沸点136.4℃,可溶于苯或 ,该晶体属于
,该晶体属于_______ 晶体。
(5) 在冶金、化工和建材等行业用途广泛,晶胞结构如图所示,其边长为bnm,
在冶金、化工和建材等行业用途广泛,晶胞结构如图所示,其边长为bnm, 代表阿伏加德罗常数的值。
代表阿伏加德罗常数的值。

已知1号原子的坐标为(0,0,0),3号原子的坐标为(1,1,1),则2号原子的坐标为_______ ; 在晶胞中的配位数是
在晶胞中的配位数是_______ ,该晶体密度_______  (用含b、
(用含b、 的代数式表示)。
的代数式表示)。
(1)氢氟酸需贮存在聚四氟乙烯容器中。聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)CO2分子中σ键、π键数目之比为
(3)下图是邻羟基苯甲酸和对羟基苯甲酸的结构简式,已知它们的沸点相差很大,其沸点较高的是

(4)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。①
 由
由 和
和 构成,
构成, 的空间构型是
的空间构型是②
 熔点是-25℃,沸点136.4℃,可溶于苯或
熔点是-25℃,沸点136.4℃,可溶于苯或 ,该晶体属于
,该晶体属于(5)
 在冶金、化工和建材等行业用途广泛,晶胞结构如图所示,其边长为bnm,
在冶金、化工和建材等行业用途广泛,晶胞结构如图所示,其边长为bnm, 代表阿伏加德罗常数的值。
代表阿伏加德罗常数的值。
已知1号原子的坐标为(0,0,0),3号原子的坐标为(1,1,1),则2号原子的坐标为
 在晶胞中的配位数是
在晶胞中的配位数是 (用含b、
(用含b、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】利用铜萃取剂M,通过如下反应实现铜离子的富集:
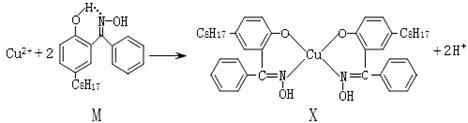
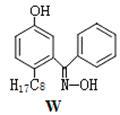
(1)X难溶于水、易溶于有机溶剂,其晶体类型为________ 晶体。
(2)X中非金属元素原子的第一电离能由大到小顺序为____ 。其中第一电离能最大的原子的杂化方式分别为_____
(3)上述反应中断裂和生成的化学键有______ (填序号)。
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是____________________________ 。
(5)如图为碳化硅的晶胞(其中●为碳原子,○为硅原子)。

①三个碳原子和三个硅原子相间构成一个_____ 式(船、椅)六元环。
②如果我们以一个硅原子为中心,则与硅原子次近的第二层有_______ 个原子。
③已知:碳原子半径为a×10-8cm,硅子半径为b×10-8cm,假设碳、硅原子是刚性小球,在晶体中彼此相切,计算碳化硅晶体的密度为____ g/cm3(只要求列出算式),查表知该密度比实测值偏小,其原因可能是 _________________________________________ 。


(1)X难溶于水、易溶于有机溶剂,其晶体类型为
(2)X中非金属元素原子的第一电离能由大到小顺序为
(3)上述反应中断裂和生成的化学键有
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是
(5)如图为碳化硅的晶胞(其中●为碳原子,○为硅原子)。

①三个碳原子和三个硅原子相间构成一个
②如果我们以一个硅原子为中心,则与硅原子次近的第二层有
③已知:碳原子半径为a×10-8cm,硅子半径为b×10-8cm,假设碳、硅原子是刚性小球,在晶体中彼此相切,计算碳化硅晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】5月15日,天问一号探测器成功着陆于火星。据了解火星上存在大量的含氮化合物,科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。请回答下列问题:
(1)邻氨基吡啶( )的铜配合物在有机不对称合成中起催化诱导效应。
)的铜配合物在有机不对称合成中起催化诱导效应。
①邻氨基吡啶中所有元素的电负性由小到大的顺序为_______ (填元素符号)。设NA为阿伏加德罗常数的值,1mol 中含有σ键的数目为
中含有σ键的数目为_______ 。
②一定条件下-NH2可以被氧化成-NO2,-NO2中N原子的杂化方式为_______ 杂化。
(2)第四周期的某主族元素,其第一至第五电离能数据如图所示,则该元素的基态原子电子排布式为_______ 。

(3)元素周期表中的第IVA族~第VIIA族中部分元素的最简单氢化物的沸点变化趋势线如图,其中一个小黑点代表一种氢化物,则趋势线a代表第_______ 族元素的最简单氢化物的沸点变化趋势,判断依据是_______ 。

(4)一种嘌呤和一种吡啶的结构如图。

①嘌呤中轨道之间的夹角∠1比∠2大,原因是_______ 。
②分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为_______ 。
(5)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图所示。若该晶体密度为dgcm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=_______ nm(写出代数式)。

(1)邻氨基吡啶(
 )的铜配合物在有机不对称合成中起催化诱导效应。
)的铜配合物在有机不对称合成中起催化诱导效应。①邻氨基吡啶中所有元素的电负性由小到大的顺序为
 中含有σ键的数目为
中含有σ键的数目为②一定条件下-NH2可以被氧化成-NO2,-NO2中N原子的杂化方式为
(2)第四周期的某主族元素,其第一至第五电离能数据如图所示,则该元素的基态原子电子排布式为

(3)元素周期表中的第IVA族~第VIIA族中部分元素的最简单氢化物的沸点变化趋势线如图,其中一个小黑点代表一种氢化物,则趋势线a代表第

(4)一种嘌呤和一种吡啶的结构如图。

①嘌呤中轨道之间的夹角∠1比∠2大,原因是
②分子中的大π键可以用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为(5)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图所示。若该晶体密度为dgcm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】 为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Q的价电子排布式为_______ 。
(2) 形成的有机物
形成的有机物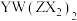 中Y、Z的杂化轨道类型分别为
中Y、Z的杂化轨道类型分别为_____ , 离子的立体构型是
离子的立体构型是_________ 。
(3)Y、R的最高价氧化物的沸点较高的是_________ (填化学式),原因是_______ 。
(4)将Q单质的粉末加入 的浓溶液中,并通入
的浓溶液中,并通入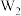 ,充分反应后溶液呈深蓝色,该反应的离子方程式为
,充分反应后溶液呈深蓝色,该反应的离子方程式为_________ 。
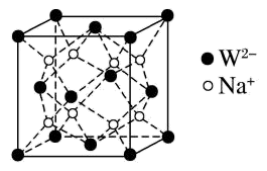
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为________ (填化学式)。 的配位数为
的配位数为_______ ,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为________ 。已知该晶胞的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 则两个最近的W离子间距离为
则两个最近的W离子间距离为______ nm(用含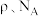 的计算式表示)。
的计算式表示)。
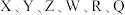 为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:(1)Q的价电子排布式为
(2)
 形成的有机物
形成的有机物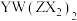 中Y、Z的杂化轨道类型分别为
中Y、Z的杂化轨道类型分别为 离子的立体构型是
离子的立体构型是(3)Y、R的最高价氧化物的沸点较高的是
(4)将Q单质的粉末加入
 的浓溶液中,并通入
的浓溶液中,并通入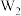 ,充分反应后溶液呈深蓝色,该反应的离子方程式为
,充分反应后溶液呈深蓝色,该反应的离子方程式为(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为
 的配位数为
的配位数为 ,阿伏加德罗常数为
,阿伏加德罗常数为 则两个最近的W离子间距离为
则两个最近的W离子间距离为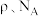 的计算式表示)。
的计算式表示)。
您最近一年使用:0次