氯及其化合物在日常生活中有广泛应用。漂白液通常用于家庭和公共场所的消毒,某品牌漂白液的包装说明如下:
(1)该漂白液中,NaClO的物质的量浓度约为___ mol·L-1。
(2)使用NaOH溶液和氯气来制取消毒液,写出该反应的离子方程式___ ,制取500mL此漂白液,需要5.0mol·L-1的NaOH溶液___ mL。
(3)漂白液易吸收空气中的CO2而生成NaHCO3,写出有关的化学方程式___ 。
| 净含量:500mL 密度:1.12g·cm-3 主要成分:7.45%NaClO 使用方法:稀释100倍(体积比)后使用 注意事项:密封保存,易吸收空气中的CO2变质 |
(1)该漂白液中,NaClO的物质的量浓度约为
(2)使用NaOH溶液和氯气来制取消毒液,写出该反应的离子方程式
(3)漂白液易吸收空气中的CO2而生成NaHCO3,写出有关的化学方程式
更新时间:2020-04-03 18:17:53
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。在NaOH溶液中ClO2与H2O2反应可以得到亚氯酸钠,化学反应方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O。
(1)ClO2中氯元素的化合价是_______ ;在制备亚氯酸钠的反应中ClO2作_______ (填“氧化剂”或“还原剂”)。
(2)若反应中生成1molNaClO2,转移电子的物质的量为_______ 。
(3)在一定条件下,将Cl2通入填充有固体NaClO2的反应柱内,二者反应可制得ClO2.ClO2作_______ (填“氧化产物”或“还原产物”),当消耗标准状况下1.12LCl2时,制得ClO2_______ g。
(1)ClO2中氯元素的化合价是
(2)若反应中生成1molNaClO2,转移电子的物质的量为
(3)在一定条件下,将Cl2通入填充有固体NaClO2的反应柱内,二者反应可制得ClO2.ClO2作
您最近一年使用:0次
【推荐2】氧化还原反应的本质是电子的转移,请回答下列有关氧化还原反应的问题。
(1)配平下列氧化还原反应方程式,并标出单线桥:
①_____________  H2S +
H2S +  HNO3(稀) =
HNO3(稀) =  H2O +
H2O +  S↓+
S↓+  NO↑
NO↑
②_____________  NH3 +
NH3 +  O2 =
O2 =  NO +
NO +  H2O
H2O
③_____________  KClO3 +
KClO3 +  HCl(浓)=
HCl(浓)=  KCl+
KCl+  Cl2↑+
Cl2↑+  H2O
H2O
④_____________  Cu +
Cu +  HNO3 (稀) =
HNO3 (稀) =  Cu(NO3)2 +
Cu(NO3)2 +  NO↑+
NO↑+  H2O
H2O
(2)已知:①Cl2+2Fe2+=2Cl-+2Fe3+;②Cl2+2I-=2Cl-+I2,并且I-还原性比Fe2+强,往100 mL 0.2 mol·L-1的FeI2溶液中通入一定体积的Cl2。充分反应后,若溶液中有50%的Fe2+被氧化,则通入的氯气的体积(标准状况)是__________ 。若通入的是足量氯气,总反应的离子方程式为_______________ 。
(3)火药是中国的四大发明之一,永远值得华夏儿女骄傲。黑火药在发生爆炸时,发生如下反应: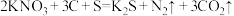 。其中作氧化剂的是
。其中作氧化剂的是___________ (填化学式)。每生成2mol气体,转移_______________ mol电子。
(4)工业盐的主要成分是 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其中毒原因是
而中毒的事件,其中毒原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有_______ 性。工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有______ 性。
(1)配平下列氧化还原反应方程式,并标出单线桥:
①
 H2S +
H2S +  HNO3(稀) =
HNO3(稀) =  H2O +
H2O +  S↓+
S↓+  NO↑
NO↑②
 NH3 +
NH3 +  O2 =
O2 =  NO +
NO +  H2O
H2O③
 KClO3 +
KClO3 +  HCl(浓)=
HCl(浓)=  KCl+
KCl+  Cl2↑+
Cl2↑+  H2O
H2O④
 Cu +
Cu +  HNO3 (稀) =
HNO3 (稀) =  Cu(NO3)2 +
Cu(NO3)2 +  NO↑+
NO↑+  H2O
H2O(2)已知:①Cl2+2Fe2+=2Cl-+2Fe3+;②Cl2+2I-=2Cl-+I2,并且I-还原性比Fe2+强,往100 mL 0.2 mol·L-1的FeI2溶液中通入一定体积的Cl2。充分反应后,若溶液中有50%的Fe2+被氧化,则通入的氯气的体积(标准状况)是
(3)火药是中国的四大发明之一,永远值得华夏儿女骄傲。黑火药在发生爆炸时,发生如下反应:
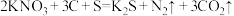 。其中作氧化剂的是
。其中作氧化剂的是(4)工业盐的主要成分是
 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其中毒原因是
而中毒的事件,其中毒原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为_______ mol·L-1。
(2)该同学参阅该“84消毒液”的配方,欲用NaCIO固体配制480mL含NaCIO质量分数为25%的消毒液。下列说法正确的是_______。
(3)84消毒液与洁厕灵(主要成分是盐酸)混合后使用,就会对人体产生严重的危害,发生的反应如下: ,取100mL上述稀释过的84消毒液与足量洁厕灵混合,产生氯气的体积在标准状况下约为
,取100mL上述稀释过的84消毒液与足量洁厕灵混合,产生氯气的体积在标准状况下约为_______ L(保留两位有效数字)。
(4)写出与Cl-具有相同电子数的正离子、负离子、分子各一种:_______ 、_______ 、_______ 。
| 84消毒液 有效成分:NaClO 规格:1000mL 质量分数:25% 密度:1.192g·cm-3 |
(2)该同学参阅该“84消毒液”的配方,欲用NaCIO固体配制480mL含NaCIO质量分数为25%的消毒液。下列说法正确的是_______。
| A.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 |
| B.需要称量NaClO固体的质量为149.0g |
| C.将NaCIO固体于烧杯中溶解后,应立即将溶液转移到容量瓶中 |
| D.配制好的溶液可置于容量瓶中保存 |
 ,取100mL上述稀释过的84消毒液与足量洁厕灵混合,产生氯气的体积在标准状况下约为
,取100mL上述稀释过的84消毒液与足量洁厕灵混合,产生氯气的体积在标准状况下约为(4)写出与Cl-具有相同电子数的正离子、负离子、分子各一种:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】现有下列9种物质,① ②淀粉溶液③
②淀粉溶液③ ④
④ ⑤
⑤ ⑥
⑥ ⑦纯醋酸⑧
⑦纯醋酸⑧ 溶液⑨
溶液⑨ ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
(1)以上能发生丁达尔效应的是_______ 。
(2)属于电解质的是_______ (填写序号)
(3)标准状况下,相同体积的④ 和⑤
和⑤ 原子个数之比为
原子个数之比为_______ ,标准状况下,若 和
和 混合气体相对于氢气的密度为14.5,则④和⑤物质的量之比为
混合气体相对于氢气的密度为14.5,则④和⑤物质的量之比为_______ ,标准状况下,V L 溶入100 mL
溶入100 mL  (1 g/mL)中,溶液密度为ρ g/mL,则氨水物质的量浓度表达式为
(1 g/mL)中,溶液密度为ρ g/mL,则氨水物质的量浓度表达式为_______ mol/L。
 ②淀粉溶液③
②淀粉溶液③ ④
④ ⑤
⑤ ⑥
⑥ ⑦纯醋酸⑧
⑦纯醋酸⑧ 溶液⑨
溶液⑨ ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:(1)以上能发生丁达尔效应的是
(2)属于电解质的是
(3)标准状况下,相同体积的④
 和⑤
和⑤ 原子个数之比为
原子个数之比为 和
和 混合气体相对于氢气的密度为14.5,则④和⑤物质的量之比为
混合气体相对于氢气的密度为14.5,则④和⑤物质的量之比为 溶入100 mL
溶入100 mL  (1 g/mL)中,溶液密度为ρ g/mL,则氨水物质的量浓度表达式为
(1 g/mL)中,溶液密度为ρ g/mL,则氨水物质的量浓度表达式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】填空。
(1)标准状况下,1.7gNH3与_______ L H2S气体含有的氢原子数相同。
(2)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、 ,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol/L、0.25mol/L、0.4mol/L,则c(
,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol/L、0.25mol/L、0.4mol/L,则c( )=
)=_______ mol/L。
(3)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中含溶质的物质的量浓度之比为_______ 。
(4)标准状况下,NH3与CH4组成的混合气体的平均密度为0. 75g/L,该混合气体的平均摩尔质量为_______ g/mol。
(5)VmLAl2(SO4)3溶液中含Al3+ ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中 的物质的量浓度是
的物质的量浓度是_______ mol/L。
(1)标准状况下,1.7gNH3与
(2)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、
 ,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol/L、0.25mol/L、0.4mol/L,则c(
,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol/L、0.25mol/L、0.4mol/L,则c( )=
)=(3)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中含溶质的物质的量浓度之比为
(4)标准状况下,NH3与CH4组成的混合气体的平均密度为0. 75g/L,该混合气体的平均摩尔质量为
(5)VmLAl2(SO4)3溶液中含Al3+ ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中
 的物质的量浓度是
的物质的量浓度是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】完成下列问题。
(1)氯气可直接用于自来水的消毒,氯气通入水中可用来杀菌消毒,其中杀菌消毒的物质是___________ (填化学式);用少量氯气消毒的自来水养金鱼时,通常需要先将自来水晒一晒,其原因是___________ (用化学方程式表示)。
(2)氯气可用来制取漂白粉,但干燥的氢氧化钙与氯气并不易发生反应,氯气只能被氢氧化钙所吸附。为此,在工业上采用加入少许水的消石灰来进行氯化,其原因是___________ ;漂白粉也能用于消毒,其有效成分生效的化学方程是___________ 。
(1)氯气可直接用于自来水的消毒,氯气通入水中可用来杀菌消毒,其中杀菌消毒的物质是
(2)氯气可用来制取漂白粉,但干燥的氢氧化钙与氯气并不易发生反应,氯气只能被氢氧化钙所吸附。为此,在工业上采用加入少许水的消石灰来进行氯化,其原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】按要求书写化学方程式或离子方程式。
(1)工业上用将氯气通入石灰乳中制漂白粉,相应的化学方程式为___________ 。
(2)硫酸厂附近的新收集雨水pH不断降低,相应的化学方程式为___________ 。
(3)木炭和浓硫酸混合加热产生大量的CO2和SO2,相应的化学方程式为___________ 。
(4)工业上用FeCl3溶液腐蚀铜线路板,相应的离子 方程式为___________ 。
(5)SO2能使氯水褪色,相应的离子 方程式为___________ 。
(1)工业上用将氯气通入石灰乳中制漂白粉,相应的化学方程式为
(2)硫酸厂附近的新收集雨水pH不断降低,相应的化学方程式为
(3)木炭和浓硫酸混合加热产生大量的CO2和SO2,相应的化学方程式为
(4)工业上用FeCl3溶液腐蚀铜线路板,相应的
(5)SO2能使氯水褪色,相应的
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】氯水中含有多种成分,因而具有多种性质,根据新制氯水(a)分别与图四种物质发生的反应填空(b、c、d、e 中重合部分代表物质间反应, 且氯水足量)。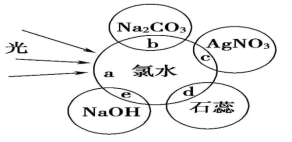
(1)能证明氯水具有漂白性的是______________ (填“b”“c”“d”或“e”)。
(2)c 过程中的现象是______ 。实验 室处理尾气氯气的化学方程式为_________
(3)久置的氯水变为______ , 用化学反应方程式表示为_____________ 。
(4)漂白粉的漂白原理_________ 。

(1)能证明氯水具有漂白性的是
(2)c 过程中的现象是
(3)久置的氯水变为
(4)漂白粉的漂白原理
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】除去下列物质中所混有的少量杂质,括号内为杂质。指明应加入的试剂,写出有关方程式。
(1)Fe粉(Al粉):试剂___ 离子方程式___ ;
(2)FeCl2溶液(FeCl3):试剂___ 离子方程式___ ;
(3)Na2CO3固体(NaHCO3):化学方程式___ 。
(1)Fe粉(Al粉):试剂
(2)FeCl2溶液(FeCl3):试剂
(3)Na2CO3固体(NaHCO3):化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)。
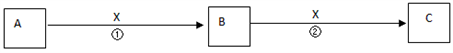
(1)若X是氧气,则A不可能______________ A.C B.Si C.Na D.Mg
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为__________ ;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)___________ 。检验B溶液中阳离子的操作方法是_________________ 。
(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,则反应②的离子方程式为________________
(4)若X为盐酸,A、B、C均不含铝元素,且反应②有无色无味气体生成,则反应①的离子方程式为___________________ 。

(1)若X是氧气,则A不可能
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为
(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,则反应②的离子方程式为
(4)若X为盐酸,A、B、C均不含铝元素,且反应②有无色无味气体生成,则反应①的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】用方程式回答下列问题。
(1) 在
在 中燃烧:
中燃烧:_______ 。
(2)“水滴石穿”的反应原理(用离子方程式表示):_______ 。
(3)“钟乳石”的形成过程(用化学方程式表示):_______ ,_______ 。
(4)向饱和 溶液中通入过量
溶液中通入过量 的离子方程式:
的离子方程式:_______ 。
(5)氢氟酸不能用玻璃瓶盛放,其原因是(用化学方程式表示):_______ 。
(6)盛放 溶液的试剂瓶不能用玻璃塞,其原因是(用离子方程式表示):
溶液的试剂瓶不能用玻璃塞,其原因是(用离子方程式表示):_______ 。
(7)侯氏制碱法的原理(用化学方程式表示):_______ 。
(1)
 在
在 中燃烧:
中燃烧:(2)“水滴石穿”的反应原理(用离子方程式表示):
(3)“钟乳石”的形成过程(用化学方程式表示):
(4)向饱和
 溶液中通入过量
溶液中通入过量 的离子方程式:
的离子方程式:(5)氢氟酸不能用玻璃瓶盛放,其原因是(用化学方程式表示):
(6)盛放
 溶液的试剂瓶不能用玻璃塞,其原因是(用离子方程式表示):
溶液的试剂瓶不能用玻璃塞,其原因是(用离子方程式表示):(7)侯氏制碱法的原理(用化学方程式表示):
您最近一年使用:0次



