百校联盟2019-2020学年高一上学期第四次月考化学试题 化学
全国
高一
阶段练习
2020-04-07
373次
整体难度:
适中
考查范围:
化学实验基础、化学与STSE、常见无机物及其应用、认识化学科学、化学反应原理
一、单选题 添加题型下试题
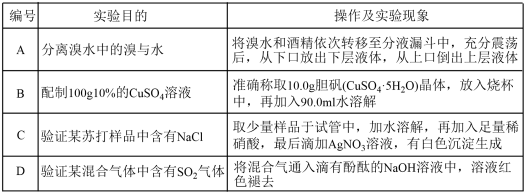
| A.工业废气中的固体悬浮物和矿山开采地的粉尘(雾霾) |
| B.超市用的塑料袋随意丢弃(白色污染) |
| C.工业上CO2的排放(酸雨) |
| D.刻制印刷电路时使用过的腐蚀液直接排放到河流(河流和地下水污染) |
【知识点】 大气污染
①SO2(漂白纸浆、毛、丝、草帽辫等)
②氢氟酸(在玻璃上雕刻赏心悦目图案)
③Fe3O4(用作红色油漆和涂料)
④ClO2(自来水消毒剂)
⑤Al(OH)3(胃酸中和剂)
⑥Na2O2(作呼吸面具或潜水艇的供氧剂)
| A.①②④⑤⑥ | B.①②③④⑤ |
| C.②③④⑤⑥ | D.全部 |
【知识点】 过氧化钠的物理性质、组成、结构及用途解读
| A.Na+、K+、SO32-、SO42- | B.Na+、Fe2+、Cl-、MnO4- |
| C.Na+、K+、SiO32-、NO3- | D.Al3+、NH4+、SO42-、Cl- |
【知识点】 离子共存 限定条件下的离子共存解读
| A.制取普通玻璃是以纯碱、黏土、石英砂为主要原料 |
| B.二氧化硅是太阳能转换为电能的常用材料 |
| C.石棉(CaMg3Si4O12)表示为CaO·3MgO·4SiO2 |
| D.水晶、玻璃、陶瓷的主要成分都属于硅酸盐制品 |
【知识点】 硅酸与硅酸盐 硅酸盐组成的表示方法解读
①NaOH溶液应保存在带有磨口玻璃塞的试剂瓶中,防止与空气中的CO2反应
②金属Na保存在煤油中,防止与空气中的O2和H2O反应
③浓硫酸应该保存在带橡胶塞的玻璃试剂瓶中,防止因浓硫酸粘性大而打不开瓶塞
④漂白粉应密封保存,防止被空气中的氧气氧化
⑤装有浓盐酸和浓氨水的试剂瓶应放在同一贮存柜中,是因为两种试剂都具有挥发性
| A.①② | B.③④ | C.② | D.②⑤ |
【知识点】 漂白粉的变质原因及检验解读 钠单质的保存与用途解读
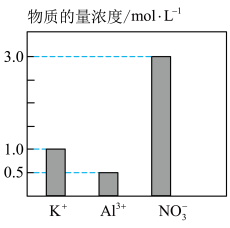
| A.0.25mol | B.0.5mol | C.0.75mol | D.1.5mol |
【知识点】 离子反应的实际应用
| A.向某溶液通入Cl2后,再滴入少许KSCN溶液,溶液变血红色,则原溶液中一定有Fe2+ |
| B.向某溶液加入BaCl2溶液生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定有SO42- |
| C.向某溶液中加入足量稀盐酸,有无色无味使澄清石灰水变浑浊的气体生成,则原溶液中一定有CO32- |
| D.向某溶液中滴加氯水和CCl4,振荡后下层溶液显紫色,则原溶液中一定有I- |
A.图甲可以用来制备Fe(OH)3胶体 |
B.图乙可以用来证明酸性强弱顺序:H2SO4>H2CO3>H2SiO3 |
C.图丙可以通过点燃肥皂泡来检验是否有氢气气体生成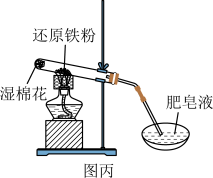 |
D.图丁可以用陶瓷坩埚加热融化NaOH固体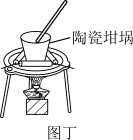 |
【知识点】 实验方案设计的基本要求解读
| A.向Na2CO3溶液中滴入少量的盐酸:CO32-+H+=HCO3- |
| B.向KAl(SO4)2溶液滴加过量NaOH溶液反应:Al3++4OH-=AlO2-+2H2O |
| C.氯气溶于水生成盐酸和次氯酸:Cl2+H2O=2H++Cl-+ClO- |
| D.固体SiO2和NaOH溶液反应:SiO2+2OH-=SiO32-+H2O |
【知识点】 离子方程式的正误判断解读
| A.配制480mL0.1mol·L-1的NaCl溶液需用托盘天平称量2.925gNaCl固体 |
| B.用50mL量筒量取5.5mL稀盐酸 |
| C.使用容量瓶配制溶液,用蒸馏水洗涤烧杯和玻璃棒2~3次并转移到容量瓶中 |
| D.定容时发现液面高于刻度线,可用胶头滴管吸取出少量液体使液面与刻度线相切 |
【知识点】 配制一定物质的量浓度的溶液的步骤、操作解读
①H2S→S→SO3→H2SO4
②Al→Al2O3→NaAlO2→Al(OH)3
③Fe→FeCl2→Fe(OH)2→Fe(OH)3
④Si→SiO2→H2SiO3→Na2SiO3
⑤Na→Na2O→Na2CO3→NaOH
| A.②③④ | B.①③④⑤ | C.②③⑤ | D.①②③④⑤ |
【知识点】 物质的转化

| A.反应①中氧化剂与还原剂的物质的量之比为1:4 |
| B.反应①②③④⑤均属于氧化还原反应 |
| C.生成等量的O2,反应③和④转移的电子数之比为1:1 |
| D.反应⑤的离子反应方程式为2Fe2++O2+2H+=2Fe3++2H2O |
【知识点】 氧化还原反应的应用
| A.标准状况下,11.2L乙醇中所含的分子数为0.5NA |
| B.常温下,39gNa2O2与Na2S的混合物所含的Na+数目为2NA |
| C.将4.6gNa与一定量O2反应生成7.0g产物时失去的电子数为0.2NA |
| D.足量的Al粉与标准状况下的1.12LCl2充分反应,转移的电子数为0.15NA |
【知识点】 阿伏加德罗常数的求算解读
①将金属钠投入到AlCl3溶液中
②将NaOH溶液滴入到盛有FeSO4溶液的试管中
③向Na2SiO3溶液中滴入过量盐酸
④向饱和NaCl溶液中先通入足量NH3,再通入过量CO2气体
⑤向饱和Na2CO3溶液中通入足量CO2
| A.①③④⑤ | B.①②③④⑤ | C.②③ | D.③④⑤ |
【知识点】 碳酸钠
| A.分别取样配成溶液,滴加稀盐酸溶液,开始就有气泡产生的是NaHCO3 |
| B.分别取样配成溶液,滴加Ca(OH)2溶液,观察无白色沉淀产生的是NaHCO3 |
| C.分别取样配成溶液,滴加BaCl2溶液,观察无白色沉淀产生的是NaHCO3 |
| D.分别取样在试管中加热,将产生的气体通入澄清石灰水,观察有白色浑浊产生的是NaHCO3 |
【知识点】 碳酸钠与碳酸氢钠性质的比较解读
| 选项 | 实验事实 | 解释 |
| A | 向品红溶液中通入SO2气体,溶液褪色 | SO2氧化品红生成无色物质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | 生成了BaSO3沉淀 |
| C | 漂白粉敞口放置在空气中失效 | 漂白粉与空气中CO2和H2O生成了CaCO3 |
| D | 硝酸具有挥发性 | 硝酸不稳定 |
| A.A | B.B | C.C | D.D |
【知识点】 物质性质实验方案的设计解读

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | NaOH | NH3 | H2O |
B | 浓硫酸 | Cu | SO2 | NaOH溶液 |
C | 浓硝酸 | Cu | NO2 | NaOH溶液 |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A.A | B.B | C.C | D.D |
【知识点】 氨气的制备

下列判断错误的是( )
| A.生成白色沉淀D的离子方程式为SiO32-+2H+=H2SiO3↓ |
| B.BaSO4一定不存在,NaOH可能存在 |
| C.Na2SiO3、BaSO4、BaCO3、Na2SO3一定存在,NaOH可能存在 |
| D.气体B和气体E均可使澄清的石灰水变浑浊 |
【知识点】 离子反应在化合物组成的分析、鉴定的应用解读 无机物的检验
 、Mg2+、Al3+、Fe3+、CO
、Mg2+、Al3+、Fe3+、CO 、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)
、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)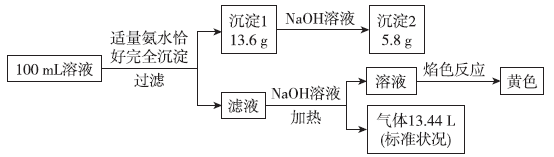
下列说法错误的是
A.原溶液一定存在Na+、NH 、Mg2+、Al3+和Cl-,一定不存在Fe3+、CO 、Mg2+、Al3+和Cl-,一定不存在Fe3+、CO |
B.原溶液中c(NH )=1mol·L-1 )=1mol·L-1 |
| C.沉淀2的成分为Mg(OH)2 |
| D.原溶液中c(Cl-)≥6mol·L-1 |
| A.当Al3+恰好完全沉淀时,消耗氢氧化钡1.5mol |
| B.当SO42-恰好完全沉淀时,铝元素全部以Al(OH)3的形式存在 |
| C.当Al3+恰好完全生成AlO2-时,消耗氢氧化钡2.5mol |
| D.随加入的氢氧化钡的物质的量不断增大,沉淀的物质的量不断增大 |
| A.15.12L | B.10.08L | C.2.24L | D.3.36L |
| A.0.15mol·L-1 | B.0.2mol·L-1 | C.0.075mol·L-1 | D.0.45mol·L-1 |
二、解答题 添加题型下试题
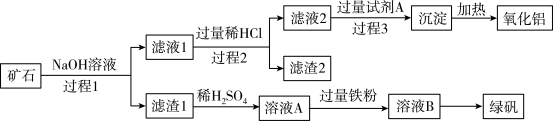
回答下列问题:
(1)滤渣1的成分是
(2)用离子方程式表示溶液A加入过量铁粉的目的是
(3)写出由滤液1生成滤液2的离子方程式
(4)过程1、2、3均涉及分离操作,所需玻璃仪器有
(5)由溶液B得到绿矾的具体操作为
(6)过程3需要加入的试剂A是
三、填空题 添加题型下试题
(1)汽车尾气含有NO、CO等多种污染物,是城市的污染源。
①用化学方程式表示产生NO的原因
②治理尾气方法是加装催化转化装置,使NO和CO反应转化为无污染的两种气体,发生反应的化学方程式是
(2)工业上产生的NO2可用NH3在一定条件下消除污染。
①写出此反应的化学方程式
②在标准状况下,消耗NO233.6L,则此反应的氧化产物比还原产物多
(3)工业上为了减少燃煤过程中SO2的排放,向燃煤中加入生石灰,其产物可作建筑材料。写出有关反应的化学方程式
| 净含量:500mL 密度:1.12g·cm-3 主要成分:7.45%NaClO 使用方法:稀释100倍(体积比)后使用 注意事项:密封保存,易吸收空气中的CO2变质 |
(1)该漂白液中,NaClO的物质的量浓度约为
(2)使用NaOH溶液和氯气来制取消毒液,写出该反应的离子方程式
(3)漂白液易吸收空气中的CO2而生成NaHCO3,写出有关的化学方程式
四、解答题 添加题型下试题
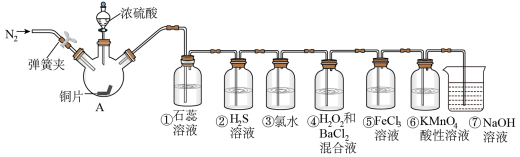
(1)在A中发生反应的化学方程式为
(2)①中的实验现象为紫色石蕊溶液
②中的实验现象为
③中的实验现象是
④中的实验现象是
⑤中的现象是溶液由黄色变为浅绿色,其反应的离子方程式为
(3)能体现出SO2还原性的实验序号是
(4)实验结束后需要通入N2,其目的是
试卷分析
试卷题型(共 29题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 实验安全 | |
| 2 | 0.85 | 大气污染 | |
| 3 | 0.65 | 过氧化钠的物理性质、组成、结构及用途 | |
| 4 | 0.65 | 离子共存 限定条件下的离子共存 | |
| 5 | 0.85 | 硅酸与硅酸盐 硅酸盐组成的表示方法 | |
| 6 | 0.65 | 漂白粉的变质原因及检验 钠单质的保存与用途 | |
| 7 | 0.65 | 离子反应的实际应用 | |
| 8 | 0.65 | 硫酸根离子的检验 离子的检验 | |
| 9 | 0.65 | 常见氧化剂与还原剂 氧化还原反应的应用 | |
| 10 | 0.65 | 实验方案设计的基本要求 | |
| 11 | 0.4 | 离子方程式的正误判断 | |
| 12 | 0.65 | 配制一定物质的量浓度的溶液的步骤、操作 | |
| 13 | 0.65 | 物质的转化 | |
| 14 | 0.4 | 氧化还原反应的应用 | |
| 15 | 0.65 | 阿伏加德罗常数的求算 | |
| 16 | 0.65 | 化学实验方案的设计与评价 | |
| 17 | 0.4 | 碳酸钠 | |
| 18 | 0.4 | 碳酸钠与碳酸氢钠性质的比较 | |
| 19 | 0.65 | 物质性质实验方案的设计 | |
| 20 | 0.65 | 氨气的制备 | |
| 21 | 0.4 | 离子反应在化合物组成的分析、鉴定的应用 无机物的检验 | |
| 22 | 0.4 | 离子共存 离子反应在化合物组成的分析、鉴定的应用 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 离子的检验 | |
| 23 | 0.4 | 离子反应的实际应用 铝盐与强碱溶液反应 | |
| 24 | 0.4 | 硝酸的强氧化性 有关酸性环境下硝酸根氧化性的有关计算 | |
| 25 | 0.4 | 硝酸的强氧化性 有关酸性环境下硝酸根氧化性的有关计算 | |
| 二、解答题 | |||
| 26 | 0.65 | 含氧化铝的混合物的提纯 有关铁及其化合物转化的流程题型 物质分离、提纯综合应用 | 工业流程题 |
| 29 | 0.65 | 二氧化硫的制备 化学实验探究 | 实验探究题 |
| 三、填空题 | |||
| 27 | 0.65 | 氨的还原性 二氧化硫的化学性质 | |
| 28 | 0.65 | 化学方程式计算中物质的量的运用 依据物质的量浓度公式的基础计算 氯气与碱溶液反应 碳酸钠与碳酸氢钠的相互转化 | |