1 . 过氧化镁( )是一种镁精细化工产品,在医疗及环境保护上均有应用。工业上利用碱式碳酸镁[
)是一种镁精细化工产品,在医疗及环境保护上均有应用。工业上利用碱式碳酸镁[ ]制备过氧化镁的过程如图所示。
]制备过氧化镁的过程如图所示。 和
和 常温下比较稳定,加热时容易发生分解;
常温下比较稳定,加热时容易发生分解;
ⅱ、MgO与 反应放出大量的热。
反应放出大量的热。
(1) 中氢、氧原子的个数比为
中氢、氧原子的个数比为______ 。
(2) 煅烧时分解生成三种氧化物,分别为MgO和
煅烧时分解生成三种氧化物,分别为MgO和______ 、______ (填化学式)。
(3)反应2的化学方程式为 。用40gMgO,理论上可制备
。用40gMgO,理论上可制备 的质量是多少?(写出计算过程)
的质量是多少?(写出计算过程)
(4)加入稳定剂的目的是______ 。
 )是一种镁精细化工产品,在医疗及环境保护上均有应用。工业上利用碱式碳酸镁[
)是一种镁精细化工产品,在医疗及环境保护上均有应用。工业上利用碱式碳酸镁[ ]制备过氧化镁的过程如图所示。
]制备过氧化镁的过程如图所示。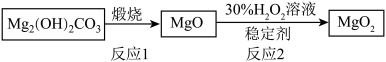
 和
和 常温下比较稳定,加热时容易发生分解;
常温下比较稳定,加热时容易发生分解;ⅱ、MgO与
 反应放出大量的热。
反应放出大量的热。(1)
 中氢、氧原子的个数比为
中氢、氧原子的个数比为(2)
 煅烧时分解生成三种氧化物,分别为MgO和
煅烧时分解生成三种氧化物,分别为MgO和(3)反应2的化学方程式为
 。用40gMgO,理论上可制备
。用40gMgO,理论上可制备 的质量是多少?(写出计算过程)
的质量是多少?(写出计算过程)(4)加入稳定剂的目的是
您最近一年使用:0次
解题方法
2 . 某工业废水中含有大量氯化镁和硝酸镁,某废水处理公司从该废水中提取回收金属镁的流程如下图所示:______ 。
(2)流程中加入石灰乳时,进行充分搅拌的目的是______ 。
(3)推断溶液A中一定含有的阴离子有______ (填离子符号)。
(4)试剂a是______ (填名称),并写出反应1的化学方程式为______ 。

(2)流程中加入石灰乳时,进行充分搅拌的目的是
(3)推断溶液A中一定含有的阴离子有
(4)试剂a是
您最近一年使用:0次
2023-07-14更新
|
33次组卷
|
2卷引用:2023年安徽省滁州市凤阳县部分学校学业水平模拟化学试题
解题方法
3 . 兴趣小组在学校的实验室进行【粗盐的提纯】实验,邀请你一起完成。
Ⅰ、溶解
Ⅱ、过滤
(1)过滤时玻璃棒的作用是________________ 。
小明引同学对过滤后滤液的成分产生了浓厚的兴趣。
a.粗盐中除含泥沙等难溶性杂质外,还含有CaC12、MgC12、Na2SO4等可溶性杂质。
b.BaSO4不溶于水、不溶于酸
【设计实验方案并进行实验】
(2)为确认滤液中CaCl2、MgC12、Na2SO4的存在,小明利用实验台上的NaOH溶液、BaCl2溶液、Na2CO3溶液进行以下实验探究。
【实验反思】
(3)小宇同学认为实验③不够严谨,理由是_________________ 。
(4)请设计实验方案验证滤液中含有Na2SO4:取少量实验③所得的白色沉淀于试管中,________________ 。
【实验结论】
(5)小组同学在老师的帮助下将上述杂质除去,然后将除杂后的滤液置于蒸发皿进行蒸发结晶,当观察到________________ ,就停止加热,利用余热蒸干。小明宣布:我们得到了纯净的氯化钠。
Ⅰ、溶解
Ⅱ、过滤
(1)过滤时玻璃棒的作用是
小明引同学对过滤后滤液的成分产生了浓厚的兴趣。
a.粗盐中除含泥沙等难溶性杂质外,还含有CaC12、MgC12、Na2SO4等可溶性杂质。
b.BaSO4不溶于水、不溶于酸
【设计实验方案并进行实验】
(2)为确认滤液中CaCl2、MgC12、Na2SO4的存在,小明利用实验台上的NaOH溶液、BaCl2溶液、Na2CO3溶液进行以下实验探究。
| 实验操作 | 实验现象 | 实验结论 |
| ①往上述所得的滤液中加入足量的NaOH溶液,充分反应,静置,过滤 | 滤液中含有MgCl2 | |
| ②往上述①的滤液中滴加足量的X溶液,充分反应,静置,过滤 | 产生白色沉淀 | 滤液中含有CaCl2发生反应的化学方程式为 |
| ③往上述②的滤液中加入足量的氯化钡溶液,充分反应,静置,过滤 | 有白色沉淀生成 | 滤液中含有Na2SO4 |
【实验反思】
(3)小宇同学认为实验③不够严谨,理由是
(4)请设计实验方案验证滤液中含有Na2SO4:取少量实验③所得的白色沉淀于试管中,
【实验结论】
(5)小组同学在老师的帮助下将上述杂质除去,然后将除杂后的滤液置于蒸发皿进行蒸发结晶,当观察到
您最近一年使用:0次
解题方法
4 . 四氧化三铁是一种重要的多功能无机物质。实验室以工业绿矾(主要成分FeSO4·7H2O为原料模拟制备四氧化三铁的流程如下:
【查阅资料】
①硫酸亚铁在不同温度下的溶解度:
②Fe(OH)2易氧化:
③获得 的反应原理为
的反应原理为
(1)制取氧气:实验室常用过氧化氢溶液和二氧化锰混合制氧气,反应的化学方程式为:_______ 。结合实验原理从下图中选择该反应的最佳发生装置为______ (填序号)。
A. B.
B.  C.
C.  D.
D. 
(2)生产流程:
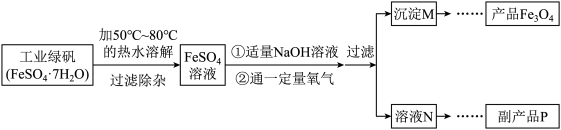
制备过程:
步骤一:将绿矾研磨之后加入50-80°C的热水溶解,然后过滤;
步骤二:向滤液中加入适量氢氧化钠溶液:
步骤三:控制合适条件,缓慢通入一定量氧气,充分反应后,得到大量沉淀;
步骤四:将沉淀过滤出后,洗涤,干燥,得到产品 。
。
①溶解时,需用50°C至80°C的热水目的是:一是可以加快并使其充分溶解;二是_______ 。
②过滤时需要的玻璃仪器有烧杯、玻璃棒、_______ 等。
③步骤二中所发生的反应方程式为:_______ 。.
④步骤三中需控制“一定量氧气”,不能通足量氧气的原因是_______ 。.
⑤步骤四中洗涤之后,检验是否洗净的方法是:取少量最后一次的洗涤液于试管中,加入足量_______ (请补充完整后续过程)。
【查阅资料】
①硫酸亚铁在不同温度下的溶解度:
| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |

③获得
 的反应原理为
的反应原理为
(1)制取氧气:实验室常用过氧化氢溶液和二氧化锰混合制氧气,反应的化学方程式为:
A.
 B.
B.  C.
C.  D.
D. 
(2)生产流程:

制备过程:
步骤一:将绿矾研磨之后加入50-80°C的热水溶解,然后过滤;
步骤二:向滤液中加入适量氢氧化钠溶液:
步骤三:控制合适条件,缓慢通入一定量氧气,充分反应后,得到大量沉淀;
步骤四:将沉淀过滤出后,洗涤,干燥,得到产品
 。
。①溶解时,需用50°C至80°C的热水目的是:一是可以加快并使其充分溶解;二是
②过滤时需要的玻璃仪器有烧杯、玻璃棒、
③步骤二中所发生的反应方程式为:
④步骤三中需控制“一定量氧气”,不能通足量氧气的原因是
⑤步骤四中洗涤之后,检验是否洗净的方法是:取少量最后一次的洗涤液于试管中,加入足量
您最近一年使用:0次
解题方法
5 . 过氧碳酸钠是一种白色固体,化学式可表示为Na2CO4,广泛应用于水产养殖、家用洗涤剂等领域。同学们发现,将过氧碳酸钠粉末加入到水中后,会产生无色气体,得到的澄清溶液pH>7。
为探究无色气体和溶液中溶质的成分,同学们分组进行了以下探究。
【查阅资料】NaHCO3溶液呈碱性,且与CaCl2不反应。CaCl2溶液呈中性。
为探究无色气体和溶液中溶质的成分,同学们分组进行了以下探究。
【查阅资料】NaHCO3溶液呈碱性,且与CaCl2不反应。CaCl2溶液呈中性。
| 甲组 | 乙组 | |
| 提出问题 | 产生的无色气体是什么? | 澄清溶液中的溶质是什么? |
| 做出猜想 | 猜想一:H2 猜想二:O2 猜想三:CO2 猜想四:CO 猜想五:以上气体中的多种 | 猜想一:Na2CO3 猜想二:NaOH 猜想三:NaCl 猜想四:NaHCO3 猜想五:以上物质中的多种 |
| 讨论交流 | 大家一致认为,猜想四不合理,理由是CO | 有同学指出,猜想三不成立,理由是 |
| 实验探究 | 青青设计了如图实验:先通入N2一段时间,再通入无色气体,然后加热。 | 悠悠取一定量反应后的澄清溶液于试管中,加入少量CaCl2溶液,产生白色沉淀。过滤后,将滤液分为a、b两份,①向a中加入无色酚酞溶液,②向b中加入足量稀盐酸。 |
| 表达交流 | 观察到装置A中固体由红色变为黑色,装置B中无明显变化,C中溶液质量不变。 | 产生白色沉淀的化学方程式为 |
| 反思改进 | 悠悠认为,该实验无法排除气体中含有CO2的可能,于是将C中试剂改为 | 青青认为,该方案中应加入稍过量的CaCl2溶液,目的是 |
| 得出结论 | 猜想二成立,产生的无色气体是O2。 | 改进后再进行实验,观察到实验①中溶液为无色,实验②中 |
您最近一年使用:0次
名校
解题方法
6 . 现探究一固体混合物的成分,已知其中可能含有 、
、 、
、 、
、 、NaCl五种物质中的一种或几种,按图所示进行实验操作,现象如图中所述(设过程中所有可能发生的反应都完全进行)。
、NaCl五种物质中的一种或几种,按图所示进行实验操作,现象如图中所述(设过程中所有可能发生的反应都完全进行)。

(1)步骤③、④都用到过滤操作,该操作中用到的铁制仪器是_____ ,该操作中玻璃棒的作用是_____ 。
(2)根据以上步骤,该固体中一定不存在的物质是_____ 、_____ 。
(3)写出步骤②③的化学方程式。步骤②_____ ,步骤③_____ 。
(4)无法确定的物质是_____ ,为了确定该物质是否存在,对以上实验的改进方案是_____ 。
 、
、 、
、 、
、 、NaCl五种物质中的一种或几种,按图所示进行实验操作,现象如图中所述(设过程中所有可能发生的反应都完全进行)。
、NaCl五种物质中的一种或几种,按图所示进行实验操作,现象如图中所述(设过程中所有可能发生的反应都完全进行)。
(1)步骤③、④都用到过滤操作,该操作中用到的铁制仪器是
(2)根据以上步骤,该固体中一定不存在的物质是
(3)写出步骤②③的化学方程式。步骤②
(4)无法确定的物质是
您最近一年使用:0次
名校
解题方法
7 . 某地一儿童将燃着的鞭炮投入窖井中,引起窖井爆炸造成一名儿童身亡。这件事引起某化学小组同学的思考和探究。
【提出问题】窨井中含有什么气体?
【查阅资料】Ⅰ.窖井中的有机物在一定条件下发酵会产生CO、 、
、 、
、 等
等
Ⅱ. 气体能与
气体能与 溶液反应生成黑色沉淀。
溶液反应生成黑色沉淀。
Ⅲ. 能使氢氧化钡溶液变浑浊。
能使氢氧化钡溶液变浑浊。
【猜想与验证】窖井中气体有多种可能,他们设计了如图所示的装置并进行探究(假设每一步都反应完全)
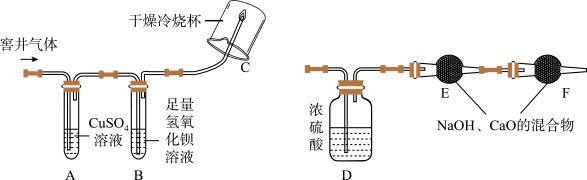
(1)实验时,A装置没有明显变化,说明窖井中不含_____ 气体。B中出现白色沉淀,则B中反应的方程式为_____ 。
(2)要检验窖井中是否含有 ,某同学认为图示装置有不足之处,需要在装置B与C之间加一个
,某同学认为图示装置有不足之处,需要在装置B与C之间加一个_____ 装置。改进后,若气体燃烧,且C装置内壁出现_____ ,就能证明气体中一定含有 。
。
(3)为了进一步确认气体中是否含有一氧化碳,小明将装置C处导出的气体完全燃烧后的产物依次通过乙图装置D、E、F,实验前后称量D、E装置的质量。
①装置D的作用是_____ ,装置F的作用是_____ 。
②经实验测定装置D增重1.8g,装置E增重2.2g,则原混合气体_____ (选填“是”或“否”)含有CO。
【实验反思】请用化学知识解释爆炸的原因_____ ,若需要工人进入下水道清理淤泥,打开下水道井盖后应首先进行_____ 操作。
【提出问题】窨井中含有什么气体?
【查阅资料】Ⅰ.窖井中的有机物在一定条件下发酵会产生CO、
 、
、 、
、 等
等Ⅱ.
 气体能与
气体能与 溶液反应生成黑色沉淀。
溶液反应生成黑色沉淀。Ⅲ.
 能使氢氧化钡溶液变浑浊。
能使氢氧化钡溶液变浑浊。【猜想与验证】窖井中气体有多种可能,他们设计了如图所示的装置并进行探究(假设每一步都反应完全)

(1)实验时,A装置没有明显变化,说明窖井中不含
(2)要检验窖井中是否含有
 ,某同学认为图示装置有不足之处,需要在装置B与C之间加一个
,某同学认为图示装置有不足之处,需要在装置B与C之间加一个 。
。(3)为了进一步确认气体中是否含有一氧化碳,小明将装置C处导出的气体完全燃烧后的产物依次通过乙图装置D、E、F,实验前后称量D、E装置的质量。
①装置D的作用是
②经实验测定装置D增重1.8g,装置E增重2.2g,则原混合气体
【实验反思】请用化学知识解释爆炸的原因
您最近一年使用:0次
8 . 某兴趣小组用氯酸钾和二氧化锰制取氧气。可能用到实验装置如图所示:

请回答下列问题:
(1)a仪器的名称________ 。
(2)写出用该方法制取氧气的化学方程式________ ,其中二氧化锰的作用是________ ,制取并收集干燥的氧气应选用________ (填实验装置图字母序号)。
(3)氯酸钾完全分解后,为了回收二氧化锰和氯化钾,又进行了如下实验操作:

实验操作中,加入足量的水的目的是________ ;实验操作②应选择上述图中的________ (填实验装置图字母序号)。
(4)实验结束后,同学们在拆卸装置时闻到刺激性气味。他们将回收得到的MnO2称量,发现其质量小于加热前MnO2的质量。查阅资料后发现。加热KC1O3和MnO2混合物的反应过程如下:
第一步:
第二步:
第三步:
拆卸装置时闻到刺激性气味的气体是________ ,根据以上信息写出加热后剩余固体中MnO2质量小于加热前MnO2质量的原因________ 。

请回答下列问题:
(1)a仪器的名称
(2)写出用该方法制取氧气的化学方程式
(3)氯酸钾完全分解后,为了回收二氧化锰和氯化钾,又进行了如下实验操作:

实验操作中,加入足量的水的目的是
(4)实验结束后,同学们在拆卸装置时闻到刺激性气味。他们将回收得到的MnO2称量,发现其质量小于加热前MnO2的质量。查阅资料后发现。加热KC1O3和MnO2混合物的反应过程如下:
第一步:

第二步:

第三步:

拆卸装置时闻到刺激性气味的气体是
您最近一年使用:0次
2023-06-09更新
|
52次组卷
|
2卷引用:2023年云南省初中学业水平模拟监测化学试题(二)
解题方法
9 . 废旧电路板中主要含有塑料、铜和锡等,为实现对其中锡的绿色回收,某工艺流程如下。

已知:Sn+SnCl4=2SnCl2
(1)反应前,先要将废旧电路板粉碎,其目的是______ ,SnCl4中锡元素的化合价是_______ 。
(2)铜的金属活动性比锡的_____ (填“强”或“弱"),固体A中一定含有的金属元素是______ 。
(3)写出步骤②发生反应的化学方程式______ 。
(4)相比于直接焚烧废旧电路板回收金属,该工艺主要优点是________ (回答点即可)。

已知:Sn+SnCl4=2SnCl2
(1)反应前,先要将废旧电路板粉碎,其目的是
(2)铜的金属活动性比锡的
(3)写出步骤②发生反应的化学方程式
(4)相比于直接焚烧废旧电路板回收金属,该工艺主要优点是
您最近一年使用:0次
10 . 镁的化学性质较活泼,能与氮气、二氧化碳、氧气等气体发生反应。如图装置气密性良好,先点燃过量的红磷,待红磷熄灭并冷却至室温,钟罩内水面上升约 体积。再使用凸透镜会聚太阳光点燃镁带,镁带继续燃烧,水面继续上升到约
体积。再使用凸透镜会聚太阳光点燃镁带,镁带继续燃烧,水面继续上升到约 位置。下列有关说法不正确的
位置。下列有关说法不正确的
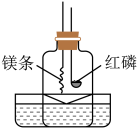
 体积。再使用凸透镜会聚太阳光点燃镁带,镁带继续燃烧,水面继续上升到约
体积。再使用凸透镜会聚太阳光点燃镁带,镁带继续燃烧,水面继续上升到约 位置。下列有关说法不正确的
位置。下列有关说法不正确的
| A.用凸透镜会聚太阳光目的是使镁的温度达到着火点 |
| B.该实验可以测定空气中氧气的含量 |
| C.氮气的化学性质不活泼,不支持燃烧 |
| D.金属燃烧不能用二氧化碳灭火 |
您最近一年使用:0次
2023-05-31更新
|
120次组卷
|
3卷引用:2023年安徽省六安市舒城县初中毕业学业考试模拟化学试题
2023年安徽省六安市舒城县初中毕业学业考试模拟化学试题2023年安徽省省城名校中考最后三模(一)化学试题(已下线)实验05 空气中氧气含量的测定-【同步实验课】2023-2024学年九年级化学上册教材实验大盘点(人教版)



