解题方法
1 . 周末航天兴趣小组的同学去参观了航天展览馆,了解到空间站实验舱使用的太阳能电池中含有铬(Cr)元素。同学们欲探究铬与常见金属铝、铜的活动性强弱。
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀的致密氧化膜。铬能与稀硫酸反应,生成氢气和硫酸铬(CrSO4)。
【提出猜想】对这三种金属的活动性顺序提出了如下猜想:
猜想①:Cr>Al>Cu猜想②:Cr>Cu>Al猜想③:Al>Cr>Cu猜想④:Al>Cu>Cr
【讨论交流】
(1)根据已学金属活动性顺序和资料分析,不能成立的是猜想___________ (填序号)。
【实验设计及过程】
(2)请将表中的内容填写完整。
【实验反思】
(3)将金属片投入稀硫酸前应先打磨金属片的目的是___________ 。
(4)写出铝片与稀硫酸反应的化学方程式:___________ 。
(5)有同学提出探究金属活动性强弱还可以依据“金属与金属化合物溶液是否发生置换反应”来判断。此方法也能比较铝、铬、铜三种金属的活动性,你的设计方案是___________ 。
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀的致密氧化膜。铬能与稀硫酸反应,生成氢气和硫酸铬(CrSO4)。
【提出猜想】对这三种金属的活动性顺序提出了如下猜想:
猜想①:Cr>Al>Cu猜想②:Cr>Cu>Al猜想③:Al>Cr>Cu猜想④:Al>Cu>Cr
【讨论交流】
(1)根据已学金属活动性顺序和资料分析,不能成立的是猜想
【实验设计及过程】
(2)请将表中的内容填写完整。
| 实验操作 | 实验现象 | 实验结论 |
| 室温下,将大小相同并打磨光亮的铬片、铝片、铜片分别浸入盛有相同浓度、相同体积的稀硫酸试管中 | 铬片表面产生气泡缓慢,铝片表面产生气泡较快,铜片表面 | 猜想 |
【实验反思】
(3)将金属片投入稀硫酸前应先打磨金属片的目的是
(4)写出铝片与稀硫酸反应的化学方程式:
(5)有同学提出探究金属活动性强弱还可以依据“金属与金属化合物溶液是否发生置换反应”来判断。此方法也能比较铝、铬、铜三种金属的活动性,你的设计方案是
您最近一年使用:0次
2024-02-19更新
|
163次组卷
|
2卷引用:安徽省滁州市定远县八一学校2023-2024学年九年级下学期开学模拟化学试题
解题方法
2 . 人体代谢产生的过氧化氢,对人体有毒害作用。人体肝脏中的过氧化氢酶能催化过氧化氢分解产生氧气和水。某同学查阅资料发现,FeCl3也能催化过氧化氢分解。为比较过氧化氢酶和FeCl3催化效率的高低,该同学在28℃环境下进行了如下探究。
【查阅资料】过氧化氢酶是高效的生物催化剂。温度过高,过氧化氢酶的活性反而会降低。
【提出问题】过氧化氢酶和 FeCl3催化效率哪个更高?
(1)【猜想与假设】______ 。
【实验材料】适宜浓度的FeCl3溶液﹐适宜浓度的新鲜猪肝研磨液(含有过氧化氢酶),5%的过氧化氢溶液等。
【实验步骤】
①取2套下图甲装置﹐编号为1、2,并各注入10 mL5%的过氧化氢溶液;
②向1号装置锥形瓶内滴入2滴适宜浓度的FeCl3溶液,向2号装置锥形瓶内滴入2滴适宜浓度的新鲜猪肝研磨液﹔
③观察并记录注射器活塞移动刻度。

【实验分析】
(2)请写出FeCl3溶液催化H2O2分解的化学方程式______ 。
(3)如图甲,实验前检查该装置气密性的方法是______ 。要定量比较两者的催化效果,可测量生成等体积气体所需的______ 。
【预测实验结果】
(4)请写出一种可能的实验结果:______ 。
【实验拓展】
(5)在以上探究的基础上,该同学又完成了“探究温度对猪肝研磨液和FeCl3催化效率的影响”实验。实验结果如图乙所示。图中代表猪肝研磨液催化效率的曲线是______ ,判断的理由是______ 。
【查阅资料】过氧化氢酶是高效的生物催化剂。温度过高,过氧化氢酶的活性反而会降低。
【提出问题】过氧化氢酶和 FeCl3催化效率哪个更高?
(1)【猜想与假设】
【实验材料】适宜浓度的FeCl3溶液﹐适宜浓度的新鲜猪肝研磨液(含有过氧化氢酶),5%的过氧化氢溶液等。
【实验步骤】
①取2套下图甲装置﹐编号为1、2,并各注入10 mL5%的过氧化氢溶液;
②向1号装置锥形瓶内滴入2滴适宜浓度的FeCl3溶液,向2号装置锥形瓶内滴入2滴适宜浓度的新鲜猪肝研磨液﹔
③观察并记录注射器活塞移动刻度。

【实验分析】
(2)请写出FeCl3溶液催化H2O2分解的化学方程式
(3)如图甲,实验前检查该装置气密性的方法是
【预测实验结果】
(4)请写出一种可能的实验结果:
【实验拓展】
(5)在以上探究的基础上,该同学又完成了“探究温度对猪肝研磨液和FeCl3催化效率的影响”实验。实验结果如图乙所示。图中代表猪肝研磨液催化效率的曲线是
您最近一年使用:0次
3 . 在浓硫酸的催化作用下,固体草酸(H2C2O4)受热分解生成碳的氧化物和水。某化学课外兴趣小组对碳的氧化物的成分进行了实验探究。
【提出问题】如何通过实验确定碳的氧化物的成分。
【猜想】
(1)
【设计实验】基于猜想3,兴趣小组同学设计了如图实验装置:(已知:氢氧化钠溶液能吸收二氧化碳)
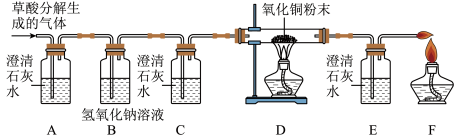
【实验探究】
(2)实验过程中观察到A装置中的澄清石灰水变浑浊,证明草酸分解时有_________ 气体产生。
(3)实验过程中还观察到以下实验现象:
①C装置中澄清石灰水不变浑浊;
②D装置中_________ 。
③E装置中________ ,证明有CO气体。
【实验结论】通过实验探究证明:
(4)在浓硫酸的催化作用下,草酸受热分解的化学方程式_________ 。
【问题讨论】
(5)利用上述实验装置实验时,需要先通入草酸分解生成的气体,一段时间后再加热氧化铜粉末,其目的_________ 。
(6)装置末端酒精灯的作用是_________ 。
【提出问题】如何通过实验确定碳的氧化物的成分。
【猜想】
(1)
| 猜想1 | 猜想2 | 猜想3 |
| 只有CO | 只有 | CO和CO2的混合物 |
【设计实验】基于猜想3,兴趣小组同学设计了如图实验装置:(已知:氢氧化钠溶液能吸收二氧化碳)

【实验探究】
(2)实验过程中观察到A装置中的澄清石灰水变浑浊,证明草酸分解时有
(3)实验过程中还观察到以下实验现象:
①C装置中澄清石灰水不变浑浊;
②D装置中
③E装置中
【实验结论】通过实验探究证明:
(4)在浓硫酸的催化作用下,草酸受热分解的化学方程式
【问题讨论】
(5)利用上述实验装置实验时,需要先通入草酸分解生成的气体,一段时间后再加热氧化铜粉末,其目的
(6)装置末端酒精灯的作用是
您最近一年使用:0次
4 . “蓝瓶子”实验是一个有趣的化学振荡实验:盛有氢氧化钠、亚基甲蓝(C16H18N3SCl)、葡萄糖混合液的试管,经振荡、静置后溶液颜色会出现反复变化(如图1)。

某兴趣小组开展如下探究,回答下列问题。
(1)小明对振荡后溶液变蓝的原因进行如下猜想:①溶液中溶入O2;②溶液中溶入CO2;③溶液中溶入________ (填化学式)。
(2)小红利用图2装置,直接吹入呼出的气体,混合液由无色变蓝色。由此_______ (填“能”或“不能”)得出猜想①正确,原因是______ 。

(3)为探究猜想②,小红又设计了利用碳酸钙和稀盐酸反应制取CO2通入图2装置的方案。该方案中制取CO2的化学方程式为_______ ,气体发生装置应连接的导管口是图2的_______ (选填“A”或“B”)。

某兴趣小组开展如下探究,回答下列问题。
(1)小明对振荡后溶液变蓝的原因进行如下猜想:①溶液中溶入O2;②溶液中溶入CO2;③溶液中溶入
(2)小红利用图2装置,直接吹入呼出的气体,混合液由无色变蓝色。由此

(3)为探究猜想②,小红又设计了利用碳酸钙和稀盐酸反应制取CO2通入图2装置的方案。该方案中制取CO2的化学方程式为
您最近一年使用:0次
5 . 某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛在空气中燃烧、硫磺在氧气中燃烧却有明亮的火焰。该小组同学进行了如下探究。

(1)写出硫磺在氧气中燃烧的符号表达式:_____________ ;基本反应类型为__________ 。
(2)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由____________ (填“固态”或“液体”或“气态”)物质燃烧形成的。
(3)探究二:物质燃烧产生火焰的根本原因是什么?
【查阅资料】
由上表可知:物质燃烧能否产生火焰与其____________ (填“熔点”或“沸点”)和燃烧时温度有关。由此推测:钠在燃烧时,____________ (填“有”或“没有”)火焰产生。
(4)“真金不怕火炼”,黄金加热至熔化(熔点1063.69℃),甚至沸腾(沸点2808),即不会燃烧,也不会变质,其原因可能是_____________ 。

(1)写出硫磺在氧气中燃烧的符号表达式:
(2)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由
(3)探究二:物质燃烧产生火焰的根本原因是什么?
【查阅资料】
| 物质 | 熔点/℃ | 沸点/℃ | 燃烧时温度/℃ |
| 石蜡 | 50~70 | 300~550 | 约600 |
| 铁 | 1535 | 2750 | 约1800 |
| 钠 | 97.8 | 883 | 约1400 |
(4)“真金不怕火炼”,黄金加热至熔化(熔点1063.69℃),甚至沸腾(沸点2808),即不会燃烧,也不会变质,其原因可能是
您最近一年使用:0次
解题方法
6 . 逻辑推理是化学学习常用的思维方法。某校研究性学习小组在做“寻找新的催化剂”课题时,发现将生锈的铁钉放入过氧化氢溶液中,也可以加快过氧化氢的分解速率。于是,他们对此展开探究:
【提出问题】什么物质是该反应的催化剂?
【猜想与假设】
(1)猜想一:铁钉表面的氧化铁是过氧化氢分解的催化剂。
猜想二:铁钉里的_______ 是过氧化氢分解的催化剂。
【进行实验】
(2)请完善下面表格。
【交流讨论】
(3)同学们讨论后一致认为此实验结论不够严谨,实验1还不能够确切地说明氧化铁就是过氧化氢分解的催化剂,理由是_______ 。
【继续探究】
(4)小组同学补做以下实验,进而确认了该实验结论。①实验前称量氧化铁粉末的质量为m1;②完成实验I;③待反应结束,将实验I试管里的物质进行过滤,洗涤,干燥,称悬氧化铁粉末的质量为m2,且m1_______ (选填“>”、“=”或“<”)m2;④把它再加到5%的过氧化氢溶液中,多次重复实验I,仍可观察到相同的实验现象。
【拓展延伸】
(5)为探究氧化铁的催化效果,小组同学将过氧化氢溶液平均分成两等份a和b,只向b中加入少量氧化铁_________(填字母)。
(6)影响过氧化氢分解速率的因素除催化剂外,还可能有_______ (写一种)。
【提出问题】什么物质是该反应的催化剂?
【猜想与假设】
(1)猜想一:铁钉表面的氧化铁是过氧化氢分解的催化剂。
猜想二:铁钉里的
【进行实验】
(2)请完善下面表格。
| 实验操作 | 实验现象 | 实验结论 |
| 实验I:取10mL5%的过氧化氢溶液于试管中,加入一定质量的氧化铁粉末,并将一根带火星的小木条置于试管口,观察现象 | 猜想一成立,发生反应的文字表达式为 | |
| 实验Ⅱ:取10mL5%的过氧化氢溶液于另一支试管中,加入相同质量的铁粉,并将一根带火星的小木条置于试管口,观察现象 | 无明显现象 |
【交流讨论】
(3)同学们讨论后一致认为此实验结论不够严谨,实验1还不能够确切地说明氧化铁就是过氧化氢分解的催化剂,理由是
【继续探究】
(4)小组同学补做以下实验,进而确认了该实验结论。①实验前称量氧化铁粉末的质量为m1;②完成实验I;③待反应结束,将实验I试管里的物质进行过滤,洗涤,干燥,称悬氧化铁粉末的质量为m2,且m1
【拓展延伸】
(5)为探究氧化铁的催化效果,小组同学将过氧化氢溶液平均分成两等份a和b,只向b中加入少量氧化铁_________(填字母)。
A. | B. | C. | D. |
(6)影响过氧化氢分解速率的因素除催化剂外,还可能有
您最近一年使用:0次
7 . 某化学兴趣小组对氯酸钾热分解温度的测定产生兴趣,根据题意完成实验探究。
一、探究氯酸钾的分解温度
【阅读资料】氯酸钾的熔点为356℃,用酒精灯给物质加热,受热物质的温度一般约为400℃。
【进行实验】

I.取一支大试管,向其中加入大约4.0g氯酸钾(含结晶水),固定在铁架台上(如图1)。
Ⅱ.把氧气体积分数传感器探头小心地插入试管内,连接数据采集器(已知氧气体积分数传感器超过最大测量值时将拉成一条直线)。
Ⅲ.点燃酒精灯加热试管,数据采集器得到的氧气体积分数随温度的变化图像如图2所示。
【分析讨论】
(1)实验时试管口略向下倾斜的原因是______________ ,试管中发生的反应的文字表达式为_______________ 。
(2)分析图2,加热前大试管内的空气中氧气体积分数约为20.8%,刚开始加热时,试管内温度不断上升,但氧气的体积分数却略有下降,原因是_______________ 。
(3)在温度达到356℃时,氯酸钾开始熔化,温度还未到达400℃,氧气体积分数曲线就不再上升,原因是______________ ,此时______________ (选填“有”或“没有”)氧气生成。
【实验结论】
(4)重复多次实验,得到的数据都如图2所示,由此得出结论:氯酸钾分解温度和熔点温度______________ (选填“接近”或“不接近”)。
二、探究氯酸钾与二氧化锰的质量配比对氯酸钾分解的影响
【继续探究】甲同学提出猜想:氯酸钾分解产生氧气时,如果使用催化剂,不论催化剂量的多少,催化效果是一样的。于是兴趣小组按照氯酸钾与二氧化锰不同的质量配比,按照图1所示装置继续进行实验,得到不同质量配比时氧气体积分数随温度变化图像如图3所示。

(5)根据图3可知,甲同学的猜想______________ (选填“正确”或“不正确”),参照数据,从节约药品角度看,在实验室制取氧气时,氯酸钾与二氧化锰质量比以______________ 为宜。
(6)实验结束后,若要回收二氧化锰,可采用的实验方法是_______________ 。
一、探究氯酸钾的分解温度
【阅读资料】氯酸钾的熔点为356℃,用酒精灯给物质加热,受热物质的温度一般约为400℃。
【进行实验】

I.取一支大试管,向其中加入大约4.0g氯酸钾(含结晶水),固定在铁架台上(如图1)。
Ⅱ.把氧气体积分数传感器探头小心地插入试管内,连接数据采集器(已知氧气体积分数传感器超过最大测量值时将拉成一条直线)。
Ⅲ.点燃酒精灯加热试管,数据采集器得到的氧气体积分数随温度的变化图像如图2所示。
【分析讨论】
(1)实验时试管口略向下倾斜的原因是
(2)分析图2,加热前大试管内的空气中氧气体积分数约为20.8%,刚开始加热时,试管内温度不断上升,但氧气的体积分数却略有下降,原因是
(3)在温度达到356℃时,氯酸钾开始熔化,温度还未到达400℃,氧气体积分数曲线就不再上升,原因是
【实验结论】
(4)重复多次实验,得到的数据都如图2所示,由此得出结论:氯酸钾分解温度和熔点温度
二、探究氯酸钾与二氧化锰的质量配比对氯酸钾分解的影响
【继续探究】甲同学提出猜想:氯酸钾分解产生氧气时,如果使用催化剂,不论催化剂量的多少,催化效果是一样的。于是兴趣小组按照氯酸钾与二氧化锰不同的质量配比,按照图1所示装置继续进行实验,得到不同质量配比时氧气体积分数随温度变化图像如图3所示。

(5)根据图3可知,甲同学的猜想
(6)实验结束后,若要回收二氧化锰,可采用的实验方法是
您最近一年使用:0次
2023-12-09更新
|
62次组卷
|
2卷引用:安徽省芜湖市无为市部分学校2023-2024学年九年级上学期11月期中化学试题
解题方法
8 . 过碳酸钠是一种清洁剂,多用在抗震、抗疫等工作中,其化学式为2Na2CO3·3H2O2,外观为白色固体,具有Na2CO3和H2O2的双重性质。
【探究I】过碳酸钠溶于水放热后产生气体的成分
【猜想与假设】猜想一:H2;猜想二:CO2;猜想三:O2
【实验验证】取少量该清洁剂于试管中,向其中加入热水,塞上带导管的橡皮塞,用点燃的木条点燃生成的气体,发现木条燃烧更旺,没有出现蓝色的火焰;再通入澄清的石灰水,没有明显现象;打开橡皮塞,接下来的操作和观察到的现象是______ ,从而证明猜想三正确。
【探究Ⅱ】过碳酸钠溶于水后得到的无色液体的成分
【猜想与假设】猜想一:NaOH;猜想二:______ 。
猜想三:NaOH和Na2CO3
【实验验证】如图所示:

【反思评价】
(1)通过实验操作(1)证明猜想一正确的说法不科学,理由是______ 。
(2)下列物质能使过碳酸钠失效的是______ 。
A.二氧化锰 B.氢氧化钠 C.氯化钠 D.盐酸
【探究I】过碳酸钠溶于水放热后产生气体的成分
【猜想与假设】猜想一:H2;猜想二:CO2;猜想三:O2
【实验验证】取少量该清洁剂于试管中,向其中加入热水,塞上带导管的橡皮塞,用点燃的木条点燃生成的气体,发现木条燃烧更旺,没有出现蓝色的火焰;再通入澄清的石灰水,没有明显现象;打开橡皮塞,接下来的操作和观察到的现象是
【探究Ⅱ】过碳酸钠溶于水后得到的无色液体的成分
【猜想与假设】猜想一:NaOH;猜想二:
猜想三:NaOH和Na2CO3
【实验验证】如图所示:

| 实验结论 | 实验操作 | 实验现象 |
| (1)取少量溶液于试管中,滴入几滴酚酞溶液 | 猜想一正确 | |
| (2)向完成(1)实验的溶液中加入足量的CaCl2溶液 | 产生白色沉淀,溶液为无色,发生反应的化学方程式为 | 猜想 |
(1)通过实验操作(1)证明猜想一正确的说法不科学,理由是
(2)下列物质能使过碳酸钠失效的是
A.二氧化锰 B.氢氧化钠 C.氯化钠 D.盐酸
您最近一年使用:0次
9 . 纯碱是种重要的化 工原料,广泛用于玻璃造纸、纺织和洗涤剂的生产。某化学兴趣小组对纯碱的制备、性质及用途等开展项目式学习。
【任务一】了解纯碱的制备——“侯氏制碱法”
(1)“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱。饱和氯化钠溶液吸收的两种气体是CO2和______ (填字母序号)。
【任务二】探究纯碱的性质——Na2CO3溶液呈碱性
【查阅资料】①溶液呈碱性,是因为溶液中存在较多的OH-;②Na2CO3在水中全部解离出Na+和 ;③CaCl2溶液呈中性。
;③CaCl2溶液呈中性。
【提出猜想】
(2)猜想:H2O 单独起作用,产生较多的OH-,使溶液呈碱性;猜想二:Na+与H2O作用,产生较多的OH-,使溶液呈碱性;猜想三:___________ ,使溶液呈碱性。
【实验探究】
(3)
【反思与交流】
(4)写出②中发生反应的化学方程式:______ 。
【任务三】探究纯碱的用途——用于生产洗涤剂
【查阅资料】Na2CO3可用于生产洗涤剂,用来清洗油污。Na2CO3溶液碱性越强,去油污效果越好。
【实验探究】兴趣小组继续对影响Na2CO3溶液去油污效果的影响因素进行探究。
用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,并测定溶液pH,记录数据如下表:
【解释与结论】
(5)实验①、②、③对比,可得出的结论是_____________ 。
(6)要探究Na2CO3溶液的溶质质量分数与去油污效果的关系,可选择的3个实验的编号是_________ 。
(7)已知稀盐酸和石灰石反应后废液中的溶质是CaCl2和HCl,小组同学决定用Na2CO3除去它们。取100mL废液样品于烧杯中,逐滴滴加5.3%的Na2CO3溶液,用pH传感器测定滴加过程中溶液的pH。实验结果如图所示。

【结果讨论】
①a→b阶段,观察到烧杯中的现象是______________ 。
②c点时,取少量烧杯中的清液于试管中,滴加CaCl2溶液,有白色沉淀生成,说明处理100 mL废液,所需5.3%的Na2CO3溶液的体积_________ 120 mL(填“大于”、“等于”或“小于”)。
③将烧杯中的沉淀过滤、洗涤、干燥称重,质量为4 g,若处理1 L该废液,理论上需要Na2CO3固体___ g(实验所用Na2CO3溶液的密度近似看作1 g/cm3)。
【任务一】了解纯碱的制备——“侯氏制碱法”
(1)“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱。饱和氯化钠溶液吸收的两种气体是CO2和______ (填字母序号)。
| A.Cl2 | B.NH3 | C.SO2 |
【任务二】探究纯碱的性质——Na2CO3溶液呈碱性
【查阅资料】①溶液呈碱性,是因为溶液中存在较多的OH-;②Na2CO3在水中全部解离出Na+和
 ;③CaCl2溶液呈中性。
;③CaCl2溶液呈中性。【提出猜想】
(2)猜想:H2O 单独起作用,产生较多的OH-,使溶液呈碱性;猜想二:Na+与H2O作用,产生较多的OH-,使溶液呈碱性;猜想三:
【实验探究】
(3)
| 实验操作 | 实验现象 | 实验结论 |
| 向试管中加入一定量的蒸馏水,滴入2滴酚酞溶液 | 溶液无明显变化 | 猜想一不成立 |
| 向试管中加入一定量的NaCl溶液,滴入2滴酚酞溶液 | 溶液无明显变化 | 猜想二不成立 |
| ①向试管中加入定量的Na2CO3溶液,滴入2滴酚酞溶液 ②往①所得溶液中逐滴加入CaCl2溶液至过量 | ①溶液由无色变红色 ② | 猜想三成立 |
【反思与交流】
(4)写出②中发生反应的化学方程式:
【任务三】探究纯碱的用途——用于生产洗涤剂
【查阅资料】Na2CO3可用于生产洗涤剂,用来清洗油污。Na2CO3溶液碱性越强,去油污效果越好。
【实验探究】兴趣小组继续对影响Na2CO3溶液去油污效果的影响因素进行探究。
用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,并测定溶液pH,记录数据如下表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 溶质质量分数 | 2% | 2% | 2% | 6% | 6% | 6% | 10% | 10% | 10% |
| 溶液温度(℃) | 20 | 40 | 60 | 20 | 50 | 60 | 20 | 40 | 70 |
| 溶液pH | 10.90 | 11.18 | 11.26 | 11.08 | 11.27 | 11.30 | 11.22 | 11.46 | 11.50 |
(5)实验①、②、③对比,可得出的结论是
(6)要探究Na2CO3溶液的溶质质量分数与去油污效果的关系,可选择的3个实验的编号是
(7)已知稀盐酸和石灰石反应后废液中的溶质是CaCl2和HCl,小组同学决定用Na2CO3除去它们。取100mL废液样品于烧杯中,逐滴滴加5.3%的Na2CO3溶液,用pH传感器测定滴加过程中溶液的pH。实验结果如图所示。

【结果讨论】
①a→b阶段,观察到烧杯中的现象是
②c点时,取少量烧杯中的清液于试管中,滴加CaCl2溶液,有白色沉淀生成,说明处理100 mL废液,所需5.3%的Na2CO3溶液的体积
③将烧杯中的沉淀过滤、洗涤、干燥称重,质量为4 g,若处理1 L该废液,理论上需要Na2CO3固体
您最近一年使用:0次
名校
解题方法
10 . 某研究性学习小组在验证“碱使酚酞溶液变红”的实验时,发现将酚酞溶液滴入NaOH溶液中,溶液变成了红色,可是过一会儿红色却消失了。下列对产生此异常现象原因的猜想不合理的是
| A.可能是酚酞与O2发生了反应 |
| B.可能是NaOH与空气中的CO2发生了反应 |
| C.可能与NaOH溶液的浓度大小有关 |
| D.可能是使用的容器中有盐酸残留 |
您最近一年使用:0次
2023-06-25更新
|
56次组卷
|
3卷引用:2023年安徽省亳州市蒙城县部分学校4月中考模拟联考化学试题



