名校
解题方法
1 . 农药波尔多液是常见的杀菌剂,为天蓝色碱性悬浊液。以硫酸铜、生石灰及水为原料,制备波尔多液。
(一)硫酸铜的制备
下图为某兴趣小组用含较多杂质的铜粉制取硫酸铜晶体[CuSO4· 5H2O]的两种实验方案。
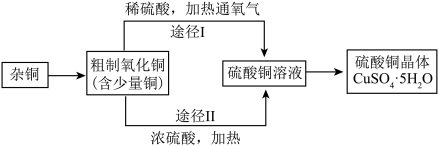
(1)方案Ⅰ通入氧气,少量Cu转化为CuSO4,该反应的化学方程式为_____ 。
(2)方案Ⅱ中加入浓硫酸发生的反应有Cu+2H2SO(浓) CuSO4+SO2↑+2H2O。方案Ⅰ优于方案Ⅱ的理由是
CuSO4+SO2↑+2H2O。方案Ⅰ优于方案Ⅱ的理由是______ 。
(二)波尔多液的制备及组成测定
为测定从波尔多液分离出来的天蓝色固体[CuSO4·aCu(OH)2·bCa(OH)2·cH2O]的组成,设计如下实验:
【实验1】称取64.4g天蓝色固体,加入足量稀硝酸使其完全溶解,再加入过量硝酸钡溶液,过滤,洗涤干燥得到白色固体23.3g。
(3)判断硝酸钡溶液已过量的方法是:静置,往上层清液中滴加______ (填化学式)溶液,无明显现象。
【实验2】另取64.4g天蓝色固体,用下列装置进行热分解实验:
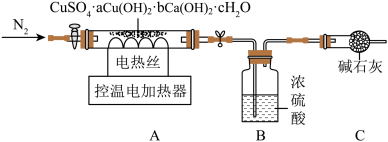
【资料】①CuSO4、Cu(OH)2、Ca(OH)2在一定温度下能受热分解,分别生成两种氧化物,分解过程中各元素的化合价均不改变。②天蓝色固体在110℃时,完全失去结晶水。③Cu(OH)2在100℃时分解完全。CuSO4和Ca(OH)2在580℃左右时开始分解,到650℃时均能分解完全。④浓硫酸可用于吸收SO3。
(4)按图连接好装置,实验前要先______ 。
(5)控制温度在110℃充分加热,测得B装置增重10.8g。再升温至650℃充分加热,B装置又增重了15.2g。最终剩余固体中的成分是________ 。
(6)整个加热过程中,天蓝色固体分解生成水的总质量为____ g。
(7)天蓝色固体[CuSO4·aCu(OH)2·bCa(OH)2·cH2O]中,a:b:c=______ 。
(一)硫酸铜的制备
下图为某兴趣小组用含较多杂质的铜粉制取硫酸铜晶体[CuSO4· 5H2O]的两种实验方案。

(1)方案Ⅰ通入氧气,少量Cu转化为CuSO4,该反应的化学方程式为
(2)方案Ⅱ中加入浓硫酸发生的反应有Cu+2H2SO(浓)
 CuSO4+SO2↑+2H2O。方案Ⅰ优于方案Ⅱ的理由是
CuSO4+SO2↑+2H2O。方案Ⅰ优于方案Ⅱ的理由是(二)波尔多液的制备及组成测定
为测定从波尔多液分离出来的天蓝色固体[CuSO4·aCu(OH)2·bCa(OH)2·cH2O]的组成,设计如下实验:
【实验1】称取64.4g天蓝色固体,加入足量稀硝酸使其完全溶解,再加入过量硝酸钡溶液,过滤,洗涤干燥得到白色固体23.3g。
(3)判断硝酸钡溶液已过量的方法是:静置,往上层清液中滴加
【实验2】另取64.4g天蓝色固体,用下列装置进行热分解实验:

【资料】①CuSO4、Cu(OH)2、Ca(OH)2在一定温度下能受热分解,分别生成两种氧化物,分解过程中各元素的化合价均不改变。②天蓝色固体在110℃时,完全失去结晶水。③Cu(OH)2在100℃时分解完全。CuSO4和Ca(OH)2在580℃左右时开始分解,到650℃时均能分解完全。④浓硫酸可用于吸收SO3。
(4)按图连接好装置,实验前要先
(5)控制温度在110℃充分加热,测得B装置增重10.8g。再升温至650℃充分加热,B装置又增重了15.2g。最终剩余固体中的成分是
(6)整个加热过程中,天蓝色固体分解生成水的总质量为
(7)天蓝色固体[CuSO4·aCu(OH)2·bCa(OH)2·cH2O]中,a:b:c=
您最近一年使用:0次
2022-07-10更新
|
512次组卷
|
3卷引用:新疆乌鲁木齐市部分校2023-2024学年九年级上学期期末化学试题
2 . 实验室可利用大理石与稀盐酸的反应制取CO2。
(1)碳酸钙与稀盐酸反应的化学方程式为_______ 。
(2)题图1所示的仪器A、D的名称为_______ 、_______ ,组装制取CO2的发生装置应选用的仪器为_______ (填字母)。
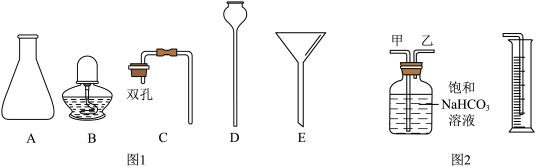
(3)为收集并准确测量CO2的体积,在装入药品前,需检查装置的_______ 。
(4)相同条件下CO2密度比空气大,利用该性质可以通过_______ 法收集CO2,若用图2所示装置测量生成CO2的体积,CO2应从_______ (填“甲”或“乙”)管通入。
(5)图(I)中瓶a内含4.38gHCl的盐酸,b是未充气的气球,里边放有4克碳酸钙粉未,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气)。将图(Ⅰ)的装置在托盘天平上称盘,质量为w1克。
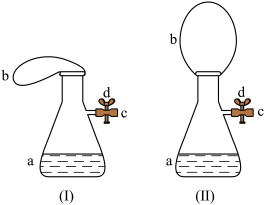
①把气球中的碳酸钙粉末小心地倒入瓶中,立即产生许多气泡,气球逐渐胀大(图Ⅱ)。反应结束后,再次称量,质量为w2克。则w2_______ w1(填“>”“<”或“=”)。
②取含6 g NaOH的溶液,先用滴管取少NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气)。打开d,将溶液挤入瓶中,立即夹紧d。可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失。用同样方法再加入少量NaOH溶液,又产生白色沉淀,轻摇,沉淀又消失,使沉淀消失的反应的化学方程式是_______ 。
③将全部NaOH溶液很快加入瓶中,夹紧d,瓶内产生大量白色沉淀,不再溶解。
④继续轻摇瓶a,气球逐渐_______ (填“变大”或“变小”)。
(1)碳酸钙与稀盐酸反应的化学方程式为
(2)题图1所示的仪器A、D的名称为

(3)为收集并准确测量CO2的体积,在装入药品前,需检查装置的
(4)相同条件下CO2密度比空气大,利用该性质可以通过
(5)图(I)中瓶a内含4.38gHCl的盐酸,b是未充气的气球,里边放有4克碳酸钙粉未,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气)。将图(Ⅰ)的装置在托盘天平上称盘,质量为w1克。

①把气球中的碳酸钙粉末小心地倒入瓶中,立即产生许多气泡,气球逐渐胀大(图Ⅱ)。反应结束后,再次称量,质量为w2克。则w2
②取含6 g NaOH的溶液,先用滴管取少NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气)。打开d,将溶液挤入瓶中,立即夹紧d。可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失。用同样方法再加入少量NaOH溶液,又产生白色沉淀,轻摇,沉淀又消失,使沉淀消失的反应的化学方程式是
③将全部NaOH溶液很快加入瓶中,夹紧d,瓶内产生大量白色沉淀,不再溶解。
④继续轻摇瓶a,气球逐渐
您最近一年使用:0次
2022-05-26更新
|
281次组卷
|
2卷引用:2020年新疆乌鲁木齐市第六十八中学中考二模化学试题
名校
解题方法
3 . 过氧化镁(化学式是MgO2)在医学上可作为“解酸剂”,过氧化镁产品中常混有MgO。
【实验目的】测定某过氧化镁样品中MgO2的质量分数。
【实验原理】过氧化镁与稀盐酸反应: ,同时放出大量热。
,同时放出大量热。
【查阅资料】Cu(OH)2等难溶性碱受热时能分解成对应的金属氧化物和水,化学方程式为______ 。
【实验装置】

【实验步骤】
①______ ;
②称取0.70g样品,与少量MnO2粉末混合均匀后装入锥形瓶,如图1搭好装置;
③调节量气管高度,使左右两侧水面相平;
④打开分液漏斗活塞,将稀盐酸全部滴入锥形瓶后立即关闭活塞;
⑤等锥形瓶中无气泡冒出时,调节量气管使左右两侧液面相平,立即读数;
⑥对锥形瓶中剩余物进行相关操作。
【交流反思】
(1)步骤②中,MnO2的作用是______ 。
(2)图1中长颈漏斗上端的橡胶管的作用是______
【数据处理】
(3)反应前后量筒内液面如图2所示,则实验收集到气体体积为______ mL。
(4)用气体体积计算时,所得样品中MgO2的质量分数偏大,可能原因是______ 。
A.锥形瓶中无气泡产生时立即读数
B.读数时,调节量气管高度,使左右两侧水面相平
C.实验开始前,量气管内空气未排尽
(5)若步骤⑥的相关操作是:过滤,向滤液中滴加______ 溶液至沉淀完全,再过滤、洗涤,将滤渣充分灼烧,最终得到0.54g固体,请写出灼烧时发生的化学反应方程式______ ,则样品中过氧化镁的质量分数是______ %。
【实验目的】测定某过氧化镁样品中MgO2的质量分数。
【实验原理】过氧化镁与稀盐酸反应:
 ,同时放出大量热。
,同时放出大量热。【查阅资料】Cu(OH)2等难溶性碱受热时能分解成对应的金属氧化物和水,化学方程式为
【实验装置】

【实验步骤】
①
②称取0.70g样品,与少量MnO2粉末混合均匀后装入锥形瓶,如图1搭好装置;
③调节量气管高度,使左右两侧水面相平;
④打开分液漏斗活塞,将稀盐酸全部滴入锥形瓶后立即关闭活塞;
⑤等锥形瓶中无气泡冒出时,调节量气管使左右两侧液面相平,立即读数;
⑥对锥形瓶中剩余物进行相关操作。
【交流反思】
(1)步骤②中,MnO2的作用是
(2)图1中长颈漏斗上端的橡胶管的作用是
【数据处理】
(3)反应前后量筒内液面如图2所示,则实验收集到气体体积为
(4)用气体体积计算时,所得样品中MgO2的质量分数偏大,可能原因是
A.锥形瓶中无气泡产生时立即读数
B.读数时,调节量气管高度,使左右两侧水面相平
C.实验开始前,量气管内空气未排尽
(5)若步骤⑥的相关操作是:过滤,向滤液中滴加
您最近一年使用:0次
名校
解题方法
4 . 关于盐的性质研究是一项重要的课题。某兴趣小组以“探究碳酸氢钠的性质”为主题开展项目式学习。
【任务一】认识碳酸氢钠
(1)下列关于碳酸氢钠的说法正确的是_______ 。
A.碳酸氢钠是由Na+和HCO3-构成
B.碳酸氢钠俗称纯碱
C.碳酸氢钠难溶于水
D.碳酸氢钠医疗上能用于治疗胃酸过多症
【任务二】探究碳酸氢钠的性质
(2)探究碳酸氢钠与稀盐酸反应:兴趣小组取适量碳酸氢钠粉末于甲试管中,加入稀盐酸,如图1所示。观察到甲试管中有气泡产生,乙中_______ ,说明碳酸氢钠能与稀盐酸反应生成二氧化碳,写出试管甲中反应的化学方程式_______ 。
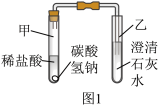
(3)探究碳酸氢钠的热稳定性:用酒精灯充分加热玻璃管,如图2所示。
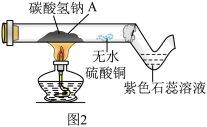
资料:无水硫酸铜呈白色,遇水后呈蓝色
①发现玻璃管内无水硫酸铜变蓝,紫色石蕊溶液变红,说明碳酸氢钠受热易分解,且有_____ 和二氧化碳生成。
②实验后兴趣小组同学猜想玻璃管A处固体产物仅是Na2CO3而不含有NaOH,请设计实验证明____ (写出具体步骤和现象)。
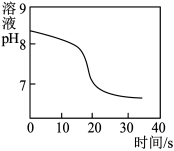
(4)常温下,兴趣小组同学取一定量的NaHCO3溶液于烧杯中,插入pH传感器,向烧杯中持续滴加CaCl2溶液,有白色沉淀生成,当溶液的pH变为6.68时开始有无色气体产生。反应过程中溶液的pH随时间变化如图所示。
【查阅资料】
材料一:NaHCO3溶于水后,少量的HCO3-能同时发生如下变化:
变化①: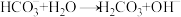
变化②: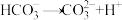
材料二:溶液的酸碱性与溶液中H+和OH-数目的相对大小有关。常温下,当单位体积溶液中OH-的数目大于H+的数目时溶液的pH>7,反之pH<7;单位体积溶液中所含的H+数目越大,溶液的pH越小。
①根据上述实验可知NaHCO3溶液显碱性,结合材料一、二从微观角度说明原因:
_______ 。
②根据本实验,可知从0~30s,单位体积溶液中H+数目不断_______ (填“增大”或“减小”),你认为能不能用CaCl2溶液鉴别Na2CO3和NaHCO3溶液,若不能请说明理由:_______ 。
【任务一】认识碳酸氢钠
(1)下列关于碳酸氢钠的说法正确的是
A.碳酸氢钠是由Na+和HCO3-构成
B.碳酸氢钠俗称纯碱
C.碳酸氢钠难溶于水
D.碳酸氢钠医疗上能用于治疗胃酸过多症
【任务二】探究碳酸氢钠的性质
(2)探究碳酸氢钠与稀盐酸反应:兴趣小组取适量碳酸氢钠粉末于甲试管中,加入稀盐酸,如图1所示。观察到甲试管中有气泡产生,乙中

(3)探究碳酸氢钠的热稳定性:用酒精灯充分加热玻璃管,如图2所示。

资料:无水硫酸铜呈白色,遇水后呈蓝色
①发现玻璃管内无水硫酸铜变蓝,紫色石蕊溶液变红,说明碳酸氢钠受热易分解,且有
②实验后兴趣小组同学猜想玻璃管A处固体产物仅是Na2CO3而不含有NaOH,请设计实验证明
(4)常温下,兴趣小组同学取一定量的NaHCO3溶液于烧杯中,插入pH传感器,向烧杯中持续滴加CaCl2溶液,有白色沉淀生成,当溶液的pH变为6.68时开始有无色气体产生。反应过程中溶液的pH随时间变化如图所示。

【查阅资料】
材料一:NaHCO3溶于水后,少量的HCO3-能同时发生如下变化:
变化①:
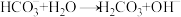
变化②:
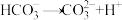
材料二:溶液的酸碱性与溶液中H+和OH-数目的相对大小有关。常温下,当单位体积溶液中OH-的数目大于H+的数目时溶液的pH>7,反之pH<7;单位体积溶液中所含的H+数目越大,溶液的pH越小。
①根据上述实验可知NaHCO3溶液显碱性,结合材料一、二从微观角度说明原因:
②根据本实验,可知从0~30s,单位体积溶液中H+数目不断
您最近一年使用:0次
2022-05-17更新
|
359次组卷
|
3卷引用:2021年新疆乌鲁木齐市农大附中中考三模化学试题
5 . 研究二氧化碳气体的制备及相关性质。
Ⅰ.制取二氧化碳气体
(1)写出实验室用石灰石与稀盐酸反应制取二氧化碳的化学方程式________ 。用向上排空气法收集二氧化碳的原因是__________ 。
(2)实验室制取气体的一般思路和方法:
①选择适当的反应,包括_________ ;
②选择合适的_________ ;
③验证所制得的气体。
(3)小明为验证制得的气体是二氧化碳,将反应生成的气体通入盛有少量澄清石灰水的试管中,观察到澄清石灰水没有变浑浊,小明猜想可能是盐酸具有________ ,制取的二氧化碳中常混有少量________ 气体(填名称)。为使验证实验成功,可将气体先通过足量的________ (填字母),再通入少量澄清石灰水中,观察到预期的现象,证明是二氧化碳。
A. 氢氧化钠溶液 B. 碳酸氢钠溶液 C. 硝酸银溶液
Ⅱ.实验结束清洗仪器,小明同学发现试管中变浑浊的石灰水又澄清了这一异常现象。
【查阅资料】
①二氧化碳与水、碳酸钙能通过化合反应生成碳酸氢钙,碳酸氢钙可溶于水。
②电导率传感器用于测量溶液的导电性强弱,相同温度下同种溶液离子浓度越大,电导率越大。
③浊度传感器用于测量溶液中悬浮物的多少,悬浮物越多则透光率越小,浊度值越小,溶液透明时浊度值(透光率)为100%。
【实验验证】
该同学将制得的二氧化碳持续通入少量澄清石灰水中,用电导率传感器采集数据,如图所示。
(1)实验中0~10 s澄清石灰水变浑浊、溶液电导率降低的原因是________ (用化学方程式表示)。
(2)10 s后浑浊的液体又逐渐变澄清、溶液的电导率上升,是因为_________ 。
【实验再探究】
若同时使用浊度传感器测定反应过程中澄清石灰水混浊的情况,反应过程中溶液浊度与时间变化的曲线如图,下列说法不正确的是_______ (填字母)。
B.BC段浊度上升,此过程发生的反应与AB段的不同
C.最终溶液并未完全澄清
Ⅰ.制取二氧化碳气体
(1)写出实验室用石灰石与稀盐酸反应制取二氧化碳的化学方程式
(2)实验室制取气体的一般思路和方法:
①选择适当的反应,包括
②选择合适的
③验证所制得的气体。
(3)小明为验证制得的气体是二氧化碳,将反应生成的气体通入盛有少量澄清石灰水的试管中,观察到澄清石灰水没有变浑浊,小明猜想可能是盐酸具有
A. 氢氧化钠溶液 B. 碳酸氢钠溶液 C. 硝酸银溶液
Ⅱ.实验结束清洗仪器,小明同学发现试管中变浑浊的石灰水又澄清了这一异常现象。
【查阅资料】
①二氧化碳与水、碳酸钙能通过化合反应生成碳酸氢钙,碳酸氢钙可溶于水。
②电导率传感器用于测量溶液的导电性强弱,相同温度下同种溶液离子浓度越大,电导率越大。
③浊度传感器用于测量溶液中悬浮物的多少,悬浮物越多则透光率越小,浊度值越小,溶液透明时浊度值(透光率)为100%。
【实验验证】
该同学将制得的二氧化碳持续通入少量澄清石灰水中,用电导率传感器采集数据,如图所示。
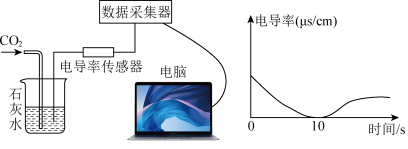
(1)实验中0~10 s澄清石灰水变浑浊、溶液电导率降低的原因是
(2)10 s后浑浊的液体又逐渐变澄清、溶液的电导率上升,是因为
【实验再探究】
若同时使用浊度传感器测定反应过程中澄清石灰水混浊的情况,反应过程中溶液浊度与时间变化的曲线如图,下列说法不正确的是

B.BC段浊度上升,此过程发生的反应与AB段的不同
C.最终溶液并未完全澄清
您最近一年使用:0次
2022-05-12更新
|
685次组卷
|
9卷引用:2021年新疆乌鲁木齐市师大附中中考二模化学试题
2021年新疆乌鲁木齐市师大附中中考二模化学试题2020年乌鲁木齐市第四十四中学中考一模化学试题2022年江苏省南京市联合体中考一模化学试题(已下线)2023年中考风向标-江苏-科学探究(已下线)金榜卷03-2023年中考化学考前一模名师押题金榜卷(南京专用)2024年江苏省南京市江宁区中考模拟化学试卷 (已下线)专题11? 实验探究题(六大题型)-2024年中考化学二轮热点题型归纳与变式演练(江苏通用)(已下线)押南京卷非选择题第21题 科学探究-备战2024年中考化学临考题号押题(南京专用)(已下线)押广州卷第19题 非选择题-备战2024年中考化学临考题号押题(广州卷)
解题方法
6 . 足球比赛会用到“嗅盐”让昏迷球员快速恢复意识。同学们对嗅盐产生了好奇,并对其成分进行如下探究。
【查阅资料】(1)嗅盐是由一种盐类物质和香料(香料不参与以下探究中的任何反应)组成,能释放出氨味气体,对人体神经会产生强烈的刺激作用,过量吸入会危害健康。
(2)氯化钙稀溶液与碳酸氢铵溶液不发生反应。
(3)氨气极易溶于水,且能与硫酸化合生成硫酸铵。
【提出问题】嗅盐中盐类物质是什么?
【实验探究】
【反思与评价】小海认为小珠最后的实验结论不严谨,理由是:______ 。
小海通过补做如下实验,进而确认了小珠的结论。
【再探究】小湖利用下图所示装置测定嗅盐中碳酸铵的质量分数(碳酸铵受热分解可生成两种气体和常温下呈液态的一种氧化物)
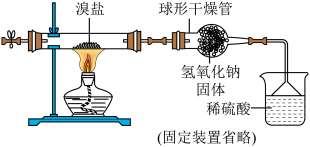
【实验步骤】①稍加热溴盐,使其充分分解。②反应结束后,向双通管通入一段时间的空气。
【数据记录】实验称取溴盐样品质量为m1,反应前、后烧杯及烧杯内溶液的总质量分别为m2和m3。
【实验分析及数据处理】碳酸铵受热分解的化学方程式为_______ 。,通过测得数据计算出嗅盐中碳酸铵的质量分数为________ (用m1、m2、m3表示)。
【反思与评价】小湖的实验装置中倒置的漏斗既可以_______ ,又可以防止倒吸,同时还可防止氨气污染环境。
【查阅资料】(1)嗅盐是由一种盐类物质和香料(香料不参与以下探究中的任何反应)组成,能释放出氨味气体,对人体神经会产生强烈的刺激作用,过量吸入会危害健康。
(2)氯化钙稀溶液与碳酸氢铵溶液不发生反应。
(3)氨气极易溶于水,且能与硫酸化合生成硫酸铵。
【提出问题】嗅盐中盐类物质是什么?
【实验探究】
| 小珠的实验方案 | 现象 | 结论 |
 嗅盐与 | 闻到刺激性气味且试纸变 | 嗅盐中含有 |
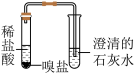 | 嗅盐中含有 ,嗅盐是(NH4)CO3 ,嗅盐是(NH4)CO3 |
小海通过补做如下实验,进而确认了小珠的结论。
| 小海的实验方案 | 现象 | 结论 |
 | 有白色沉淀出现 | 小海的实验目的是排除溴盐中含有 |

【实验步骤】①稍加热溴盐,使其充分分解。②反应结束后,向双通管通入一段时间的空气。
【数据记录】实验称取溴盐样品质量为m1,反应前、后烧杯及烧杯内溶液的总质量分别为m2和m3。
【实验分析及数据处理】碳酸铵受热分解的化学方程式为
【反思与评价】小湖的实验装置中倒置的漏斗既可以
您最近一年使用:0次
2021-08-10更新
|
190次组卷
|
2卷引用:2021年新疆乌鲁木齐市第十三中学中考一模化学试题
解题方法
7 . 下列实验方法能达到实验目的的是
| 实验目的 | 试验方法 | |
| A | 鉴别氮气和二氧化碳 | 用燃着的木条伸入集气瓶中 |
| B | 除去二氧化碳中混有的氯化氢气体 | 加入过量的氢氧化钠溶液,干燥 |
| C | 鉴别小苏打和苏打 | 分别加热并将气体产物通入澄清石灰水 |
| D | 探究锌、铁、铜三种金属的活动性顺序 | 把铜和锌分别放入硫酸铁溶液中 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-07-22更新
|
308次组卷
|
3卷引用:2021年新疆乌鲁木齐市沙依巴克区中考三模化学试题
8 . (1)在1800年,某科学家利用“伏打电池”在常温下对水进行通电分解,当正极产生了10mL的___________ ,负极产生的气体约为___________ mL,再次确认了水的组成。
(2)《茶疏》中对泡茶过程有如下记载:“治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶……”,以上过程涉及的操作有溶解、过滤等;在实验室进行过滤操作时玻璃棒的作用是___________ ,过滤时液面高于滤纸边缘会造成的后果是___________ 。过滤___________ (填“能”或“不能”)将硬水软化。
(3)如图为A、B、C三种固体物质的溶解度曲线,根据图回答下列问题:
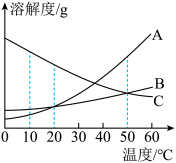
①10℃时,A、B、C三种物质中溶解度最大的是___________ 。
②若A中含有少量B时,可用___________ 的方法提纯A。
③将等质量的A、B、C饱和溶液由50℃降温到20℃时,所得溶液中溶质质量由大到小的顺序为___________ 。
(2)《茶疏》中对泡茶过程有如下记载:“治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶……”,以上过程涉及的操作有溶解、过滤等;在实验室进行过滤操作时玻璃棒的作用是
(3)如图为A、B、C三种固体物质的溶解度曲线,根据图回答下列问题:

①10℃时,A、B、C三种物质中溶解度最大的是
②若A中含有少量B时,可用
③将等质量的A、B、C饱和溶液由50℃降温到20℃时,所得溶液中溶质质量由大到小的顺序为
您最近一年使用:0次
2021-06-18更新
|
1363次组卷
|
6卷引用:2020年新疆乌鲁木齐市第一一三中学中考三模化学试题
2020年新疆乌鲁木齐市第一一三中学中考三模化学试题2021年云南省昆明市中考化学试题(已下线)专题12 溶液-2021年中考化学真题分项汇编(全国通用)(第01期)(已下线)图形图像数据分析专题(已下线)溶液-专题(已下线)2023年中考风向标+云南+溶解度曲线
9 . 溶液与人们的生产、生活密切相关。
(1)A、B、C三种固体物质的溶解度曲线如图所示,回答下列问题。

①t1℃时,溶解度等于20g的物质为___________ (填字母);
②t2℃时,向盛有50gB物质的烧杯中加入100g水,充分溶解后,所得溶液的质量______ 150g(填“>”、“<”或“=”);
③t1℃时,A、B、C三种物质饱和溶液升温到t2℃后,溶液中溶质质量分数由大到小的顺序是_____ 。
④t2℃时,300gA物质的饱和溶液降温到t1℃时,析出晶体的质量是___________ g。
(2)配制50g质量分数为15%的氯化钠溶液:
①溶解过程中玻璃棒的作用是___________ 。
②对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有___________ 。(填字母)
A.称量时,药品与砝码放反了(1g以下使用游码)
B.量取水的体积时,仰视读数
C.装瓶时,有少量溶液洒出
③若用50g质量分数为15%的氧化钠溶液配制溶质质量分数为5%的氯化钠溶液,需要加水的质量是___________ 。
(1)A、B、C三种固体物质的溶解度曲线如图所示,回答下列问题。

①t1℃时,溶解度等于20g的物质为
②t2℃时,向盛有50gB物质的烧杯中加入100g水,充分溶解后,所得溶液的质量
③t1℃时,A、B、C三种物质饱和溶液升温到t2℃后,溶液中溶质质量分数由大到小的顺序是
④t2℃时,300gA物质的饱和溶液降温到t1℃时,析出晶体的质量是
(2)配制50g质量分数为15%的氯化钠溶液:
①溶解过程中玻璃棒的作用是
②对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有
A.称量时,药品与砝码放反了(1g以下使用游码)
B.量取水的体积时,仰视读数
C.装瓶时,有少量溶液洒出
③若用50g质量分数为15%的氧化钠溶液配制溶质质量分数为5%的氯化钠溶液,需要加水的质量是
您最近一年使用:0次
2021-06-04更新
|
932次组卷
|
3卷引用:2020年新疆乌鲁木齐市第一一三中学中考一模化学试题
10 . 下列图像能正确反映对应变化关系的组合是
①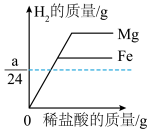 分别向质量为ag的镁粉和ag的铁粉中逐滴加入相同溶质质量分数的稀盐酸至过量
分别向质量为ag的镁粉和ag的铁粉中逐滴加入相同溶质质量分数的稀盐酸至过量
② 向一定质量盐酸中逐滴加入与盐酸等质量、等溶质质量分数的NaOH溶液
向一定质量盐酸中逐滴加入与盐酸等质量、等溶质质量分数的NaOH溶液
③ 向一定量的氢氧化铜粉末中逐渐加入稀硫酸至过量
向一定量的氢氧化铜粉末中逐渐加入稀硫酸至过量
④ 煅烧一定量的石灰石样品(假设杂质不参与反应),y轴表示固体中杂质的质量分数
煅烧一定量的石灰石样品(假设杂质不参与反应),y轴表示固体中杂质的质量分数
①
 分别向质量为ag的镁粉和ag的铁粉中逐滴加入相同溶质质量分数的稀盐酸至过量
分别向质量为ag的镁粉和ag的铁粉中逐滴加入相同溶质质量分数的稀盐酸至过量②
 向一定质量盐酸中逐滴加入与盐酸等质量、等溶质质量分数的NaOH溶液
向一定质量盐酸中逐滴加入与盐酸等质量、等溶质质量分数的NaOH溶液③
 向一定量的氢氧化铜粉末中逐渐加入稀硫酸至过量
向一定量的氢氧化铜粉末中逐渐加入稀硫酸至过量④
 煅烧一定量的石灰石样品(假设杂质不参与反应),y轴表示固体中杂质的质量分数
煅烧一定量的石灰石样品(假设杂质不参与反应),y轴表示固体中杂质的质量分数| A.③④ | B.①② | C.①③ | D.②④ |
您最近一年使用:0次
2021-05-26更新
|
528次组卷
|
2卷引用:2020年新疆乌鲁木齐市生产建设兵团第一中学中考一模化学试题



