解题方法
1 . 某化学兴趣小组以“生命之源——水”为主题开展项目式学习。
【任务一】认识水的蒸发
(1)如图是两杯等体积的水在不同温度下放置时发生变化的微观示意图,已知两杯水的水温分别是20℃和50℃,则温度为20℃的水为_______ (填序号)。_______ 。
【继续探究】实验过程中,同学们发现调节电压或在水中加入少量氢氧化钠都会改变电解速率。于是他进行了多次实验,将实验数据取平均值。记录如下。(保持其它条件不变,每次实验收集10mL氧气)
(3)该实验的目的是_______ 。
(4)分析上表数据可得出的结论_______ 、_______ 。(写两条)
(5)该实验采用的方法是收集相同体积的氧气比较反应时间的长短,你还可以采用的方法是_______ 。
【任务一】认识水的蒸发
(1)如图是两杯等体积的水在不同温度下放置时发生变化的微观示意图,已知两杯水的水温分别是20℃和50℃,则温度为20℃的水为


【继续探究】实验过程中,同学们发现调节电压或在水中加入少量氢氧化钠都会改变电解速率。于是他进行了多次实验,将实验数据取平均值。记录如下。(保持其它条件不变,每次实验收集10mL氧气)
| 电压 反应时间 氢氧化钠溶液浓度(氢氧化钠的质量占氢氧化钠和水的质量和的百分比) | 6V | 9V | 12V |
| 5% | 26分26秒 | 12分14秒 | 7分30秒 |
| 10% | 17分8秒 | 9分26秒 | 6分22秒 |
(3)该实验的目的是
(4)分析上表数据可得出的结论
(5)该实验采用的方法是收集相同体积的氧气比较反应时间的长短,你还可以采用的方法是
您最近一年使用:0次
2 . 探究氧化铁是否像二氧化锰一样可作氯酸钾分解的催化剂,同学们设计了三组实验(其他可能影响因素均控制相同),下列有关说法错误的是
| 实验编号 | 实验药品 | 分解温度/℃ |
| ① | 1.2g氯酸钾 | t1 |
| ② | 1.2g氯酸钾、0.5g二氧化锰 | t2 |
| ③ | xg氯酸钾、yg氧化铁 | t3 |
| A.x=1.2,y=0.5 |
| B.t2<t1 |
| C.若t3>t1,说明氧化铁能加快氯酸押的分解 |
| D.比较t2、t3的大小可对比氧化铁与二氧化锰对氯酸钾分解的催化效果 |
您最近一年使用:0次
3 . 花青素具有显著的抗氧化功能,广泛存在于植物中、实验小组对紫薯中的花青素展开了研究。
【查阅资料】
①紫薯中的花青素随溶液pH变化,会呈现不同的颜色:
②烫漂是加工紫薯粉的方法之一。花青素保留率越高,加工效果越好。
③花青素保留率越高,说明其在该条件下的稳定性越好。
【进行实验】
实验1:测定溶液的酸碱性。
实验2:探究一定条件下,烫漂加工紫薯粉过程中花青素稳定性的影响因素。实验数据如下表:
实验3:探究一定条件下,pH对花青素稳定性的影响。实验结果如下图:
(1)实验1的结论是______ 。
(2)实验2:
①a=______ 。
②ADE的目的是______ 。
③由BCD可以得到的结论是______ 。
(3)实验3的数据可作为pH越大,花青素的稳定性越差的证据,理由是______ 。
【反思与评价】
(4)结合实验2和实验3,烫漂加工紫薯粉的最佳实验条件为______ 。
【查阅资料】
①紫薯中的花青素随溶液pH变化,会呈现不同的颜色:
| pH值 | 1~4 | 5~7 | 8~10 | 11 | 12 | 13 |
| 颜色 | 洋红色 | 淡洋红色 | 淡紫色 | 蓝色 | 蓝黄色 | 土黄色 |
③花青素保留率越高,说明其在该条件下的稳定性越好。
【进行实验】
实验1:测定溶液的酸碱性。
| 实验操作 | 实验现象 | 实验结论 |
| 向试管中加入少量纯碱溶液,滴加2滴紫薯汁。 | 溶液变为蓝色 | ______ |
| 实验序号 | 烫漂温度/℃ | 烫漂时间/min | 成品花青素保留率/% |
| A | 65 | a | 2.95 |
| B | 75 | 1 | 6.49 |
| C | 75 | 3 | 10.39 |
| D | 75 | 5 | 12.01 |
| E | 100 | 5 | 42.86 |

(1)实验1的结论是
(2)实验2:
①a=
②ADE的目的是
③由BCD可以得到的结论是
(3)实验3的数据可作为pH越大,花青素的稳定性越差的证据,理由是
【反思与评价】
(4)结合实验2和实验3,烫漂加工紫薯粉的最佳实验条件为
您最近一年使用:0次
解题方法
4 . 科技小组同学开展项目式学习:探究食品脱氧剂铁粉的“锈蚀和影响因素
【资料信息】①食品脱氧剂的主要成分是铁粉和辅助物质,脱氧原理是铁的生锈。
②铁锈的主要成分是Fe2O3•nH2O。
【任务一】探究铁生锈的条件_______ ,得出铁生锈与______ 有关。请你列举生活、生产中防止铁腐蚀采取的措施:______ (任写一种即可)。
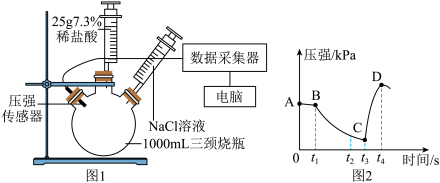
【任务二】探究铁粉锈蚀快慢和程度_______ 。将5g铁粉和2g碳粉加入三颈烧瓶,连接压强传感器、数据采集器,采集数据,绘制出压强随时间变化的曲线如图2所示。t1时刻利用注射器加入2mL饱和NaCl溶液,t3将一只装有稀盐酸的注射器插到烧瓶上并加入稀盐酸。根据图2信息对比AB段和BC段说明_______ ,t3时刻压强突然变大,说明铁粉腐蚀的程度属于______ (填“部分”“全部”)腐蚀。
【任务三】测定铁锈主要成分Fe2O3•nH2O中n的数值
(3)根据图3进行两步实验,实验相关数据如图4所示:
第二步:改持续通入H2,加强热至t2,熄灭酒精喷灯后,继续通入H2至固体冷却。
继续通入H2的目的是_______ 。计算这包“脱氧剂”中Fe2O3•nH2O的n=_______ 。
【资料信息】①食品脱氧剂的主要成分是铁粉和辅助物质,脱氧原理是铁的生锈。
②铁锈的主要成分是Fe2O3•nH2O。
【任务一】探究铁生锈的条件
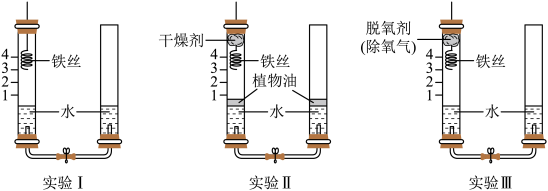
【任务二】探究铁粉锈蚀快慢和程度
【任务三】测定铁锈主要成分Fe2O3•nH2O中n的数值
(3)根据图3进行两步实验,实验相关数据如图4所示:

第二步:改持续通入H2,加强热至t2,熄灭酒精喷灯后,继续通入H2至固体冷却。
继续通入H2的目的是
您最近一年使用:0次
解题方法
5 . 化学兴趣小组利用如图装置进行实验,探究锌与硫酸反应快慢的影响因素。
下列说法不正确的是

| 序号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL) (均收集3min) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 薄锌片 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| ④ | 30% | 薄锌片 | 79.9 |
| A.四个实验中,④的反应最快 |
| B.对比①③、②④均可以探究硫酸的浓度对反应快慢的影响 |
| C.对比①②、③④均可以探究反应物的接触面积对反应快慢的影响 |
| D.对比①④可知硫酸的浓度大的反应快 |
您最近一年使用:0次
6 . 临近中考,同学们努力拼搏,每天用眼时间较长,为缓解眼部疲劳,小明使用了蒸汽眼罩,并对蒸汽眼罩开展了以下研究。
【查阅资料】蒸汽眼罩由无纺布眼罩和发热体构成。发热体内含有铁粉、活性炭、氯化钠、蛭石(保温作用,可以减缓热量散失)、高吸水树脂(良好保水性能,为眼罩提供水蒸气)等。
任务一:验证蒸汽眼罩发热体内含有铁粉和氯化钠
(1)Ⅰ.甲同学取少量发热体内固体粉末于试管中,向其中滴加稀盐酸,观察到产生气泡,反应的化学方程式为________ ,证明发热体内含有铁粉。
Ⅱ.乙同学另取少量发热体内固体粉末于烧杯中,加入足量水,充分溶解后,取上层清液于试管中,加入硝酸银溶液,观察到________ ,证明发热固体内含有氯化钠。
任务二:探究蒸汽眼罩的发热原理
(2)根据“使用方法:打开蒸汽眼罩包装,接触空气即开始发热”,小组同学进行了以下实验:取20g发热体内固体粉末放入密闭容器中,通过数字传感器分别测得氧气和二氧化碳含量变化如图。据图回答:发热体内的物质和空气中的________ 发生了反应,理由是________ 。
(3)实验2中应取用氯化钠的质量是________ g。实验4中温度迅速上升的原因是铁粉与________ 共同作用的结果。
【拓展延伸】
(4)厂在蒸汽眼罩密封装袋时,应确保________ 。
【查阅资料】蒸汽眼罩由无纺布眼罩和发热体构成。发热体内含有铁粉、活性炭、氯化钠、蛭石(保温作用,可以减缓热量散失)、高吸水树脂(良好保水性能,为眼罩提供水蒸气)等。
任务一:验证蒸汽眼罩发热体内含有铁粉和氯化钠
(1)Ⅰ.甲同学取少量发热体内固体粉末于试管中,向其中滴加稀盐酸,观察到产生气泡,反应的化学方程式为
Ⅱ.乙同学另取少量发热体内固体粉末于烧杯中,加入足量水,充分溶解后,取上层清液于试管中,加入硝酸银溶液,观察到
任务二:探究蒸汽眼罩的发热原理
(2)根据“使用方法:打开蒸汽眼罩包装,接触空气即开始发热”,小组同学进行了以下实验:取20g发热体内固体粉末放入密闭容器中,通过数字传感器分别测得氧气和二氧化碳含量变化如图。据图回答:发热体内的物质和空气中的
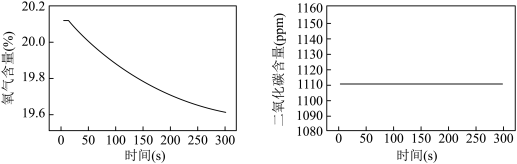
| 方案 | 药品 | 1分钟前后氧气含量变化 | 1分钟前后温度变化 |
| 实验1 | 4g铁粉、2mL水 | 20.1%→20.1% | 16°C→16°C |
| 实验2 | 4g铁粉、2mL水、____g氯化钠 | 20.1%→20.1% | 16°C→>16°C |
| 实验3 | 4g铁粉、2mL水、2g活性炭 | 20.1%→20.1% | 16°C→16°C |
| 实验4 | 4g铁粉、2mL水、2g氯化钠、2g活性炭 | 20.1%→15% | 16°C→55°C→26°C |
(3)实验2中应取用氯化钠的质量是
【拓展延伸】
(4)厂在蒸汽眼罩密封装袋时,应确保
您最近一年使用:0次
7 . 红枣和紫薯同时具有抗氧化、降血糖和抑制肿瘤等多种功能,某小组同学尝试将二者共同放入酸奶中,并对影响酸奶感官品质的因素进行探究。
【查阅资料】
①酸奶采用纯牛奶、红枣和紫薯为主要原料,制备流程可以概括为:原料处理→调配→均质→灭菌→冷却→接种→发酵→冷藏后熟→成品。
②酸奶感官品质从组织状态、口感、气味、色泽等方面打分,感官评分越高,酸奶品质越好。
【进行实验】
将纯牛奶与按制备好的红枣汁、紫薯浆、和白砂糖按比例混合调配,加入3%乳酸菌,并按流程进行制备,将制备好的酸奶进行感官评分,实验记录如下:
【解释与结论】
(1)酸奶的制备过程中,发酵属于______ (填“物理变化”或“化学变化”)。
(2)实验①②③的目的是______ 。
(3)由实验②④⑤可以得到的结论是______ 。
(4)根据实验可知,制备红枣紫薯风味酸奶的最佳配方为:红枣汁添加量______ ,紫薯浆添加量______ ,白砂糖添加量7%,乳酸菌3%。
【继续实验】
(5)补做实验探究乳酸菌加入量对酸奶感官品质的影响。实验方案:将纯牛奶与制备好的红枣汁9%,______ ,并按流程进行制备,将制备好的酸奶进行感官评分。
【查阅资料】
①酸奶采用纯牛奶、红枣和紫薯为主要原料,制备流程可以概括为:原料处理→调配→均质→灭菌→冷却→接种→发酵→冷藏后熟→成品。
②酸奶感官品质从组织状态、口感、气味、色泽等方面打分,感官评分越高,酸奶品质越好。
【进行实验】
将纯牛奶与按制备好的红枣汁、紫薯浆、和白砂糖按比例混合调配,加入3%乳酸菌,并按流程进行制备,将制备好的酸奶进行感官评分,实验记录如下:
| 实验序号 | 红枣汁添加量/% | 紫薯浆添加量/% | 白砂糖添加量/% | 感官评分 |
| ① | 10 | 10 | 7 | 74.9 |
| ② | 9 | 10 | 7 | 85.5 |
| ③ | 8 | 10 | 7 | 75.7 |
| ④ | 9 | 9 | 7 | 76.6 |
| ⑤ | 9 | 11 | 7 | 77.2 |
| ⑥ | 9 | 10 | 8 | 75.3 |
| ⑦ | 9 | 10 | 6 | 79.2 |
(1)酸奶的制备过程中,发酵属于
(2)实验①②③的目的是
(3)由实验②④⑤可以得到的结论是
(4)根据实验可知,制备红枣紫薯风味酸奶的最佳配方为:红枣汁添加量
【继续实验】
(5)补做实验探究乳酸菌加入量对酸奶感官品质的影响。实验方案:将纯牛奶与制备好的红枣汁9%,
您最近一年使用:0次
8 . 到2060年,我国要实现“碳中和”,梦天化学兴趣小组以“简易吸碳机的制作”为项目开展探究,请你一起参与:
任务一:“捕风”——制作简易吸风机
兴趣小组成员自制捕风装置——简易吸风机(如图1),左侧是利用负压吸风动力装置,右侧是滤网,接通电后,吸风机风扇旋转产生内外压强差将空气自右向左吸进简易吸风机,完成捕风任务。
任务二:“捉碳”——探寻适宜的 吸收剂
吸收剂
兴趣小组向装有 气体的塑料瓶内倒入不同种类的吸收剂,实验数据及现象如下:
气体的塑料瓶内倒入不同种类的吸收剂,实验数据及现象如下:
采用振荡吸收法比较不同吸收剂的吸收效果
(1)30mL水这一组实验的作用是_____ 。
(2)写出用澄清石灰水做吸收剂时反应的化学方程式_____ 。
(3)从上述实验得到的结论是_____ 。
(4)将吸风机过滤网倒扣在石灰乳中,蘸取一定量的石灰乳后,通电后发现吸风效果变差,其原因是_____ 。
兴趣小组在老师的帮助下,查阅相关资料如下:
资料1:20℃时,几种常见物质的溶解度
资料2:碳酸盐能与 、
、 反应
反应
(5)你认为哪种物质最不适合作为 吸收剂?
吸收剂?_____ ,说明理由:_____ 。
经实验探究,氢氧化钾更适合用于简易吸碳机。
任务三:“释碳”——吸收剂再生与碳释放再利用
兴趣小组设计了吸收并释放 方案,其流程如图2所示:
方案,其流程如图2所示:_____ 种氧化物。
(7)请你设计实验证明滤液中不含 ,实验方案:
,实验方案:_____ 。
(8)除通过“碳捕集”实现碳中和外,请你再提出一条能实现碳中和的合理方案_____ 。
任务一:“捕风”——制作简易吸风机
兴趣小组成员自制捕风装置——简易吸风机(如图1),左侧是利用负压吸风动力装置,右侧是滤网,接通电后,吸风机风扇旋转产生内外压强差将空气自右向左吸进简易吸风机,完成捕风任务。

任务二:“捉碳”——探寻适宜的
 吸收剂
吸收剂兴趣小组向装有
 气体的塑料瓶内倒入不同种类的吸收剂,实验数据及现象如下:
气体的塑料瓶内倒入不同种类的吸收剂,实验数据及现象如下:采用振荡吸收法比较不同吸收剂的吸收效果
| 水 | 澄清石灰水 | 石灰乳 |  固体 固体 |
|
 |
 |
 固体 固体 |
(1)30mL水这一组实验的作用是
(2)写出用澄清石灰水做吸收剂时反应的化学方程式
(3)从上述实验得到的结论是
(4)将吸风机过滤网倒扣在石灰乳中,蘸取一定量的石灰乳后,通电后发现吸风效果变差,其原因是
兴趣小组在老师的帮助下,查阅相关资料如下:
资料1:20℃时,几种常见物质的溶解度
| 物质 | NaOH | KOH |  |  |  |
| 溶解度/g | 109 | 112 | 3.89 | 21.8 | 111 |
 、
、 反应
反应(5)你认为哪种物质最不适合作为
 吸收剂?
吸收剂?经实验探究,氢氧化钾更适合用于简易吸碳机。
任务三:“释碳”——吸收剂再生与碳释放再利用
兴趣小组设计了吸收并释放
 方案,其流程如图2所示:
方案,其流程如图2所示: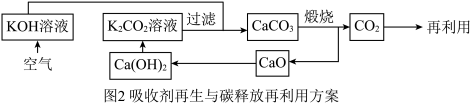
(7)请你设计实验证明滤液中不含
 ,实验方案:
,实验方案:(8)除通过“碳捕集”实现碳中和外,请你再提出一条能实现碳中和的合理方案
您最近一年使用:0次
9 . 某同学发现一种蜡烛吹灭大约5秒后会重新复燃。于是对这种“吹不灭的蜡烛”产生兴趣并进行如下探究。
探究A:蜡烛复燃的原因
【查阅资料】
①“吹不灭的蜡烛”烛芯里包裹了一层由铜、铁、镁中的一种金属制成的合金,其着火点为150℃。合金中的其他成分化学性质稳定。
②蜡烛燃烧时温度约为550℃~600℃。
【进行实验】为确定该合金中金属的成分,同学们展开了以下探究.
【解释与结论】
(1)实验1,操作X是_______ 。
(2)实验2,加入的试剂Y是______ 。
(3)得出“合金中的金属只有镁”的现象是_______________ 。
(4)蜡烛吹灭后,又复燃的原因是_____________ 。
(5)设计由镁粉(单质镁)生产 的转化路径,依次写出反应的化学方程式:
的转化路径,依次写出反应的化学方程式:________________ 。
探究B:蜡烛复燃快慢的影响因素
【进行实验】用棉线(均为12根拧成一股)分别裹上不同质量的金属颗粒和金属粉末,制成直径为0.5cm的蜡烛,分别记录蜡烛复燃所需时间。
【解释与结论】
(6)对比第1组和第2组实验,得出的结论是_______________ 。
【反思】
(7)小组认为还可以探究________ (因素)对蜡烛复燃快慢的影响。
探究A:蜡烛复燃的原因
【查阅资料】
①“吹不灭的蜡烛”烛芯里包裹了一层由铜、铁、镁中的一种金属制成的合金,其着火点为150℃。合金中的其他成分化学性质稳定。
②蜡烛燃烧时温度约为550℃~600℃。
【进行实验】为确定该合金中金属的成分,同学们展开了以下探究.
| 序号 | 实验步骤 | 实验现象 |
| 实验1 | 取出烛芯内的合金,操作X,观察 | 呈银白色 |
| 实验2 | 取上述操作后的合金于试管中,滴加适量试剂Y,观察 | 固体部分溶解,产生气泡,溶液为无色 |
(1)实验1,操作X是
(2)实验2,加入的试剂Y是
(3)得出“合金中的金属只有镁”的现象是
(4)蜡烛吹灭后,又复燃的原因是
(5)设计由镁粉(单质镁)生产
 的转化路径,依次写出反应的化学方程式:
的转化路径,依次写出反应的化学方程式:探究B:蜡烛复燃快慢的影响因素
【进行实验】用棉线(均为12根拧成一股)分别裹上不同质量的金属颗粒和金属粉末,制成直径为0.5cm的蜡烛,分别记录蜡烛复燃所需时间。
| 组别 | 第1组(金属颗粒) | 第2组(金属粉末) | ||||
| 实验序号 | ① | ② | ③ | ④ | ⑥ | ⑥ |
| 金属用量/g | 0.05 | 0.10 | 0.15 | 0.05 | 0.10 | 0.15 |
| 复燃所需时间/s | 未复燃 | 5 | 4 | 9 | 4.7 | 持续燃烧 |
(6)对比第1组和第2组实验,得出的结论是
【反思】
(7)小组认为还可以探究
您最近一年使用:0次
10 . 芬顿(Fenton)反应是一种利用过氧化氢分解产生自由基降解污染物的技术,常用于处理水体和大气中的污染物。
【传统“Fe2+-H2O2”体系】
(1)Fe2+在降解过程中起催化作用,反应前后质量和___________ 不变。
(2)为了探究Fenton法对有机污染物降解速率的影响因素,某小组用一定浓度的H2O2溶液和FeSO4溶液进行实验并整理如下表格,测得有机污染物浓度的变化情况如图a所示(p-CP指有机污染物)。
①实验D中的x的值为___________ 。
②对比A,B组实验可发现升高温度可以加快Fenton法降解有机污染物的速率。分析图1中对应的曲线,得到上述结论的依据为___________ 。
③本实验中除温度、pH、H2O2溶液浓度外,还研究了___________ 对Fenton法降解有机污染物速率的影响。
④为测定不同时间内有机污染物的浓度,需在不同时间从反应器中取样,并使所取样品中的降解反应立即停止下来。请你根据图中的信息,给出一种迅速停止反应的方法:___________ 。
【“纳米零价铁——H2O2”体系】
(3)纳米零价铁粒径较小,表面积较大,吸附性和反应活性较高。去除工业烟气中的NO的途径如下:在一定温度下,将H2O2溶液和稀盐酸雾化,再与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置。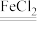 2HNO3+2H2O,反应中化合价改变的元素有
2HNO3+2H2O,反应中化合价改变的元素有___________ (填元素符号)。
②此过程中,纳米零价铁除了具有较好的吸附效果外,还具有的作用是___________ 。
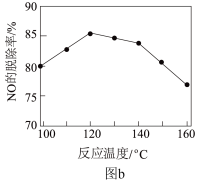
③NO脱除率随温度的变化如图b所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是___________ 。
【传统“Fe2+-H2O2”体系】
(1)Fe2+在降解过程中起催化作用,反应前后质量和
(2)为了探究Fenton法对有机污染物降解速率的影响因素,某小组用一定浓度的H2O2溶液和FeSO4溶液进行实验并整理如下表格,测得有机污染物浓度的变化情况如图a所示(p-CP指有机污染物)。
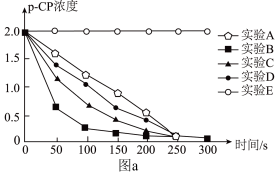
| 编号 | H2O2溶液/mL | FeSO4溶液/mL | 蒸馏水/mL | pH | 温度/℃ |
| A | 1.5 | 3.5 | 10 | 3 | 25 |
| B | 1.5 | 3.5 | 10 | 3 | 40 |
| C | 3.5 | 3.5 | 8 | 3 | 25 |
| D | 1.5 | 4.5 | x | 3 | 25 |
| E | 1.5 | 3.5 | 10 | 10 | 25 |
②对比A,B组实验可发现升高温度可以加快Fenton法降解有机污染物的速率。分析图1中对应的曲线,得到上述结论的依据为
③本实验中除温度、pH、H2O2溶液浓度外,还研究了
④为测定不同时间内有机污染物的浓度,需在不同时间从反应器中取样,并使所取样品中的降解反应立即停止下来。请你根据图中的信息,给出一种迅速停止反应的方法:
【“纳米零价铁——H2O2”体系】
(3)纳米零价铁粒径较小,表面积较大,吸附性和反应活性较高。去除工业烟气中的NO的途径如下:在一定温度下,将H2O2溶液和稀盐酸雾化,再与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置。
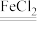 2HNO3+2H2O,反应中化合价改变的元素有
2HNO3+2H2O,反应中化合价改变的元素有②此过程中,纳米零价铁除了具有较好的吸附效果外,还具有的作用是
③NO脱除率随温度的变化如图b所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是
您最近一年使用:0次