1 . “固体酒精”是餐饮行业中常用的燃料。同学们对用“乙醇、硬脂酸、NaOH ”混合制备“固体酒精”的最佳反应条件进行了探究。
【查阅资料】①在液态乙醇中加入适当的固化剂可得到“固体酒精”,硬脂酸钠为最常见的固化剂。②在标准大气压下,乙醇的沸点为78℃。③制备“固体酒精”的操作:取乙醇,加入硬脂酸、NaOH固体,搅拌至完全溶解,趁热倒入模具中,待自然冷却得到均匀一致的“固体酒精”。
【分析与解释】
(1)硬脂酸与NaOH混合后生成硬脂酸钠,发生如下化学反应,补全化学方程式:C17H35COOH+NaOH=C17H35COONa+______ ,该反应的基本反应类型为______ 反应。
(2)在较高温度下,上述反应生成的硬脂酸钠均匀地分散在乙醇中,冷却后形成“固体酒精”。由此可知,“固体酒精”______ (填“是”或“不是”)固态乙醇。
(3)“固体酒精”与液态乙醇相比,具有的优势有______ (写出两点)。
实验Ⅰ:探究加料方式对制备“固体酒精”的影响
一定温度下,乙醇、硬脂酸、NaOH 用量相同时,用不同的加料方式进行实验,实验现象记录如下:
(4)③为最佳加料方式的依据是______ 。
实验Ⅱ:探究制备“固体酒精”的最佳温度
在不同温度下,乙醇、硬脂酸、NaOH 用量相同时,用最佳加料方式进行实验,实验现象记录如下:
(5)制备“固体酒精”的最佳温度是______ 。
(6)不选择70℃ 以上的温度做对比实验,原因是______ 。
实验Ⅲ:探究硬脂酸的含量对“固体酒精”燃烧时凝固性能的影响
在最佳温度下,用最佳加料方式进行实验制备“固体酒精”并点燃,实验现象记录如下:
(7)实验⑨,X=______ 。
(8)对比实验⑦~⑨得出的结论是______ 。
(9)评价“固体酒精”的优劣,还可以参考哪些因素______ (写出一点)。
【查阅资料】①在液态乙醇中加入适当的固化剂可得到“固体酒精”,硬脂酸钠为最常见的固化剂。②在标准大气压下,乙醇的沸点为78℃。③制备“固体酒精”的操作:取乙醇,加入硬脂酸、NaOH固体,搅拌至完全溶解,趁热倒入模具中,待自然冷却得到均匀一致的“固体酒精”。
【分析与解释】
(1)硬脂酸与NaOH混合后生成硬脂酸钠,发生如下化学反应,补全化学方程式:C17H35COOH+NaOH=C17H35COONa+
(2)在较高温度下,上述反应生成的硬脂酸钠均匀地分散在乙醇中,冷却后形成“固体酒精”。由此可知,“固体酒精”
(3)“固体酒精”与液态乙醇相比,具有的优势有
实验Ⅰ:探究加料方式对制备“固体酒精”的影响
一定温度下,乙醇、硬脂酸、NaOH 用量相同时,用不同的加料方式进行实验,实验现象记录如下:
| 实验序号 | ① | ② | ③ |
| 加料方式 | 硬脂酸和NaOH同时加入乙醇 | 先将硬脂酸溶于乙醇,再加入NaOH | 将硬脂酸和NaOH分别充分溶于2份乙醇后,再混合 |
| 完全溶解所需时间 | 60min | 45min | 30min |
(4)③为最佳加料方式的依据是
实验Ⅱ:探究制备“固体酒精”的最佳温度
在不同温度下,乙醇、硬脂酸、NaOH 用量相同时,用最佳加料方式进行实验,实验现象记录如下:
| 实验序号 | 温度/℃ | 现象 |
| ④ | 30 | 混合后立即生成“固体酒精”,产品不能混合均匀 |
| ⑤ | 40 | 混合后立即生成少量“固体酒精”,产品局部混合不均匀 |
| ⑥ | 60 | 混合后不立刻生成“固体酒精”,可以混合均匀 |
(5)制备“固体酒精”的最佳温度是
(6)不选择70℃ 以上的温度做对比实验,原因是
实验Ⅲ:探究硬脂酸的含量对“固体酒精”燃烧时凝固性能的影响
在最佳温度下,用最佳加料方式进行实验制备“固体酒精”并点燃,实验现象记录如下:
| 实验序号 | 乙醇/g | 硬脂酸/g | 氢氧化钠/g | 燃烧现象 |
| ⑦ | 96 | 3 | 1 | 熔化流淌 |
| ⑧ | 93 | 6 | 1 | 少量熔化流淌 |
| ⑨ | 92 | X | 1 | 不熔化流淌 |
(7)实验⑨,X=
(8)对比实验⑦~⑨得出的结论是
(9)评价“固体酒精”的优劣,还可以参考哪些因素
您最近一年使用:0次
解题方法
2 . 兴趣小组以“探究燃烧的奥秘”为主题开展探究活动。
【任务一】认识燃烧
(1)含碳燃料不完全燃烧易产生有毒的_______ ,造成“煤气中毒”,使用时要注意通风透气。
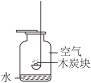
(2)下列是木炭燃烧的实验:欲证明氧气浓度对可燃物有影响应该进行的对比实验为_______ (填数字序号);实验②与实验③对比可以证明可燃物燃烧剧烈程度的因素是_______ 。
(3)探究燃烧产生火焰的原因。蜡烛在氧气中燃烧有明亮的火焰,而铁丝在氧气中燃烧却没有火焰。请据表中数据分析:
①物质燃烧能否产生火焰与其_______ (选填“熔点”或“沸点”)和燃烧时温度有关。钠燃烧时_______ (选填“有”或“没有”)火焰产生。
②硫在氧气中燃烧产生蓝紫色火焰,硫的沸点_______ (填“>”或“<”或“=”)硫燃烧时的温度。
【任务二】用如图装置探究燃烧的条件。从导管口通入氧气至a、b露出水面后停止,观察到只有a处白磷燃烧。已知:白磷、红磷的着火点分别为40℃、240℃。_______ 。
(5)能证明可燃物燃烧需要与氧气接触的现象是_______ 。
(6)该实验中,热水的作用有_______ 。
【任务三】调控燃烧。
(7)民间焰火表演艺术打铁花要将生铁烧成铁水,再将铁水在空中用力击打而形成四处飞溅的耀眼“铁花”。烧铁水时,用鼓风机不断向燃着的焦炭中鼓入空气,其目的是_______ 。
【任务一】认识燃烧
(1)含碳燃料不完全燃烧易产生有毒的
(2)下列是木炭燃烧的实验:欲证明氧气浓度对可燃物有影响应该进行的对比实验为
| 实验 | ① | ② | ③ |
| 操作 |
|
|
|
(3)探究燃烧产生火焰的原因。蜡烛在氧气中燃烧有明亮的火焰,而铁丝在氧气中燃烧却没有火焰。请据表中数据分析:
①物质燃烧能否产生火焰与其
②硫在氧气中燃烧产生蓝紫色火焰,硫的沸点
| 物质 | 熔点/℃ | 沸点/℃ | 燃烧时温度/℃ |
| 石蜡 | 50-70 | 300-550 | 约600 |
| 硫 | 暂无数据 | 444 | 待测 |
| 钠 | 97.8 | 883 | 约1800 |
| 铁 | 1535 | 2750 | 约1800 |
【任务二】用如图装置探究燃烧的条件。从导管口通入氧气至a、b露出水面后停止,观察到只有a处白磷燃烧。已知:白磷、红磷的着火点分别为40℃、240℃。
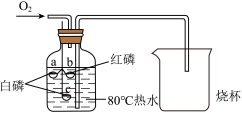
(5)能证明可燃物燃烧需要与氧气接触的现象是
(6)该实验中,热水的作用有
【任务三】调控燃烧。
(7)民间焰火表演艺术打铁花要将生铁烧成铁水,再将铁水在空中用力击打而形成四处飞溅的耀眼“铁花”。烧铁水时,用鼓风机不断向燃着的焦炭中鼓入空气,其目的是
您最近一年使用:0次
解题方法
3 . 芬顿(Fenton)反应是一种利用过氧化氢分解产生自由基降解污染物的技术,常用于处理水体和大气中的污染物。
I.传统“Fe2+-H2O2”体系
(1)Fe2+在降解过程中起催化作用,反应前后质量和______ 不变。
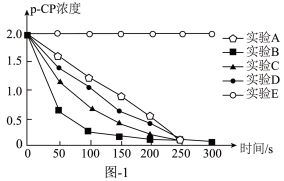
为了探究Fenton法对有机污染物(p-CP)降解速率的影响因素,用一定浓度的H2O2溶液和FeSO4,溶液进行如图实验,测得有机污染物(p-CP)浓度的变化情况如图1所示。
(2)①对比A、B组实验可发现升高温度可以加快Fenton法降解有机污染物(p-CP)的速率。分析图1中对应的曲线,得到上述结论的依据为_______ 。
②本实验中除温度、pH、H2O2溶液浓度外,还研究了______ 对Fenton法降解有机污染物(p-CP)速率的影响。实验D中的X的值是______ 。
③为测定不同时间内有机污染物的浓度,需在不同时间从反应器中取样,并使所取样品中的降解反应立即停止下来。根据图中的信息,给出一种迅速停止反应的方法________ 。
II.“纳米零价铁—H2O2”体系
纳米零价铁粒径较小,比表面积较大,吸附性和反应活性较高,因此“纳米零价铁H2O2”体系应用前景更广。
(3)除去工业烟气中的NO:一定温度下,将H2O2溶液和稀盐酸雾化,再与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置。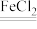 2HNO3+2H2O,反应中化合价改变的元素有
2HNO3+2H2O,反应中化合价改变的元素有______ 。(填元素符号)
②此过程中,纳米零价铁除了具有较好的吸附效果外,还具有的作用是_______ 。
③NO脱除率随温度的变化如图2所示。温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是______ 。
I.传统“Fe2+-H2O2”体系
(1)Fe2+在降解过程中起催化作用,反应前后质量和
为了探究Fenton法对有机污染物(p-CP)降解速率的影响因素,用一定浓度的H2O2溶液和FeSO4,溶液进行如图实验,测得有机污染物(p-CP)浓度的变化情况如图1所示。
| 编号 | H2O2溶液/mL | FeSO4溶液/mL | 蒸馏水/mL | pH | 温度/℃ |
| A | 1.5 | 3.5 | 10 | 3 | 25 |
| B | 1.5 | 3.5 | 10 | 3 | 40 |
| C | 3.5 | 3.5 | 8 | 3 | 25 |
| D | 1.5 | 4.5 | X | 3 | 25 |
| E | 1.5 | 3.5 | 10 | 10 | 25 |
(2)①对比A、B组实验可发现升高温度可以加快Fenton法降解有机污染物(p-CP)的速率。分析图1中对应的曲线,得到上述结论的依据为
②本实验中除温度、pH、H2O2溶液浓度外,还研究了
③为测定不同时间内有机污染物的浓度,需在不同时间从反应器中取样,并使所取样品中的降解反应立即停止下来。根据图中的信息,给出一种迅速停止反应的方法
II.“纳米零价铁—H2O2”体系
纳米零价铁粒径较小,比表面积较大,吸附性和反应活性较高,因此“纳米零价铁H2O2”体系应用前景更广。
(3)除去工业烟气中的NO:一定温度下,将H2O2溶液和稀盐酸雾化,再与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置。

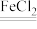 2HNO3+2H2O,反应中化合价改变的元素有
2HNO3+2H2O,反应中化合价改变的元素有②此过程中,纳米零价铁除了具有较好的吸附效果外,还具有的作用是
③NO脱除率随温度的变化如图2所示。温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是
您最近一年使用:0次
4 . 在学习“金属的化学性质”一课中,小深同学做了如下实验: 的质量为
的质量为______ g。
(2)依据化学方程式,求稀硫酸中溶质的质量分数。(写出计算过程)
(3)小深同学探究其他金属与酸的反应。用2g金属与10g稀硫酸进行实验,并记录收集到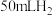 时所需要的时间,如下表:
时所需要的时间,如下表:
【分析】比较不同金属与酸反应的速率,选择的实验编号是______ ;
【结论】影响金属与稀硫酸反应速率的因素有:金属种类、金属表面积、______ (写一条)。

 的质量为
的质量为(2)依据化学方程式,求稀硫酸中溶质的质量分数。(写出计算过程)
(3)小深同学探究其他金属与酸的反应。用2g金属与10g稀硫酸进行实验,并记录收集到
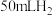 时所需要的时间,如下表:
时所需要的时间,如下表:| 编号 | 稀硫酸浓度 | 金属 | 时间/s | 备注 |
| ① | 5% | 镁粉 | 60 | 镁条和铁片表面积相同 |
| ② | 5% | 镁条 | 102 | |
| ③ | 5% | 铁片 | 120 | |
| ④ | 10% | 铁片 | 110 |
【结论】影响金属与稀硫酸反应速率的因素有:金属种类、金属表面积、
您最近一年使用:0次
5 . 有学者提出“铁丝燃烧绕成螺旋状,是为了防止燃烧点因迅速上升到集气瓶内氧气低浓度区而熄灭”。据此,化学学习小组的同学决定对铁丝在氧气中燃烧进行更深入的探究。
活动一:探究铁丝燃烧时长的影响因素
[实验1]如图1所示,从同一长铁丝上分别截取3根长度相同的铁丝,将1根拉直、另2根绕成直径大小不同的螺旋状,下端系上燃着的小木条进行燃烧实验。每种形状的铁丝平行测量3次,所测得的实验数据如图2所示。______ ,故进行该实验时,宜选择容积为______ (填“125”或“250”)mL的集气瓶更容易成功。
(2)实验中发现不管铁丝形状如何,其燃烧时长均在曲线附近,说明燃烧时长与铁丝是否绕成螺旋状_____ (填“有关”或“无关”)。
(3)实验时,3根铁丝均要完全伸入集气瓶中,原因是______ 。
(4)分析图2可知,铁丝在氧气中剧烈燃烧的时长与集气瓶内氧气的起始浓度的关系是_______ 。
活动二:探究铁丝的含碳量与火星四射的关系
[实验2]取粗细相同、含碳量不同的细铁丝,分别在氧气中燃烧,记录实验现象如表。
(5)实验中_______ (填“能”或“不能”)以产生火星四射的现象作为衡量铁丝是否燃烧的唯一标志。
反思与拓展
(6)理论上,铁丝燃烧后质量会增加。分析多组实验发现,铁丝未发生熔断,但反应前铁丝质量与反应后差别不大,其原因可能是________ 。
(7)冷烟花由多种金属粉末制成,燃放时火花飞舞,其喷射口处温度可高达700-800℃,火花喷出后温度迅速降低,距喷射口50mm处,温度降至约40℃,所以俗称冷烟花。燃放冷烟花的正确做法是_______ 。
活动一:探究铁丝燃烧时长的影响因素
[实验1]如图1所示,从同一长铁丝上分别截取3根长度相同的铁丝,将1根拉直、另2根绕成直径大小不同的螺旋状,下端系上燃着的小木条进行燃烧实验。每种形状的铁丝平行测量3次,所测得的实验数据如图2所示。
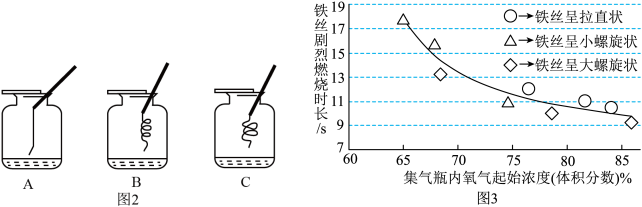
(2)实验中发现不管铁丝形状如何,其燃烧时长均在曲线附近,说明燃烧时长与铁丝是否绕成螺旋状
(3)实验时,3根铁丝均要完全伸入集气瓶中,原因是
(4)分析图2可知,铁丝在氧气中剧烈燃烧的时长与集气瓶内氧气的起始浓度的关系是
活动二:探究铁丝的含碳量与火星四射的关系
[实验2]取粗细相同、含碳量不同的细铁丝,分别在氧气中燃烧,记录实验现象如表。
| 铁丝含碳量 | 0% | 0.2% | 0.38% |
| 实验现象 | 无火星,燃烧处熔成小球 | 有短暂火星四射现象 | 火星四射,现象明显 |
(5)实验中
反思与拓展
(6)理论上,铁丝燃烧后质量会增加。分析多组实验发现,铁丝未发生熔断,但反应前铁丝质量与反应后差别不大,其原因可能是
(7)冷烟花由多种金属粉末制成,燃放时火花飞舞,其喷射口处温度可高达700-800℃,火花喷出后温度迅速降低,距喷射口50mm处,温度降至约40℃,所以俗称冷烟花。燃放冷烟花的正确做法是
您最近一年使用:0次
名校
6 . 某学习小组用不同浓度的溶液浇灌植物,研究重金属对植物生长的影响。
(1)该小组首先研究了 的影响。每次施用的浇灌液均为100mL,配液方案如下表。(本研究所用溶液很稀,密度均近似看作1
的影响。每次施用的浇灌液均为100mL,配液方案如下表。(本研究所用溶液很稀,密度均近似看作1 )
)
①补充盆3的配液数据:a=________ ,b=________ ;
②为了获得严谨的结论,合理设计盆4的配液方案:d=______ 。
(2)该小组还研究了 的影响。研究结束后该小组将未用完的
的影响。研究结束后该小组将未用完的 溶液和
溶液和 溶液直接混合,准备作无害化处理。
溶液直接混合,准备作无害化处理。
①混合后产生大量白色沉淀,反应的化学方程式为__________
②过滤,所得蓝色滤液中含有的溶质可能是
假设一:只有
假设二: 和
和
假设三:__________ 。
③设计实验确定蓝色滤液的成分,完成表格。
(1)该小组首先研究了
 的影响。每次施用的浇灌液均为100mL,配液方案如下表。(本研究所用溶液很稀,密度均近似看作1
的影响。每次施用的浇灌液均为100mL,配液方案如下表。(本研究所用溶液很稀,密度均近似看作1 )
)| 编号 | 浇灌液中 的浓度 的浓度 | 5%  溶液的用量/mL 溶液的用量/mL | 水的用量/mL | 总体积/mL |
| 盆1 | 5% | 100 | 0 | 100 |
| 盆2 | 3% | 60 | 40 | 100 |
| 盆3 | 1% | a | b | 100 |
| 盆4 | w | c | d | 100 |
②为了获得严谨的结论,合理设计盆4的配液方案:d=
(2)该小组还研究了
 的影响。研究结束后该小组将未用完的
的影响。研究结束后该小组将未用完的 溶液和
溶液和 溶液直接混合,准备作无害化处理。
溶液直接混合,准备作无害化处理。①混合后产生大量白色沉淀,反应的化学方程式为
②过滤,所得蓝色滤液中含有的溶质可能是
假设一:只有

假设二:
 和
和
假设三:
③设计实验确定蓝色滤液的成分,完成表格。
| 实验操作 | 现象与结论 |
| 取少量滤液于试管中, |
您最近一年使用:0次
名校
解题方法
7 . 分类、类比是学习化学常用的方法________ 归为一类,依据是________ 。
(2)凡是有元素化合价升降的化学反应都是氧化还原反应。有化合价降低的物质是氧化剂,有化合价升高的物质是还原剂。用辉铜矿炼铜的反应原理为:

 ,此反应中还原剂是
,此反应中还原剂是___________ 。 中铜元素的化合价为
中铜元素的化合价为___________ 。
(2)凡是有元素化合价升降的化学反应都是氧化还原反应。有化合价降低的物质是氧化剂,有化合价升高的物质是还原剂。用辉铜矿炼铜的反应原理为:


 ,此反应中还原剂是
,此反应中还原剂是 中铜元素的化合价为
中铜元素的化合价为
您最近一年使用:0次
2024-05-22更新
|
27次组卷
|
2卷引用: 黑龙江省哈尔滨市第六十九中学校2023—2024学年八年级下学期期中考试理化综合试卷 -初中化学
8 . 下面是初中化学中常见的几个实验,请回答下列问题。______ ,根据该现象可知,二氧化碳具有______ 的性质。
(2)实验二中加热片刻后,可观察到棉球上蘸有的酒精燃烧,而棉球上蘸有的水不燃烧,由此可得出燃烧的条件之一是______ 。
(3)实验三是一组对比实验,一段时间后试管______ (选填“甲”或“乙”)中的铁钉会锈蚀,该实验说明铁生锈与______ 有关。

(2)实验二中加热片刻后,可观察到棉球上蘸有的酒精燃烧,而棉球上蘸有的水不燃烧,由此可得出燃烧的条件之一是
(3)实验三是一组对比实验,一段时间后试管
您最近一年使用:0次
9 . 为了证明NaOH能与CO2发生了反应,将两支充满CO2的相同试管分别倒扣在等体积的水和NaOH溶液中。乙中液面高于甲,说明NaOH与CO2发生了反应,该反应的化学方程式为_____ ,本实验中甲的作用是_____ 。

您最近一年使用:0次
解题方法
10 . 为比较 溶液和
溶液和 溶液对
溶液对 分解的催化效果,某研究小组进行了如下探究:
分解的催化效果,某研究小组进行了如下探究: 分解的催化效果,实验时对二者需要控制的变量是
分解的催化效果,实验时对二者需要控制的变量是______ 。如图甲,可通过观察______ 来定性比较两者的催化效果。写出 溶液用
溶液用 作催化剂分解的化学方程式
作催化剂分解的化学方程式______ 。
(2)如图乙,实验前检查该装置气密性的方法是______ 。定量比较两者的催化效果,可测量生成等体积气体所需的______ ;
(3)在 溶液中,究竟是哪种粒子起催化作用呢?
溶液中,究竟是哪种粒子起催化作用呢?
猜想1:铁离子;猜想2:______ ;猜想3:水分子。
小明同学认为可以排除猜想3,他这样认为的原因是______ 。
 溶液和
溶液和 溶液对
溶液对 分解的催化效果,某研究小组进行了如下探究:
分解的催化效果,某研究小组进行了如下探究:
 分解的催化效果,实验时对二者需要控制的变量是
分解的催化效果,实验时对二者需要控制的变量是 溶液用
溶液用 作催化剂分解的化学方程式
作催化剂分解的化学方程式(2)如图乙,实验前检查该装置气密性的方法是
(3)在
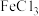 溶液中,究竟是哪种粒子起催化作用呢?
溶液中,究竟是哪种粒子起催化作用呢?猜想1:铁离子;猜想2:
小明同学认为可以排除猜想3,他这样认为的原因是
您最近一年使用:0次