名校
1 . 我国科研工作者通过研发新型催化剂,利用太阳能电池将工业排放的 转化为
转化为 ,实现碳中和目标,原理如图所示。下列说法正确的是
,实现碳中和目标,原理如图所示。下列说法正确的是
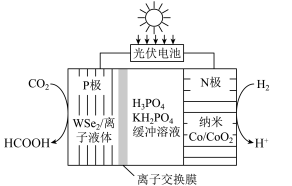
 转化为
转化为 ,实现碳中和目标,原理如图所示。下列说法正确的是
,实现碳中和目标,原理如图所示。下列说法正确的是
| A.该过程中存在的能量转化形式只有太阳能→化学能 |
| B.离子交换膜为阴离子交换膜 |
C.P极的电极反应式为: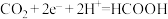 |
D.N极催化转化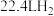 时,P极生成 时,P极生成 的质量为 的质量为 |
您最近半年使用:0次
2023-12-01更新
|
422次组卷
|
4卷引用:THUSSAT中学生标准学术能力诊断性测试2023-2024学年高三上学期11月月考理科综合化学试卷
2 . 过二硫酸铵[ ]具有强氧化性,广泛用于蓄电池工业,其电解法制备的装置如图所示:
]具有强氧化性,广泛用于蓄电池工业,其电解法制备的装置如图所示:

(1)已知:电解效率η的定义为
①M膜为___________ (填“阳”或“阴”)离子交换膜,生成 的电极反应式是
的电极反应式是___________ 。
②向阳极室和阴极室各加入100mL溶液。经测定制备的 的物质的量浓度为
的物质的量浓度为 ,在电极a、b表面共收集到
,在电极a、b表面共收集到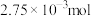 气体。则电极b表面收集到的气体是
气体。则电极b表面收集到的气体是___________ , 为
为___________ 。
(2)取电解后的b极室溶液少许于甲、乙两支试管中,进行下列实验:向甲试管中滴入酸化的KI和淀粉溶液并微热,溶液变蓝,说明过二硫酸铵具有___________ (填“氧化”或“还原”)性;向乙试管中滴入酸化的 溶液及1滴
溶液及1滴 溶液(催化)并微热,溶液变紫色,能说明该现象的离子方程式为
溶液(催化)并微热,溶液变紫色,能说明该现象的离子方程式为___________ 。
(3)以 为原料制备过二硫酸钾的主要流程如下:
为原料制备过二硫酸钾的主要流程如下:
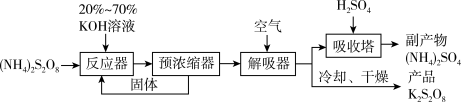
已知 受热分解可得
受热分解可得 、
、 等。
等。
①预浓缩得到的固体返回反应器再次与反应物作用的目的是___________ 。
②解吸器中通入空气的目的是___________ 。
 ]具有强氧化性,广泛用于蓄电池工业,其电解法制备的装置如图所示:
]具有强氧化性,广泛用于蓄电池工业,其电解法制备的装置如图所示:
(1)已知:电解效率η的定义为

①M膜为
 的电极反应式是
的电极反应式是②向阳极室和阴极室各加入100mL溶液。经测定制备的
 的物质的量浓度为
的物质的量浓度为 ,在电极a、b表面共收集到
,在电极a、b表面共收集到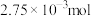 气体。则电极b表面收集到的气体是
气体。则电极b表面收集到的气体是 为
为(2)取电解后的b极室溶液少许于甲、乙两支试管中,进行下列实验:向甲试管中滴入酸化的KI和淀粉溶液并微热,溶液变蓝,说明过二硫酸铵具有
 溶液及1滴
溶液及1滴 溶液(催化)并微热,溶液变紫色,能说明该现象的离子方程式为
溶液(催化)并微热,溶液变紫色,能说明该现象的离子方程式为(3)以
 为原料制备过二硫酸钾的主要流程如下:
为原料制备过二硫酸钾的主要流程如下:
已知
 受热分解可得
受热分解可得 、
、 等。
等。①预浓缩得到的固体返回反应器再次与反应物作用的目的是
②解吸器中通入空气的目的是
您最近半年使用:0次
名校
解题方法
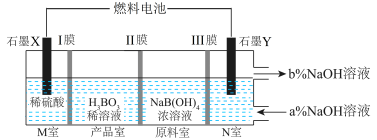
3 . 以甲烷燃料电池为电源电解 溶液制备
溶液制备 工作原理如图所示。下列说法正确的是
工作原理如图所示。下列说法正确的是
 溶液制备
溶液制备 工作原理如图所示。下列说法正确的是
工作原理如图所示。下列说法正确的是
A.N室中: |
| B.燃料电池通入氧气的电极接电解池的Y电极 |
| C.I、Ⅲ膜为阴离子交换膜,Ⅱ膜为阳离子交换膜 |
D.理论上每生成 产品,需消耗甲烷的体积为 产品,需消耗甲烷的体积为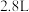 (标准状况) (标准状况) |
您最近半年使用:0次
2023-11-16更新
|
683次组卷
|
3卷引用:江苏省苏州市实验中学2023-2024学年高二上学期10月月考化学试题
名校
4 . 电解硫酸钠溶液制取电池正极材料 的前驱体
的前驱体 ,其工作原理如图所示:
,其工作原理如图所示:
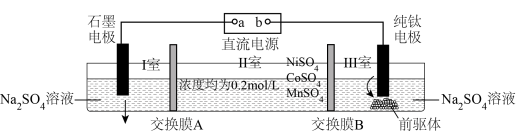
下列说法不正确 的是
 的前驱体
的前驱体 ,其工作原理如图所示:
,其工作原理如图所示:
下列说法
| A.a是直流电源的正极,石墨电极发生氧化反应 |
| B.交换膜A是阴离子交换膜,通电一段时间,Ⅰ室pH降低 |
C.当产生 的 的 时,标准状况下纯钛电极上至少产生 时,标准状况下纯钛电极上至少产生 气体 气体 |
| D.若将纯钛电极直接放入Ⅱ室,则纯钛电极上会有金属与前驱体附着而使产率降低 |
您最近半年使用:0次
2023-11-15更新
|
2311次组卷
|
6卷引用:浙江省宁波市2023-2024学年高三上学期选考模拟考试化学试题
浙江省宁波市2023-2024学年高三上学期选考模拟考试化学试题化学02(15+4模式)2024年1月“九省联考”考前化学猜想卷湖南省衡阳市第八中学2023-2024学年高三上学期1月月考化学(已下线)热点14 电化学及其应用(已下线)专题05 化学反应与能量(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)2024届湖南省长沙市第一中高三下学期高考适应性演练(一)化学试题
5 . 以四甲基氯化铵[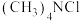 ]水溶液为原料,利用光伏并网发电装置制备四甲基氢氧化铵[
]水溶液为原料,利用光伏并网发电装置制备四甲基氢氧化铵[ ],下列叙述不正确的是
],下列叙述不正确的是

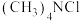 ]水溶液为原料,利用光伏并网发电装置制备四甲基氢氧化铵[
]水溶液为原料,利用光伏并网发电装置制备四甲基氢氧化铵[ ],下列叙述不正确的是
],下列叙述不正确的是
| A.a极电极发生还原反应 |
B.保持电流恒定,增大NaCl稀溶液浓度,制备 的反应速率增大 的反应速率增大 |
| C.c为阳离子交换膜,d为阴离子交换膜 |
| D.b极收集2.24L(标况)气体时,溶液中有0.4mol离子透过交换膜 |
您最近半年使用:0次
名校
6 . 最新研究开发的锌〜二氧化碳电池,是同时具备二氧化碳固定、利用和能量转化、存储的电池技术,其工作原理如图所示,其中X为锌电极,Y为钯纳米材料的催化剂电极,可以在水中根据电流的方向高效、高选择性地催化二氧化碳和甲酸的相互转化。

已知:双极膜是阴离子膜与阳离子膜的复合膜,该膜可在外加直流电场作用下将膜间的水解离成H+和OH⁻,并分别向膜两侧提供。下列说法错误的是

已知:双极膜是阴离子膜与阳离子膜的复合膜,该膜可在外加直流电场作用下将膜间的水解离成H+和OH⁻,并分别向膜两侧提供。下列说法错误的是
A.放电时负极电极反应为 |
B.标准状况下该电池固定 2.24 L时,在电路中有0.2 mol电子通过 2.24 L时,在电路中有0.2 mol电子通过 |
| C.双极膜中的X电极一侧为阴离子膜 |
| D.充电时Y极室溶液的pH降低 |
您最近半年使用:0次
2023-10-31更新
|
382次组卷
|
2卷引用:河北省保定市2023-2024学年高三上学期10月期中考试化学试题
名校
解题方法
7 . 设计如图所示装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCoO2(s)转化为Co2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法错误的是
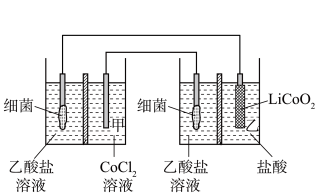

| A.为了保持细菌所在环境pH稳定,两侧都应选择质子交换膜 |
| B.乙室电极反应式为LiCoO2+e-+4H+=Co2++Li++2H2O |
| C.装置工作一段时间后,乙室的pH在减小 |
| D.若甲室Co2+减少150mg,乙室Co2+增加200mg,则此时已进行过溶液转移 |
您最近半年使用:0次
名校
8 . 电化学原理在工业生产及生活中发挥着巨大的作用。
Ⅰ.利用微电解技术可以处理工业废水,如酸性含铬废水(主要含有Cr2O )。原理是利用电极反应物与某些污染物反应,从而达到去除污物的作用。
)。原理是利用电极反应物与某些污染物反应,从而达到去除污物的作用。
(1)通常以铁板和石墨作为电极材料,应选________ 作阴极。
(2)废水中的Cr2O 通过反应转化为Cr3+,此过程的离子反应方程式为
通过反应转化为Cr3+,此过程的离子反应方程式为________ ,最终Cr3+以Cr(OH)3形式除去。
(3)当电路中每转移1.2mol电子,最多有________ mol Cr2O 参加反应。
参加反应。
Ⅱ.红矾钠(Na2Cr2O7•2H2O)是一种重要的化工原料。利用膜电解技术(装置如图所示),以Na2CrO4为主要原料制备Na2Cr2O7的总反应方程式为:4Na2CrO4+4H2O 2Na2Cr2O7+4NaOH+2H2↑+O2↑。
2Na2Cr2O7+4NaOH+2H2↑+O2↑。
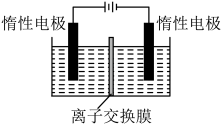
(4)电解时应选择________ (填“阴”“阳”)离子交换膜。阳极区的反应有________ ,NaOH在________ (填“阴”或“阳”)极室制得。
Ⅲ.用C3H8、O2和熔融Na2CO3组成的燃料电池作电源,电解饱和的K2S溶液和2mol•L-1AgNO3溶液制备某些单质,盐桥中充有饱和的KNO3溶液。
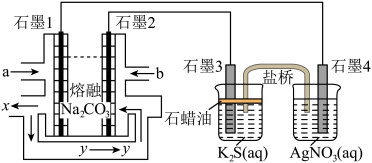
(5)石墨1电极反应式为________ ,物质y为________ 。
(6)若此装置通入C3H8的体积为2.24L(标准状况下),则可以制取单质硫的质量为________ 。
Ⅰ.利用微电解技术可以处理工业废水,如酸性含铬废水(主要含有Cr2O
 )。原理是利用电极反应物与某些污染物反应,从而达到去除污物的作用。
)。原理是利用电极反应物与某些污染物反应,从而达到去除污物的作用。(1)通常以铁板和石墨作为电极材料,应选
(2)废水中的Cr2O
 通过反应转化为Cr3+,此过程的离子反应方程式为
通过反应转化为Cr3+,此过程的离子反应方程式为(3)当电路中每转移1.2mol电子,最多有
 参加反应。
参加反应。Ⅱ.红矾钠(Na2Cr2O7•2H2O)是一种重要的化工原料。利用膜电解技术(装置如图所示),以Na2CrO4为主要原料制备Na2Cr2O7的总反应方程式为:4Na2CrO4+4H2O
 2Na2Cr2O7+4NaOH+2H2↑+O2↑。
2Na2Cr2O7+4NaOH+2H2↑+O2↑。
(4)电解时应选择
Ⅲ.用C3H8、O2和熔融Na2CO3组成的燃料电池作电源,电解饱和的K2S溶液和2mol•L-1AgNO3溶液制备某些单质,盐桥中充有饱和的KNO3溶液。

(5)石墨1电极反应式为
(6)若此装置通入C3H8的体积为2.24L(标准状况下),则可以制取单质硫的质量为
您最近半年使用:0次
名校
9 . Co是磁性合金的重要材料,也是维生素重要的组成元素。工业上可用如下装置制取单质Co并获得副产品盐酸(A、B均为离子交换膜):
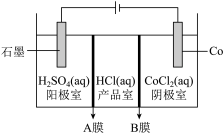
下列说法正确的是

下列说法正确的是
| A.若阴极析出11.8gCo,则加入0.2molCo(OH)2可将溶液恢复至原状态 |
| B.A为阳离子交换膜,B为阴离子交换膜 |
| C.若产品室Δn(HCl)=0.2mol,阴极溶液质量减少5.9g |
| D.电解结束后,阳极室溶液中H+的浓度减小 |
您最近半年使用:0次
2023-10-18更新
|
274次组卷
|
3卷引用:山东学情2023-2024学年高二上学期10月质量检测(鲁科版)化学试题
名校
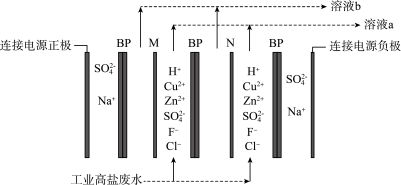
10 . 某有色金属工业的高盐废水中主要含有 、
、 、
、 、
、 、
、 和
和 ,利用如图电解装置可回收
,利用如图电解装置可回收 、
、 并尽可能除去
并尽可能除去 和
和 ,其中双极膜(BP)中间层的
,其中双极膜(BP)中间层的 被解离为
被解离为 和
和 ,并在直流电场作用下分别向两极迁移,M膜、N膜需在一价阴离子交换膜和阳离子交换膜中选择。下列说法正确的是
,并在直流电场作用下分别向两极迁移,M膜、N膜需在一价阴离子交换膜和阳离子交换膜中选择。下列说法正确的是
 、
、 、
、 、
、 、
、 和
和 ,利用如图电解装置可回收
,利用如图电解装置可回收 、
、 并尽可能除去
并尽可能除去 和
和 ,其中双极膜(BP)中间层的
,其中双极膜(BP)中间层的 被解离为
被解离为 和
和 ,并在直流电场作用下分别向两极迁移,M膜、N膜需在一价阴离子交换膜和阳离子交换膜中选择。下列说法正确的是
,并在直流电场作用下分别向两极迁移,M膜、N膜需在一价阴离子交换膜和阳离子交换膜中选择。下列说法正确的是
| A.电解过程中,不需要控制高盐废水的pH |
B.BP膜中 均向右侧溶液迁移,M膜为一价阴离子交换膜 均向右侧溶液迁移,M膜为一价阴离子交换膜 |
C.溶液a的溶质主要为HF和HCl,溶液b的溶质主要为 和 和 |
| D.当阳极产生22.4L气体(标准状况)时,理论上有2mol离子通过N膜 |
您最近半年使用:0次
2023-10-17更新
|
195次组卷
|
2卷引用:安徽省十五校卓越联盟体2024届高三上学期10月联考化学试题



