1 . 一氯甲烷主要用于生产甲基氯硅烷,一氯乙烯主要用于生产聚氯乙烯等高聚物,1,2-二氯乙烷常用作有机溶剂和化工原料。回答下列问题:
I.在加热或光照条件下,“甲烷一氯气”法得到一氯甲烷是按自由基机理进行的,即CH4(g)+Cl2(g) CH3Cl(g)+HCl(g) △H。该反应涉及两个基元步骤①②,其相对能量一反应历程图如图:
CH3Cl(g)+HCl(g) △H。该反应涉及两个基元步骤①②,其相对能量一反应历程图如图:
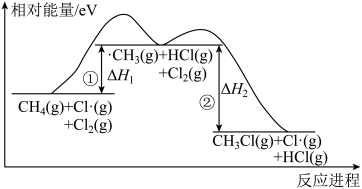
(1)已知H3C-H键能为4.56eV,H-Cl键能为4.46eV,1eV相当于96.5kJ/mol。则步骤①的焓变△H1=_______ kJ/mol;一氯取代反应的总焓变△H=______ (用△H1、△H2表示)。
Ⅱ.一氯乙烯(CH2=CHC1)的工业生产方法之一是乙烯氯化裂解法,该方法分以下两个过程进行:
乙烯氯化加成:CH2=CH2(g)+Cl2(g) ClCH2CH2Cl(g) △H1=-171.7kJ/mol
ClCH2CH2Cl(g) △H1=-171.7kJ/mol
1,2-二氯乙烷裂解:ClCH2CH2Cl(g) CH2=CHCl(g)+HCl(g) △H2=+73.4kJ/mol
CH2=CHCl(g)+HCl(g) △H2=+73.4kJ/mol
(2)乙烯氯化加成反应在热力学上进行的趋势很大,原因是______ 。1,2-二氯乙烷裂解反应的△S=+145.7J mol/K,则该裂解反应能自发进行的最低温度约为
mol/K,则该裂解反应能自发进行的最低温度约为______ K(保留整数)。
(3)在某恒压密闭容器中通入一定量的ClCH2CH2Cl(g),仅发生1,2-二氯乙烷裂解生成氯乙烯和氯化氢,实验测得ClCH2CH2Cl(g)的转化率随温度和反应时间的关系如图所示。

①T1、T2、T3的大小关系为_______ ,原因是_______ 。
②若M点刚好达到平衡状态,则N点的v正_____ v逆(填“大于”“小于”或“等于”)。Ka是以物质的量分数表示的平衡常数,则T2温度下1,2-二氯乙烷裂解生成氯乙烯和氯化氢的反应的Kx=_____ 保留2位小数)。
Ⅲ.一种电化学合成1,2-二氯乙婉的实验装置如图所示
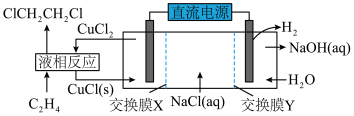
(4)交换膜X是______ 离子交换膜(填“阴”或“阳”),该实验装置合成1,2-二氯乙烷的总反应的化学方程式为______ 。
I.在加热或光照条件下,“甲烷一氯气”法得到一氯甲烷是按自由基机理进行的,即CH4(g)+Cl2(g)
 CH3Cl(g)+HCl(g) △H。该反应涉及两个基元步骤①②,其相对能量一反应历程图如图:
CH3Cl(g)+HCl(g) △H。该反应涉及两个基元步骤①②,其相对能量一反应历程图如图:
(1)已知H3C-H键能为4.56eV,H-Cl键能为4.46eV,1eV相当于96.5kJ/mol。则步骤①的焓变△H1=
Ⅱ.一氯乙烯(CH2=CHC1)的工业生产方法之一是乙烯氯化裂解法,该方法分以下两个过程进行:
乙烯氯化加成:CH2=CH2(g)+Cl2(g)
 ClCH2CH2Cl(g) △H1=-171.7kJ/mol
ClCH2CH2Cl(g) △H1=-171.7kJ/mol1,2-二氯乙烷裂解:ClCH2CH2Cl(g)
 CH2=CHCl(g)+HCl(g) △H2=+73.4kJ/mol
CH2=CHCl(g)+HCl(g) △H2=+73.4kJ/mol(2)乙烯氯化加成反应在热力学上进行的趋势很大,原因是
 mol/K,则该裂解反应能自发进行的最低温度约为
mol/K,则该裂解反应能自发进行的最低温度约为(3)在某恒压密闭容器中通入一定量的ClCH2CH2Cl(g),仅发生1,2-二氯乙烷裂解生成氯乙烯和氯化氢,实验测得ClCH2CH2Cl(g)的转化率随温度和反应时间的关系如图所示。

①T1、T2、T3的大小关系为
②若M点刚好达到平衡状态,则N点的v正
Ⅲ.一种电化学合成1,2-二氯乙婉的实验装置如图所示

(4)交换膜X是
您最近半年使用:0次
2024-03-18更新
|
115次组卷
|
2卷引用:河北省石家庄市辛集中学、衡水中学2023-2024高三上学期期末联考化学试题
名校
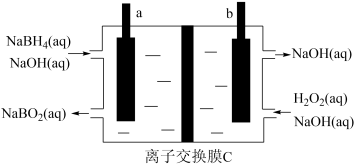
2 . 硼氢化钠( )广泛用于化工生产,常温下能与水反应,易溶于异丙胺(沸点为
)广泛用于化工生产,常温下能与水反应,易溶于异丙胺(沸点为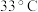 )。工业上可用硼镁矿(主要成分为
)。工业上可用硼镁矿(主要成分为 ,含少量杂质
,含少量杂质 )制取
)制取 ,其工艺流程如下:
,其工艺流程如下:
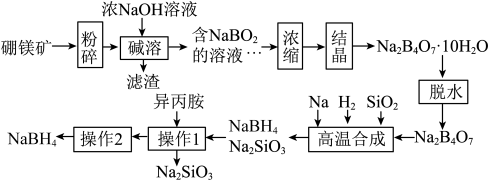
回答下列问题:
(1)粉碎的目的是___________ 。
(2) 的空间结构为
的空间结构为___________ 。
(3)滤渣的成分是___________ 。
(4)高温合成发生的化学反应方程式为___________ ,操作2的名称为___________ ,流程中可循环利用的物质是___________ 。
(5)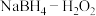 燃料电池有望成为低温环境下工作的便携式燃料电池,其工作原理如图所示。离子交换膜C为
燃料电池有望成为低温环境下工作的便携式燃料电池,其工作原理如图所示。离子交换膜C为___________ 交换膜(填“阳离子”或“阴离子”),a极发生的电极方程式为___________ 。
 )广泛用于化工生产,常温下能与水反应,易溶于异丙胺(沸点为
)广泛用于化工生产,常温下能与水反应,易溶于异丙胺(沸点为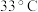 )。工业上可用硼镁矿(主要成分为
)。工业上可用硼镁矿(主要成分为 ,含少量杂质
,含少量杂质 )制取
)制取 ,其工艺流程如下:
,其工艺流程如下:
回答下列问题:
(1)粉碎的目的是
(2)
 的空间结构为
的空间结构为(3)滤渣的成分是
(4)高温合成发生的化学反应方程式为
(5)
 燃料电池有望成为低温环境下工作的便携式燃料电池,其工作原理如图所示。离子交换膜C为
燃料电池有望成为低温环境下工作的便携式燃料电池,其工作原理如图所示。离子交换膜C为
您最近半年使用:0次
3 . 过二硫酸铵[ ]具有强氧化性,广泛用于蓄电池工业,其电解法制备的装置如图所示:
]具有强氧化性,广泛用于蓄电池工业,其电解法制备的装置如图所示:

(1)已知:电解效率η的定义为
①M膜为___________ (填“阳”或“阴”)离子交换膜,生成 的电极反应式是
的电极反应式是___________ 。
②向阳极室和阴极室各加入100mL溶液。经测定制备的 的物质的量浓度为
的物质的量浓度为 ,在电极a、b表面共收集到
,在电极a、b表面共收集到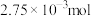 气体。则电极b表面收集到的气体是
气体。则电极b表面收集到的气体是___________ , 为
为___________ 。
(2)取电解后的b极室溶液少许于甲、乙两支试管中,进行下列实验:向甲试管中滴入酸化的KI和淀粉溶液并微热,溶液变蓝,说明过二硫酸铵具有___________ (填“氧化”或“还原”)性;向乙试管中滴入酸化的 溶液及1滴
溶液及1滴 溶液(催化)并微热,溶液变紫色,能说明该现象的离子方程式为
溶液(催化)并微热,溶液变紫色,能说明该现象的离子方程式为___________ 。
(3)以 为原料制备过二硫酸钾的主要流程如下:
为原料制备过二硫酸钾的主要流程如下:
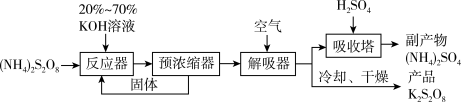
已知 受热分解可得
受热分解可得 、
、 等。
等。
①预浓缩得到的固体返回反应器再次与反应物作用的目的是___________ 。
②解吸器中通入空气的目的是___________ 。
 ]具有强氧化性,广泛用于蓄电池工业,其电解法制备的装置如图所示:
]具有强氧化性,广泛用于蓄电池工业,其电解法制备的装置如图所示:
(1)已知:电解效率η的定义为

①M膜为
 的电极反应式是
的电极反应式是②向阳极室和阴极室各加入100mL溶液。经测定制备的
 的物质的量浓度为
的物质的量浓度为 ,在电极a、b表面共收集到
,在电极a、b表面共收集到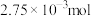 气体。则电极b表面收集到的气体是
气体。则电极b表面收集到的气体是 为
为(2)取电解后的b极室溶液少许于甲、乙两支试管中,进行下列实验:向甲试管中滴入酸化的KI和淀粉溶液并微热,溶液变蓝,说明过二硫酸铵具有
 溶液及1滴
溶液及1滴 溶液(催化)并微热,溶液变紫色,能说明该现象的离子方程式为
溶液(催化)并微热,溶液变紫色,能说明该现象的离子方程式为(3)以
 为原料制备过二硫酸钾的主要流程如下:
为原料制备过二硫酸钾的主要流程如下:
已知
 受热分解可得
受热分解可得 、
、 等。
等。①预浓缩得到的固体返回反应器再次与反应物作用的目的是
②解吸器中通入空气的目的是
您最近半年使用:0次
名校
解题方法
4 . 2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:
(1)在一定温度下,向体积固定 的密闭容器中加入足量的C(s)和1molH2O(g),起始压强为0.2MPa时,发生下列反应生成水煤气:
Ⅰ、C(s)+H2O(g) CO(g)+H2(g) △H1=+131.4kJ/mol
CO(g)+H2(g) △H1=+131.4kJ/mol
Ⅱ、CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41.1kJ/mol
CO2(g)+H2(g) △H2=-41.1kJ/mol
①上述反应达平衡后,若升高温度,则CO的平衡体积分数___________ (填“增大”、“减小”或“不变”),其理由是___________ ;
②下列说法正确的是___________ ;
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.加入合适催化剂,可以提高H2O(g)的平衡转化率
D.将炭块粉碎,可加快反应速率
③反应Ⅰ、Ⅱ均达平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1mol。求反应Ⅰ的平衡常数Kp=___________ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)工业上常用电解法制备物质,回答下列问题:
①电解V2O5制备金属钒的装置如图1所示,熔融CaCl2可传导O2-。则石墨电极Y接直流电源___________ (填“正极”或“负极”),阴极电极反应式为___________ 。
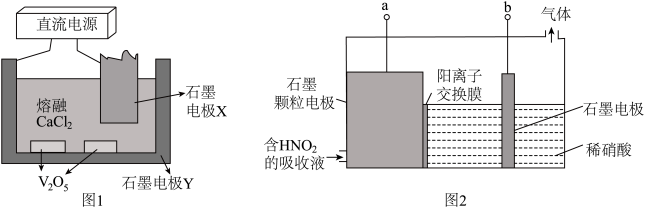
②工业上脱硝常用6%的稀硝酸吸收NOx生成HNO2(提示:HNO2为弱酸),再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图2所示。
i、当电路中有0.4mol电子转移时,有___________ molH+需要通过阳离子交换膜发生移动。
ii、阳极电极反应式为___________ 。
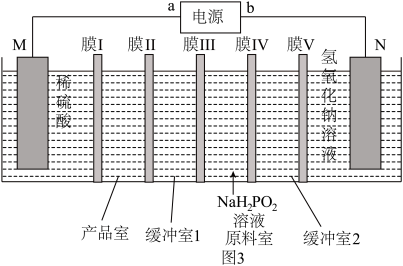
③用金属钴和不锈钢作电极材料,通过电渗析法制取Co(H2PO2)2的原理如图3所示。N的电极材料是___________ (填“金属钴”或“不锈钢”),M极的电极反应式为___________ ,膜Ⅱ为___________ (填“阴”或“阳”)离子变换膜。
(1)在一定温度下,向
Ⅰ、C(s)+H2O(g)
 CO(g)+H2(g) △H1=+131.4kJ/mol
CO(g)+H2(g) △H1=+131.4kJ/molⅡ、CO(g)+H2O(g)
 CO2(g)+H2(g) △H2=-41.1kJ/mol
CO2(g)+H2(g) △H2=-41.1kJ/mol①上述反应达平衡后,若升高温度,则CO的平衡体积分数
②下列说法正确的是
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.加入合适催化剂,可以提高H2O(g)的平衡转化率
D.将炭块粉碎,可加快反应速率
③反应Ⅰ、Ⅱ均达平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1mol。求反应Ⅰ的平衡常数Kp=
(2)工业上常用电解法制备物质,回答下列问题:
①电解V2O5制备金属钒的装置如图1所示,熔融CaCl2可传导O2-。则石墨电极Y接直流电源

②工业上脱硝常用6%的稀硝酸吸收NOx生成HNO2(提示:HNO2为弱酸),再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图2所示。
i、当电路中有0.4mol电子转移时,有
ii、阳极电极反应式为
③用金属钴和不锈钢作电极材料,通过电渗析法制取Co(H2PO2)2的原理如图3所示。N的电极材料是

您最近半年使用:0次
名校
5 . 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许正离子通过。
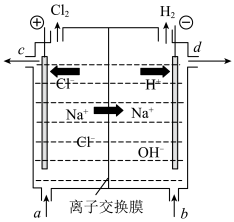
(1)写出电解饱和食盐水的离子方程式_______
(2)写出阴极的电极反应式_______
(3)离子交换膜的作用为_______ 、_______ 。
(4)精制饱和食盐水从图中_______ 位置补充,氢氧化钠溶液从图中_______ 位置流出。(选填“a”、“b”、“c”或“d”)
氯气和烧碱溶液反应可以制得“84”消毒液,可杀灭新冠病毒。
已知:
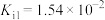
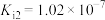 HClO
HClO 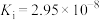

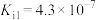
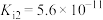
(5)生活中不可将NaClO与洁厕灵(含有盐酸)混合使用,是因为二者会反应生成_______。
(6)室温下, NaClO溶液的pH
NaClO溶液的pH_______ 
 溶液的pH。(选填“大于”、“小于”或“等于”)
溶液的pH。(选填“大于”、“小于”或“等于”)
(7)浓度均为 的
的 和
和 的混合溶液中,
的混合溶液中, 、
、 浓度从大到小的顺序为
浓度从大到小的顺序为_______ 。

(1)写出电解饱和食盐水的离子方程式
(2)写出阴极的电极反应式
(3)离子交换膜的作用为
(4)精制饱和食盐水从图中
氯气和烧碱溶液反应可以制得“84”消毒液,可杀灭新冠病毒。
已知:

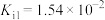
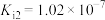 HClO
HClO 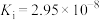

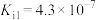
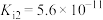
(5)生活中不可将NaClO与洁厕灵(含有盐酸)混合使用,是因为二者会反应生成_______。
| A.次氯酸 | B.高氯酸 | C.氯气 | D.氧气 |
 NaClO溶液的pH
NaClO溶液的pH
 溶液的pH。(选填“大于”、“小于”或“等于”)
溶液的pH。(选填“大于”、“小于”或“等于”)(7)浓度均为
 的
的 和
和 的混合溶液中,
的混合溶液中, 、
、 浓度从大到小的顺序为
浓度从大到小的顺序为
您最近半年使用:0次
名校
6 . 铁镍矿是一种重要的金属材料,主要用于制备铁镍合金,还用于制备镍氢电池的材料。某铁镍矿石的主要成分是四氧化三铁和硫酸镍,还含有铜、钙、镁、硅的氧化物。由该铁镍矿制备高纯度的氢氧化镍,工艺流程如下:
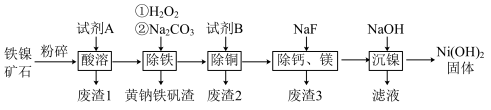
回答下列问题:
(1)铁镍矿石粉碎的目的是_______ 。
(2)“酸溶”时,所加入的试剂A是硫酸,溶液中有 等
等_______ 种金属阳离子生成,废渣1的主要成分的化学式为_______ 。
(3)“除铁”时 的作用是
的作用是_______ 。
(4)“除铜”时,所用的试剂B可选用 或
或 ,你认为选用最好的是
,你认为选用最好的是_______ ,反应的离子方程式为_______ 。
(5)“除钙、镁”过程形成的废渣3的化学式为_______ 。
(6)已知常温下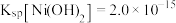 ,该流程在“沉镍”过程中,需调节溶液
,该流程在“沉镍”过程中,需调节溶液 约为
约为_______ 时, 才刚好沉淀完全(离子沉淀完全的浓度
才刚好沉淀完全(离子沉淀完全的浓度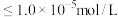 ;
;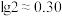 )。
)。
(7)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4。
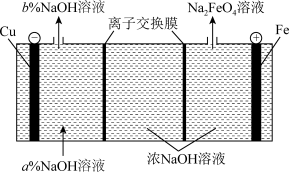
①阳极的电极反应式为_______ 。
②右侧的离子交换膜为_______ (填“阴”或“阳”)离子交换膜,阴极区a%_______ b%(填“>”、“=”或“<”)。
③Na2FeO4作为高效净水剂的工作原理是:_______ 。

回答下列问题:
(1)铁镍矿石粉碎的目的是
(2)“酸溶”时,所加入的试剂A是硫酸,溶液中有
 等
等(3)“除铁”时
 的作用是
的作用是(4)“除铜”时,所用的试剂B可选用
 或
或 ,你认为选用最好的是
,你认为选用最好的是(5)“除钙、镁”过程形成的废渣3的化学式为
(6)已知常温下
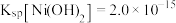 ,该流程在“沉镍”过程中,需调节溶液
,该流程在“沉镍”过程中,需调节溶液 约为
约为 才刚好沉淀完全(离子沉淀完全的浓度
才刚好沉淀完全(离子沉淀完全的浓度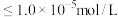 ;
;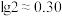 )。
)。(7)Na2FeO4是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4。

①阳极的电极反应式为
②右侧的离子交换膜为
③Na2FeO4作为高效净水剂的工作原理是:
您最近半年使用:0次
名校
解题方法
7 . 利用电化学方法可以将 有效地转化为
有效地转化为 (其中C元素的化合价为+2价)。装置如图所示。
(其中C元素的化合价为+2价)。装置如图所示。
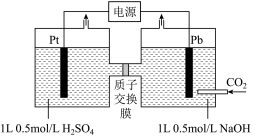
(1)在该装置中,左侧Pt电极为______ (填“阴极”或“阳极”)。
(2)装置工作时,阴极除有 生成外,还可能生成副产物降低电解效率。
生成外,还可能生成副产物降低电解效率。
已知:电解效率= ×100%。
×100%。
①阴极区的副产物可能是______ (写出一种即可,写化学式)。
②标准状况下,当阳极生成氧气体积为224mL时,测得整个阴极区内的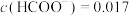 mol/L,电解效率为
mol/L,电解效率为______ (忽略电解前后溶液的体积变化)。
(3)研究表明,溶液pH会影响 转化为
转化为 的效率。如图所示,是
的效率。如图所示,是 (以
(以 计)在水溶液中各种存在形式的物质的量分数δ随pH变化的情况。
计)在水溶液中各种存在形式的物质的量分数δ随pH变化的情况。
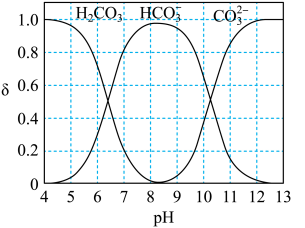
①pH>12时, 几乎未转化为
几乎未转化为 ,此时
,此时 在溶液中的主要存在形式为
在溶液中的主要存在形式为______ 。
②pH=8.5时, 的转化效率较高,溶液中相应的电极反应式为
的转化效率较高,溶液中相应的电极反应式为______ 。有人认为,在此条件下装置工作一段时间后,阴极附近溶液的pH几乎不发生变化(忽略电解前后溶液的体积变化)。你是否同意他的观点______ (填“是”或“否”),请说明理由______ 。
 有效地转化为
有效地转化为 (其中C元素的化合价为+2价)。装置如图所示。
(其中C元素的化合价为+2价)。装置如图所示。
(1)在该装置中,左侧Pt电极为
(2)装置工作时,阴极除有
 生成外,还可能生成副产物降低电解效率。
生成外,还可能生成副产物降低电解效率。已知:电解效率=
 ×100%。
×100%。①阴极区的副产物可能是
②标准状况下,当阳极生成氧气体积为224mL时,测得整个阴极区内的
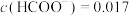 mol/L,电解效率为
mol/L,电解效率为(3)研究表明,溶液pH会影响
 转化为
转化为 的效率。如图所示,是
的效率。如图所示,是 (以
(以 计)在水溶液中各种存在形式的物质的量分数δ随pH变化的情况。
计)在水溶液中各种存在形式的物质的量分数δ随pH变化的情况。
①pH>12时,
 几乎未转化为
几乎未转化为 ,此时
,此时 在溶液中的主要存在形式为
在溶液中的主要存在形式为②pH=8.5时,
 的转化效率较高,溶液中相应的电极反应式为
的转化效率较高,溶液中相应的电极反应式为
您最近半年使用:0次
2022-11-15更新
|
192次组卷
|
3卷引用:山东省实验中学2022-2023学年高二上学期11月期中考试化学试题
名校
8 . 回答下列问题
(1)近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中。再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。科学家还研究了其他转化温室气体的方法,利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为_______ 。

(2)氢气是一种理想的清洁能源,其制取与储存是氢能源利用领域的研究热点。有一种制氢方法为光电化学分解。其原理如图所示,钛酸锶光电极的电极反应为 ,则铂电极的电极反应为
,则铂电极的电极反应为_______ 。

(3)熔融盐燃料电池具有较高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3 (其中不含O2-和 )为电解质,以丁烷为燃料,以空气中的氧气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为
)为电解质,以丁烷为燃料,以空气中的氧气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为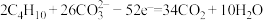 。试回答下列问题:
。试回答下列问题:
①该燃料电池的总反应式为_______ 。
②正极电极反应式为_______ 。
③为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是_______ ,它来自_______ 。
(1)近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中。再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。科学家还研究了其他转化温室气体的方法,利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为

(2)氢气是一种理想的清洁能源,其制取与储存是氢能源利用领域的研究热点。有一种制氢方法为光电化学分解。其原理如图所示,钛酸锶光电极的电极反应为
 ,则铂电极的电极反应为
,则铂电极的电极反应为
(3)熔融盐燃料电池具有较高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3 (其中不含O2-和
 )为电解质,以丁烷为燃料,以空气中的氧气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为
)为电解质,以丁烷为燃料,以空气中的氧气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为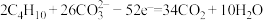 。试回答下列问题:
。试回答下列问题:①该燃料电池的总反应式为
②正极电极反应式为
③为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是
您最近半年使用:0次
名校
9 . 回答下列问题:
(1)向100mL 0.01mol/L Ba(OH)2溶液中滴加 0.1mol/L NaHCO3溶液,测得溶液电导率的变化如下图:
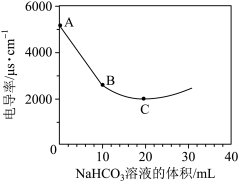
用_______ (离子方程式 )表示B→C这一过程中发生的化学反应。
(2)①写出属于苯的同系物,同时含有8个碳原子且苯环上的一氯代物有3种的有机物的结构简式:_______ 、_______ 。
②邻苯二甲酸与乙二醇1:1发生缩聚反应的化学方程式为_______ 。
③对甲基苯酚与乙醛在酸性条件下合成酚醛树脂的化学方程式为_______ 。
(3)以CO和H2为原料合成甲醇是工业上的成熟方法,直接以CO2为原料生产甲醇是目前的研究热点。我国科学家用CO2人工合成淀粉时,第一步就需要将CO2转化为甲醇。
已知:① CO(g) +2H2(g)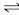 CH3OH(g) Δ H1 = -90.5 kJ·mol-1
CH3OH(g) Δ H1 = -90.5 kJ·mol-1
② CO(g) + H2O(g)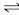 CO2(g) + H2(g) Δ H2 = -41.1 kJ·mol-1
CO2(g) + H2(g) Δ H2 = -41.1 kJ·mol-1
CO2与H2合成甲醇的热化学方程式 为_______ 。
(4)研究人员用Ni、Fe作电极电解浓KOH溶液制备K2FeO4,装置示意图如下。
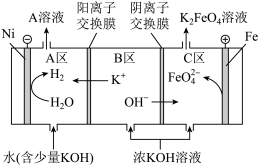
① Ni电极作_______ (填“阴”或“阳”)极。
② Fe电极上的电极反应式为_______ 。
③ A溶液为KOH溶液,请结合化学用语解释其生成过程:_______ 。
(1)向100mL 0.01mol/L Ba(OH)2溶液中滴加 0.1mol/L NaHCO3溶液,测得溶液电导率的变化如下图:

用
(2)①写出属于苯的同系物,同时含有8个碳原子且苯环上的一氯代物有3种的有机物的结构简式:
②邻苯二甲酸与乙二醇1:1发生缩聚反应的化学方程式为
③对甲基苯酚与乙醛在酸性条件下合成酚醛树脂的化学方程式为
(3)以CO和H2为原料合成甲醇是工业上的成熟方法,直接以CO2为原料生产甲醇是目前的研究热点。我国科学家用CO2人工合成淀粉时,第一步就需要将CO2转化为甲醇。
已知:① CO(g) +2H2(g)
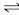 CH3OH(g) Δ H1 = -90.5 kJ·mol-1
CH3OH(g) Δ H1 = -90.5 kJ·mol-1② CO(g) + H2O(g)
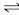 CO2(g) + H2(g) Δ H2 = -41.1 kJ·mol-1
CO2(g) + H2(g) Δ H2 = -41.1 kJ·mol-1CO2与H2合成甲醇的
(4)研究人员用Ni、Fe作电极电解浓KOH溶液制备K2FeO4,装置示意图如下。

① Ni电极作
② Fe电极上的电极反应式为
③ A溶液为KOH溶液,请结合化学用语解释其生成过程:
您最近半年使用:0次
名校
10 . 电化学原理在工业生产、物质制备、污染物理处理等方面应用广泛,请按要求回答下列问题。
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。
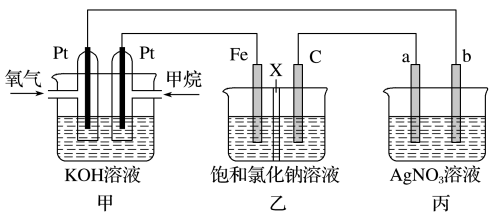
请按要求回答相关问题:
(1)乙中X是_______ 交换膜,甲烷燃料电池负极电极反应式是_______ 。
(2)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成气体的物质的量为_______ 。
(3)欲用丙装置给铜镀银,b应是_______ (填化学式)。
(4)将0.2 mol AgNO3、0.4 mol Cu(NO3)2、0.6 mol KCl溶于水,配成100 mL溶液,用惰性电极电解一段时间后,某一电极上析出了0.3 mol Cu,此时在另一电极上产生的气体体积(标准状况)为_______ L
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。

请按要求回答相关问题:
(1)乙中X是
(2)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成气体的物质的量为
(3)欲用丙装置给铜镀银,b应是
(4)将0.2 mol AgNO3、0.4 mol Cu(NO3)2、0.6 mol KCl溶于水,配成100 mL溶液,用惰性电极电解一段时间后,某一电极上析出了0.3 mol Cu,此时在另一电极上产生的气体体积(标准状况)为
您最近半年使用:0次



