名校
1 . 有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
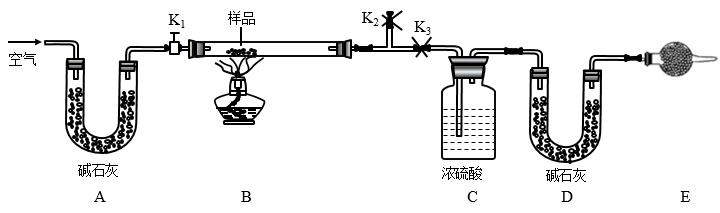
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是______ 。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是______ 。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为______ 、______ 。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对NaCl质量测定结果的影响是______ 。(填“偏大”“偏小”或“无影响”)。
②E处干燥管中盛放的药品是碱石灰,其作用是______ ,如果实验中没有该装置,则会导致测量结果NaHCO3的质量______ (填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为______ (用含w、m1、m2的代数式表示)。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对NaCl质量测定结果的影响是
②E处干燥管中盛放的药品是碱石灰,其作用是
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为
您最近一年使用:0次
2021-02-20更新
|
428次组卷
|
20卷引用:贵州省贞丰县第二中学2019-2020学年高一上学期期末考试化学试题
贵州省贞丰县第二中学2019-2020学年高一上学期期末考试化学试题云南省通海三中2019-2020学年高一上学期期末考试化学试题云南省玉溪市通海二中2019-2020学年高一上学期期末考试化学试题云南省迪庆州维西县第二中学2019-2020学年高一上学期期末考试化学试题云南省富宁县三中2019-2020学年高一上学期期末考试化学试题云南省普洱市镇沅县第一中学2019—2020学年高一上学期期末考试化学试题云南省丽江市永胜县第二中学2019—2020学年高一上学期期末考试化学试题云南省盐津县第三中学2019-2020学年高一上学期期末考试化学试题云南省昭通市彝良县一中2019—2020学年高一上学期期末考试化学试题云南省昭通市大关县第二中学2019-2020学年高一上学期期末考试化学试题贵州省榕江县第三高级中学2019-2020学年高一上学期期末考试化学试题云南省曲靖市马龙区第二中学2019-2020学年 高一上学期期末考试化学试题云南省曲靖市富源县第六中学2019-2020学年高一上学期期末考试化学试题云南省昆明市寻甸县第五中学2019-2020学年高一上学期期末考试化学试题广西河池市都安第五高中2019-2020学年高一上学期期末考试化学试题广西来宾市象州县中学2019-2020学年高一上学期期末考试化学试题四川省泸县第五中学2019-2020学年高一下学期第一次在线月考化学试题安徽省滁州市定远县重点中学2020-2021学年高一10月月考化学试题重庆实验中学2020-2021学年高一上学期第一阶段测试化学试题四川省遂宁中学校2020-2021学年高一上学期12月月考化学试题
名校
解题方法
2 . 固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,下列有关说法中不正确的是
| A.1molNH5中含有5NA个N-H键 | B.NH5是离子化合物 |
C.NH5的电子式为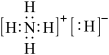 | D.NH5与水反应的化学方程式为NH5+H2O=NH3•H2O+H2↑ |
您最近一年使用:0次
2020-08-20更新
|
1744次组卷
|
6卷引用:贵州省兴义一中2020-2021学年高一上学期第三次考试化学试题
3 . 镁、铝、铁合金投入300mL 溶液中,金属恰好溶解,分别转化成
溶液中,金属恰好溶解,分别转化成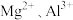 和
和 ;还原产物为NO,在标准状况下体积为6.72L。在反应后的溶液中加入300mL某浓度的NaOH溶液,金属阳离子恰好全部沉淀,干燥后测得质量为27.2g。下列有关推断正确的是
;还原产物为NO,在标准状况下体积为6.72L。在反应后的溶液中加入300mL某浓度的NaOH溶液,金属阳离子恰好全部沉淀,干燥后测得质量为27.2g。下列有关推断正确的是
 溶液中,金属恰好溶解,分别转化成
溶液中,金属恰好溶解,分别转化成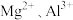 和
和 ;还原产物为NO,在标准状况下体积为6.72L。在反应后的溶液中加入300mL某浓度的NaOH溶液,金属阳离子恰好全部沉淀,干燥后测得质量为27.2g。下列有关推断正确的是
;还原产物为NO,在标准状况下体积为6.72L。在反应后的溶液中加入300mL某浓度的NaOH溶液,金属阳离子恰好全部沉淀,干燥后测得质量为27.2g。下列有关推断正确的是A.参加反应的 的物质的量为0.9mol 的物质的量为0.9mol | B.NaOH的物质的量浓度为6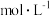 |
| C.参加反应的金属的质量为11.9g | D. 的物质的量浓度为3 的物质的量浓度为3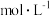 |
您最近一年使用:0次
2020-05-01更新
|
977次组卷
|
11卷引用:贵州省黔西南布依族苗族自治州望谟民族中学2019-2020学年高一上学期期末考试化学试题
贵州省黔西南布依族苗族自治州望谟民族中学2019-2020学年高一上学期期末考试化学试题吉林省吉林市长春汽车经济开发区第六中学2016-2017学年高一下学期期末考试化学试题云南省元江县一中2018-2019学年高一上学期12月考试化学试题浙江省东阳中学2019-2020学年高二上学期期中考试化学试题云南省镇康县第一中学2019-2020学年高一12月月考化学试题人教版高一化学必修1第四章《非金属及其化合物》测试卷贵州省天柱县第二中学2019-2020学年高一上学期期末考试化学试题陕西省渭南韩城市2019-2020学年高二上学期竞赛考试化学试题河南省长葛市第一高级中学2020-2021学年高二上学期阶段性测试试卷化学试题上海市黄浦区大同中学2020-2021学年高二上学期期中考试化学试题湖南省长沙市第一中学2023-2024学年高一上学期期中考试化学试题
解题方法
4 . 某研究小组制备氯气并对产生氯气的条件进行探究。
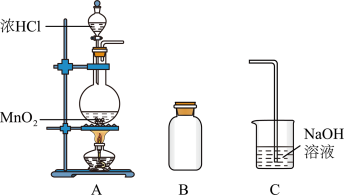
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的___________ (填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是___________ 。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向_____________ 。
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是____________________________________________________________ 。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
①已知MnO2呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是___________________________________________________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是__________________________________ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是____________________________ ;
将ⅰ、ⅱ作对比,得出的结论是___________________________________ 。

(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的
(2)A中产生的气体不纯,含有的杂质可能是
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。
| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将MnO2和12mol L-1浓盐酸混合 L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ 中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅲ | 加热MnO2和4mol L-1稀盐酸混合物 L-1稀盐酸混合物 | 无明显现象 |
②Ⅱ中发生了分解反应,反应的化学方程式是
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是
将ⅰ、ⅱ作对比,得出的结论是
您最近一年使用:0次
2020-02-23更新
|
402次组卷
|
4卷引用:贵州省黔西南布依族苗族自治州册亨县第三中学2019-2020学年高一上学期期末考试化学试题
解题方法
5 . 离子方程式Ba2++SO42-=BaSO4↓可以表示( )
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与稀硫酸之间的反应
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与稀硫酸之间的反应
| A.① | B.①②④ | C.②③ | D.①②③ |
您最近一年使用:0次
6 . (1)2molOH-中含有____ mol质子,____ mol电子。
(2)2molNH3的质量为____ ,在标准状况下的体积为____ ,其中含H的物质的量为____ 。
(3)同温同压下,同体积的CO2和H2的物质的量之比为____ 原子数之比为_____ 。
(4)36gH2O中含有H与___ LCH4(标准状况下)中含有的H相同。
(5)同温同体积下,2molCH4与3molCO分别装入两个密闭容器中,其的压强之比为____ ,密度之比为____ 。
(2)2molNH3的质量为
(3)同温同压下,同体积的CO2和H2的物质的量之比为
(4)36gH2O中含有H与
(5)同温同体积下,2molCH4与3molCO分别装入两个密闭容器中,其的压强之比为
您最近一年使用:0次
名校
7 . 能正确表示下列化学反应的离子方程式的是( )
| A.石灰水与盐酸的反应 OH﹣+H+===H2O |
| B.氧化铜与盐酸反应 O2﹣+2H+===H2O |
| C.铜片插入硝酸银溶液中 Cu+Ag+===Cu2++Ag |
| D.碳酸钙溶于醋酸中 CaCO3+2H+===Ca2++H2O+CO2↑ |
您最近一年使用:0次
2018-12-19更新
|
820次组卷
|
8卷引用:贵州省黔西县一中2018-2019学年高一第一学期12月考试化学试题
8 . 下列物质的变化不能产生自由移动离子的是( )
| A.氢氧化钠溶于水 | B.将硫酸溶于水 |
| C.氯化钠固体受热熔化 | D.冰醋酸固体受热熔化 |
您最近一年使用:0次
2018-12-19更新
|
818次组卷
|
5卷引用:贵州省黔西县一中2018-2019学年高一第一学期12月考试化学试题
贵州省黔西县一中2018-2019学年高一第一学期12月考试化学试题云南省广南县二中2019-2020学年高一上学期期末考试化学试题云南省普洱市景东县第二中学2019—2020学年高一上学期期末考试化学试题(已下线)【新东方】【2019】【高一上】【期中考】【JEZ】【化学】【栾子豪制作】广东省潮州市潮安区宝山中学2021-2022学年高一上学期第一学段教学质量检测化学试题
9 . 下列电离方程式正确的是
A.NaHSO4=Na++H++SO |
B.NaHCO3=Na++H++CO |
| C.Ca(OH)2=Ca2++OH2- |
D.K2SO4=K++SO |
您最近一年使用:0次
2018-12-19更新
|
548次组卷
|
2卷引用:贵州省黔西县一中2018-2019学年高一第一学期12月考试化学试题
10 . A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中B与C同周期,D与E和F周周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素F在周期表中的位置_______________________ ;
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)____________ ;
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有_________ ;检验该化合物中的阳离子的方法是____________________ (用离子方程式表示及文字描述表示)。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:_______________________ ;若E是非金属元素,其单质在电子工业中有重要应用,请写出其单质溶于强碱溶液的离子方程式:_______________________ 。
(1)元素F在周期表中的位置
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:
您最近一年使用:0次



