贵州省榕江县第三高级中学2019-2020学年高一上学期期末考试化学试题
贵州
高一
期末
2020-02-20
253次
整体难度:
容易
考查范围:
常见无机物及其应用、认识化学科学、化学与STSE、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
| A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | B.稀硫酸和稀硝酸都具有氧化性 |
| C.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性 | D.硫酸和硝酸都是重要的化工原料 |
| A.27 g H2O | B.34 g H2O2 |
| C.51 g OH- | D.38 g H3O+ |
【知识点】 物质的量有关计算
| A.千克 | B.伏特 | C.安培 | D.摩尔 |
【知识点】 物质的量及单位——摩尔 摩尔解读
| A.物质的量是一个基本物理量,表示物质所含粒子的多少 |
| B.1 mol氢中含有2 mol氢原子和2 mol电子 |
| C.1 mol水的质量等于NA个水分子质量的总和 |
| D.摩尔表示物质的量的数量单位 |
【知识点】 物质的量及单位——摩尔 阿伏加德罗常数 阿伏加德罗常数的含义解读
| A.质量是国际单位制(SI)的七个基本单位之一 |
| B.电流是国际单位制中安培(A)衡量的物理量 |
| C.物质的量是含有一定数目粒子集合体的物理量 |
| D.物质的量常用符号n表示,其单位是摩尔(mol) |
【知识点】 物质的量及单位——摩尔 物质的量的含义解读 摩尔解读
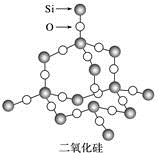
下列关于二氧化硅晶体网状结构的叙述正确的是
| A.存在四面体结构单元,O处于中心,Si处于4个顶角 |
| B.在最小的环上,有3个Si原子和3个O原子 |
| C.在最小的环上,Si和O的原子个数之比为1∶2 |
| D.在最小的环上,有6个Si原子和6个O原子 |
【知识点】 二氧化硅的组成、结构解读
| A.单质硫既有氧化性,又有还原性 | B.硫在空气中的燃烧产物是二氧化硫 |
| C.铜与硫反应生成黑色的硫化铜 | D.硫与氢气反应的氧化剂是硫 |
【知识点】 氧化还原反应在生活、生产中的应用解读 硫 硫单质的化学性质
| A.MgAl合金 | B.黄铜(CuZn合金) |
| C.NaK合金 | D.生铁(FeC合金) |
| A.硅胶是硅酸凝胶干燥脱水而形成 | B.硅胶呈多孔状,吸水性强 |
| C.硅胶常用作干燥剂或催化剂载体 | D.硅胶的主要化学成分是硅酸 |
【知识点】 硅酸
①2Mg+O2
 2MgO
2MgO ②3Mg+N2
 Mg3N2
Mg3N2③2Mg+CO2
 2MgO+C(黑色)。
2MgO+C(黑色)。关于上述三个反应的叙述不正确的是( )
| A.反应①②③的还原剂都是金属镁 |
| B.反应①和③中都是氧元素被还原 |
| C.反应②的生成物中氮元素为-3价 |
| D.反应③的氧化剂是二氧化碳 |
| A.用SO2漂白纸浆和草帽辫 | B.用硫酸清洗锅炉中的水垢 |
| C.高温下用焦炭还原SiO2制取粗硅 | D.用 Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
| A.(a-b)NA g·mol-1 | B.(b-a)NA g·mol-1 | C.(a-b)NA g | D.(b-a)NA g |
| A.新制的氯水呈浅黄绿色,久置的氯水无色 |
| B.新制的氯水漂白作用强,久置的氯水漂白作用很弱或消失 |
| C.新制的氯水中没有氯离子,久置的氯水中才含有氯离子 |
| D.新制的氯水中含氯气多,久置的氯水中含有极少量的氯气或不含氯气 |
【知识点】 氯水的成分及检验解读 新制氯水与久置氯水的区别解读
③Co2O3+6HCl = 2CoCl2+ Cl2↑+3H2O,下列说法正确的是
| A.①②③中氧化产物分别是FeCl2、Fe3+、Cl2 |
| B.根据以上方程式可以得到氧化性Cl2>Co2O3>Fe3+ |
| C.在反应③中生成1molCl2时,有2molHCl被氧化 |
| D.根据反应①②一定可以推理得到Cl2+FeBr2= FeCl2+Br2 |
| A.将钠投入到足量水中 |
| B.将钠用铝箔包好并刺一些小孔,再放入足量的水中 |
| C.将钠放入足量稀硫酸中 |
| D.将钠放入足量稀盐酸中 |
| A.6.72 L CO | B.6.6 g CO2 | C.8 g SO3 | D.9.8 g H2SO4 |
| A.分散质粒子都能透过滤纸 |
| B.都具有丁达尔效应 |
| C.分散质粒子的直径大小相同 |
| D.它们的稳定性相同 |
| A.化学反应中1 mol金属镁变成镁离子时失去电子的数目为2NA |
| B.28 g氮气所含有的原子数目为NA |
| C.标准状况下,22.4 L水中含有NA个水分子 |
| D.标准状况下,22.4 L氯化氢所含的原子数为NA |
| A.40.0 g | B.19.2 g | C.20.0 g | D.2.0 g |
【知识点】 一定物质的量浓度的溶液的配制
| A.硫酸工业的尾气必须回收、净化处理,主要为了充分利用原料 |
| B.“酸雨”中主要含有硫的氧化物以及所形成的硫酸及硫酸盐 |
| C.大气中,大量的SO2来源于煤和石油燃烧、金属矿石的冶炼 |
| D.消除大气污染的主要方法之一是减少污染物的排放 |
| A.氯气的化学性质很活泼,所以纯净的液氯不能用钢瓶贮存 |
| B.氯气和液氯是两种不同的物质 |
| C.不可以用浓硫酸除去氯气中的水蒸气 |
| D.氯气有毒,它曾在战争中被用于制造毒气弹 |
①用剩的药品为避免浪费应放回原瓶
②蒸发氯化钠溶液时要用玻璃棒不断搅拌
③称取易潮解的药品必须放在玻璃器皿中称量
④用试纸检验气体性质时,手拿着试纸经水润湿后靠近气体观察试纸颜色变化
| A.②③ | B.②③④ | C.②④ | D.①②③④ |
| A.常温下所有的金属都是固态 |
| B.金属具有导电、导热和延展性 |
| C.金属都具有较高的硬度和密度 |
| D.金属都具有较高的熔点和沸点 |
| A.不能发生丁达尔效应的分散系有氯化钠溶液、水等 |
| B.将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA |
| C.黄河入海口处三角洲的形成与胶体性质有关 |
| D.电泳现象说明胶体带电 |
① 16H++10Z-+2XO
 =2X2++5Z2+8H2O
=2X2++5Z2+8H2O② 2A2++B2=2A3++2B-
③ 2B-+Z2=B2+2Z-
由此推断下列说法错误的是
| A.反应Z2+2A2+=2A3++2Z−可以进行 |
| B.Z元素在反应③中被还原,在反应①中被氧化 |
C.氧化性由强到弱的顺序是XO 、Z2、B2、A3+ 、Z2、B2、A3+ |
| D.Z2可以置换出X2+溶液中的X |
| A.青铜是我国使用最早的合金,也是目前使用最广泛的合金 |
| B.不管哪种铜合金都含有铜元素,所以它们的性质也和金属铜一样 |
| C.我们日常生活中用到的铜合金制品主要是黄铜制的 |
| D.各种铜合金都有良好的导电、导热性 |
【知识点】 金属材料的性质及利用
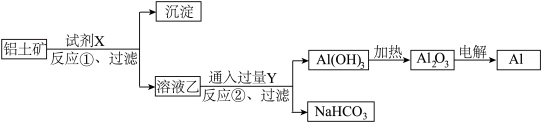
下列叙述不正确的是( )
| A.试剂X可以是氢氧化钠溶液 |
| B.反应①过滤后所得沉淀为氧化铁 |
| C.图中所示转化反应包含氧化还原反应 |
| D.反应②的化学方程式为2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3 |
二、解答题 添加题型下试题
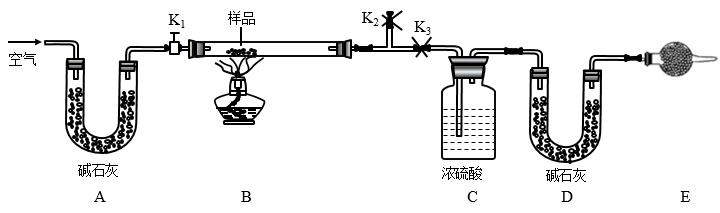
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对NaCl质量测定结果的影响是
②E处干燥管中盛放的药品是碱石灰,其作用是
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为

(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为
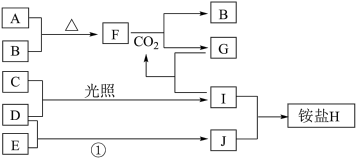
请回答下列问题:
(1)E和J的化学式分别是
(2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况:
(3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为
(4)标况下3.36 L气体B与A完全反应,转移电子的数目为
【知识点】 无机综合推断 根据物质性质进行元素种类推断解读
(1)X的化学名称为
(2)B单质的结构式为
(3)B、C、E分别与A形成的化合物中最稳定的是
(4)D是同周期简单阳离子中离子半径最
(5)F的单质在反应中常作
三、填空题 添加题型下试题
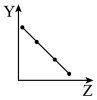
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a.
 b.
b. 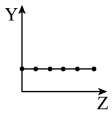 c.
c.  d.
d. 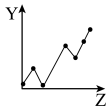
①第ⅡA族元素的价电子数
②第三周期元素的最高化合价
③F-、Na+、Mg2+、Al3+的离子半径
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为
②N的最高价氧化物的水化物的化学式为
③M的最高价氧化物的化学式为
试卷分析
导出试卷题型(共 35题)
试卷难度
知识点分析
细目表分析
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 硝酸的强氧化性 浓硫酸的脱水性 浓硫酸的强氧化性 铝的钝化 | |
| 2 | 0.85 | 物质的量有关计算 | |
| 3 | 0.94 | 氯水的成分及检验 | |
| 4 | 0.94 | 物质的量及单位——摩尔 摩尔 | |
| 5 | 0.85 | 物质的量及单位——摩尔 阿伏加德罗常数 阿伏加德罗常数的含义 | |
| 6 | 0.85 | 物质的量及单位——摩尔 物质的量的含义 摩尔 | |
| 7 | 0.65 | 二氧化硫的化学性质 酸性氧化物的通性 二氧化硫的漂白性 | |
| 8 | 0.85 | 二氧化硅的组成、结构 | |
| 9 | 0.94 | 几种常见硅酸盐矿物 硅酸盐工业 | |
| 10 | 0.85 | 氧化还原反应在生活、生产中的应用 硫 硫单质的化学性质 | |
| 11 | 0.85 | 铝合金及其制品 金属与合金性能比较 | |
| 12 | 0.85 | 硅酸 | |
| 13 | 0.85 | 氧化还原反应的概念判断 氧化还原反应在生活、生产中的应用 | |
| 14 | 0.65 | 二氧化硫的漂白性 硅的制备 处理污水的几种方法 | |
| 15 | 0.85 | 阿伏加德罗常数 阿伏加德罗定律的应用 结合气体物质与NA相关推算 以N=m·NA/M为中心的有关基本粒子的推算 | |
| 16 | 0.65 | 氯水的成分及检验 新制氯水与久置氯水的区别 | |
| 17 | 0.65 | 氧化还原反应的几组概念 常见氧化剂与还原剂 氧化性、还原性强弱的比较 氧化还原反应的规律 | |
| 18 | 0.65 | 钠与水反应原理 铝与强碱溶液反应 | |
| 19 | 0.85 | 阿伏加德罗常数的应用 根据n=N/NA进行相关计算 以N=m·NA/M为中心的有关基本粒子的推算 | |
| 20 | 0.85 | 分散系概念及其分类 胶体的定义及分类 胶体的性质和应用 | |
| 21 | 0.85 | 阿伏加德罗常数的求算 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 | |
| 22 | 0.65 | 一定物质的量浓度的溶液的配制 | |
| 23 | 0.94 | 硫、氮氧化物对人体、环境的危害 酸雨 大气污染 大气污染来源及危害 大气污染的治理原理及方法 | |
| 24 | 0.65 | 氯气的物理性质 氯气的化学性质 | |
| 25 | 0.65 | 仪器使用与实验安全 化学实验基础操作 | |
| 26 | 0.94 | 金属通性 金属物理通性 | |
| 27 | 0.85 | 胶体的定义及分类 胶体的性质和应用 胶体的制备 | |
| 28 | 0.65 | 氧化性、还原性强弱的比较 氧化还原反应在生活、生产中的应用 | |
| 29 | 0.85 | 金属材料的性质及利用 | |
| 30 | 0.85 | 氧化铝与碱溶液反应 含氧化铝的混合物的提纯 铝土矿提取铝的综合考查 物质分离、提纯综合应用 | |
| 二、解答题 | |||
| 31 | 0.4 | 碳酸氢钠的不稳定性 碳酸钠、碳酸氢钠混合物的有关求算 探究物质组成或测量物质的含量 | 实验探究题 |
| 32 | 0.65 | 金属与非金属在周期表中位置及其性质递变的规律 物质性质的探究 | 实验探究题 |
| 33 | 0.65 | 无机综合推断 根据物质性质进行元素种类推断 | 无机推断题 |
| 34 | 0.65 | 元素周期律、元素周期表的推断 化学键与物质类别关系的判断 | 无机推断题 |
| 三、填空题 | |||
| 35 | 0.85 | 元素周期律的应用 同周期元素性质递变规律探究实验 根据原子结构进行元素种类推断 | |