1 . 某无色透明溶液中可能大量存在 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种,为确定溶液中的离子组成,进行了如下实验:
中的几种,为确定溶液中的离子组成,进行了如下实验:
①用玻璃棒蘸取溶液滴在pH试纸上,待试纸变色后与标准比色卡比对,溶液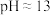 ;
;
②取少量溶液于试管中,向其中加入足量的 溶液,生成白色沉淀,过滤,向白色固体中滴加足量盐酸,沉淀部分溶解并有气泡冒出;
溶液,生成白色沉淀,过滤,向白色固体中滴加足量盐酸,沉淀部分溶解并有气泡冒出;
③将实验②所得悬浊液过滤,向滤液中滴加 溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
已知常温下 饱和溶液的
饱和溶液的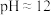 ;
; 微溶于水,易溶于
微溶于水,易溶于 溶液。
溶液。
回答下列问题:
(1)不进行实验,通过观察就可以确定原溶液中不存在的离子是___________ (填离子符号,下同)。
(2)由实验①进一步可推知原溶液中一定不存在的离子是___________ 。
(3)实验②中白色沉淀的成分是___________ (填化学式);白色沉淀部分溶解,发生反应的离子方程式为___________ ;由实验②可确定原溶液中一定不存在的离子符号是___________ 。
(4)根据上述实验现象可知,原溶液中,一定存在的离子是___________ ,不能确定是否存在的离子是___________ ;确定该离子是否存在的实验为:取少量样本溶液于试管中,先加入稀硝酸酸化后,再加入 溶液至沉淀完全,过滤,
溶液至沉淀完全,过滤,___________ ,有白色沉淀生成,再次加入稀硝酸,观察沉淀是否溶解。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种,为确定溶液中的离子组成,进行了如下实验:
中的几种,为确定溶液中的离子组成,进行了如下实验:①用玻璃棒蘸取溶液滴在pH试纸上,待试纸变色后与标准比色卡比对,溶液
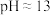 ;
;②取少量溶液于试管中,向其中加入足量的
 溶液,生成白色沉淀,过滤,向白色固体中滴加足量盐酸,沉淀部分溶解并有气泡冒出;
溶液,生成白色沉淀,过滤,向白色固体中滴加足量盐酸,沉淀部分溶解并有气泡冒出;③将实验②所得悬浊液过滤,向滤液中滴加
 溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。已知常温下
 饱和溶液的
饱和溶液的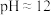 ;
; 微溶于水,易溶于
微溶于水,易溶于 溶液。
溶液。回答下列问题:
(1)不进行实验,通过观察就可以确定原溶液中不存在的离子是
(2)由实验①进一步可推知原溶液中一定不存在的离子是
(3)实验②中白色沉淀的成分是
(4)根据上述实验现象可知,原溶液中,一定存在的离子是
 溶液至沉淀完全,过滤,
溶液至沉淀完全,过滤,
您最近一年使用:0次
2023-11-16更新
|
202次组卷
|
3卷引用:甘肃省永昌县第一高级中学2023-2024学年高一上学期期中考试化学试题
名校
2 . 几种中学化学常见的单质及其化合物相互转化的关系如图:
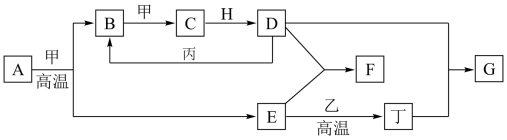
已知:
①甲、乙、丙、丁为单质,乙中元素在地壳中的含量占第三位,丙为红色固体,其余为化合物。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③H常温下为无色、无味的液体,E常用作油漆、涂料的红色颜料。
回答下列问题:
(1)高温下,A和甲反应生成B和E的化学方程式为___________ ,每生成1 mol B,转移___________ mol电子。
(2)F的水溶液与丁单质反应也可以生成G,反应的离子方程式为___________ 。
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①②③。
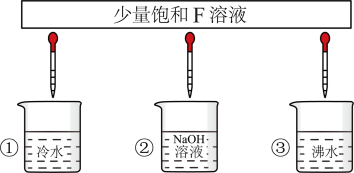
分散系②是___________ (填“胶体”“悬浊液”“乳浊液”或“溶液”),能鉴别分散系①③的实验现象称为___________ 。
(4)一定条件下,丙和D反应生成B的化学方程式为___________ 。

已知:
①甲、乙、丙、丁为单质,乙中元素在地壳中的含量占第三位,丙为红色固体,其余为化合物。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③H常温下为无色、无味的液体,E常用作油漆、涂料的红色颜料。
回答下列问题:
(1)高温下,A和甲反应生成B和E的化学方程式为
(2)F的水溶液与丁单质反应也可以生成G,反应的离子方程式为
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①②③。

分散系②是
(4)一定条件下,丙和D反应生成B的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 某校实验室需配制480 mL  NaOH溶液。现有下列仪器:
NaOH溶液。现有下列仪器:
A.烧杯 B.玻璃棒 C.漏斗 D.500 mL容量瓶 E.1 000 mL容量瓶 F.托盘天平(带砝码)
请回答下列问题:
(1)应用托盘天平称取NaOH固体的质量为_______ 。
(2)配制时,使用的仪器有_______ (填字母),还缺少的仪器是_______ 。
(3)配制中多次使用到玻璃棒,其作用是_______ 。
(4)若所配溶液的浓度偏大,你认为原因可能是_______ (填字母)。
A.溶解后未冷却至室温便进行定容
B.未将烧杯和玻璃棒洗涤液转移进容量瓶
C.摇匀后发现液面低于刻度线,滴加蒸馏水至刻度线再摇匀
D.定容时俯视容量瓶的刻度线
E.容量瓶内壁附有水珠而未进行干燥
F.称取NaOH时间过长
(5)若取上述已配好的溶液V mL,向其加水至体积为5V mL,取出 mL,则取出溶液物质的量浓度为
mL,则取出溶液物质的量浓度为_______ 。
 NaOH溶液。现有下列仪器:
NaOH溶液。现有下列仪器:A.烧杯 B.玻璃棒 C.漏斗 D.500 mL容量瓶 E.1 000 mL容量瓶 F.托盘天平(带砝码)
请回答下列问题:
(1)应用托盘天平称取NaOH固体的质量为
(2)配制时,使用的仪器有
(3)配制中多次使用到玻璃棒,其作用是
(4)若所配溶液的浓度偏大,你认为原因可能是
A.溶解后未冷却至室温便进行定容
B.未将烧杯和玻璃棒洗涤液转移进容量瓶
C.摇匀后发现液面低于刻度线,滴加蒸馏水至刻度线再摇匀
D.定容时俯视容量瓶的刻度线
E.容量瓶内壁附有水珠而未进行干燥
F.称取NaOH时间过长
(5)若取上述已配好的溶液V mL,向其加水至体积为5V mL,取出
 mL,则取出溶液物质的量浓度为
mL,则取出溶液物质的量浓度为
您最近一年使用:0次
4 . 某校化学实验小组拟在实验室制备干燥、纯净的 并验证
并验证 的性质,选择了如图所示的实验装置(铁架台及夹持装置均已省略)。请按要求回答下列问题:
的性质,选择了如图所示的实验装置(铁架台及夹持装置均已省略)。请按要求回答下列问题:
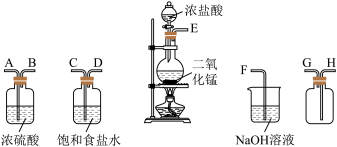
(1)上述仪器的正确连接顺序(填各接口处的字母):_______ 。
E→_______→_______→_______→_______→_______→_______→_______。
(2)装置中,饱和食盐水的作用是_____ ;NaOH溶液的作用是_______ (用化学方程式回答)。
(3)检验 是否充满了集气瓶的正确操作为_______(填字母,下同)。
是否充满了集气瓶的正确操作为_______(填字母,下同)。
(4)该小组所做有关 实验的叙述正确的是_______。
实验的叙述正确的是_______。
(5)若用 和浓盐酸制取氯气时,有14.6 g氯化氢被氧化,所得
和浓盐酸制取氯气时,有14.6 g氯化氢被氧化,所得 全部用石灰水吸收,则该小组可制得漂白粉的质量是_______。
全部用石灰水吸收,则该小组可制得漂白粉的质量是_______。
 并验证
并验证 的性质,选择了如图所示的实验装置(铁架台及夹持装置均已省略)。请按要求回答下列问题:
的性质,选择了如图所示的实验装置(铁架台及夹持装置均已省略)。请按要求回答下列问题:
(1)上述仪器的正确连接顺序(填各接口处的字母):
E→_______→_______→_______→_______→_______→_______→_______。
(2)装置中,饱和食盐水的作用是
(3)检验
 是否充满了集气瓶的正确操作为_______(填字母,下同)。
是否充满了集气瓶的正确操作为_______(填字母,下同)。| A.用手轻扇集气瓶口,仔细闻是否有刺激性气味 |
B.将 溶液滴入集气瓶中,观察有无白色沉淀生成 溶液滴入集气瓶中,观察有无白色沉淀生成 |
| C.用玻璃棒蘸取少许NaOH溶液放入集气瓶口附近,看是否反应 |
| D.用玻璃棒粘上湿润的淀粉-KI试纸伸到集气瓶口附近,观察试纸是否变蓝 |
 实验的叙述正确的是_______。
实验的叙述正确的是_______。| A.钠在氯气中燃烧产生白色烟雾 |
B.向湿润的有色布条通入氯气,布条褪色,说明 具有漂白性 具有漂白性 |
C.将 通入硝酸银溶液会产生淡黄色沉淀 通入硝酸银溶液会产生淡黄色沉淀 |
D.光照新制氯水有气泡逸出,该气体可能是 |
 和浓盐酸制取氯气时,有14.6 g氯化氢被氧化,所得
和浓盐酸制取氯气时,有14.6 g氯化氢被氧化,所得 全部用石灰水吸收,则该小组可制得漂白粉的质量是_______。
全部用石灰水吸收,则该小组可制得漂白粉的质量是_______。| A.14.3 g | B.25.4 g | C.28.6 g | D.50.8 g |
您最近一年使用:0次
名校
5 . 填空。
(1)下列物质中:A.NaCl晶体;B. 气体;C.
气体;C. 溶液;D.
溶液;D. (酒精)溶液;E.单质铜;F.熔融氯化钾;G.液态氯化氢。
(酒精)溶液;E.单质铜;F.熔融氯化钾;G.液态氯化氢。
①能够直接导电的是_______ (填字母,下同);
②虽溶于水能导电,但不属于电解质的是_______ ;
③虽不能直接导电,但属于电解质的是_______ 。
(2)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下: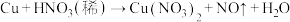 (未配平)
(未配平)
①被还原的元素是_______ (填元素符号),氧化产物是_______ (填化学式)。
②请配平上述反应并用双线桥法标出电子转移的方向和数目:_______ 。
③ 在上述反应中显示出来的性质有
在上述反应中显示出来的性质有_______ (填字母)。
A.氧化性 B.还原性 C.酸性 D.碱性
(1)下列物质中:A.NaCl晶体;B.
 气体;C.
气体;C. 溶液;D.
溶液;D. (酒精)溶液;E.单质铜;F.熔融氯化钾;G.液态氯化氢。
(酒精)溶液;E.单质铜;F.熔融氯化钾;G.液态氯化氢。①能够直接导电的是
②虽溶于水能导电,但不属于电解质的是
③虽不能直接导电,但属于电解质的是
(2)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
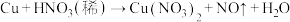 (未配平)
(未配平)①被还原的元素是
②请配平上述反应并用双线桥法标出电子转移的方向和数目:
③
 在上述反应中显示出来的性质有
在上述反应中显示出来的性质有A.氧化性 B.还原性 C.酸性 D.碱性
您最近一年使用:0次
名校
解题方法
6 . 下图是某硫酸试剂瓶标签上的部分内容。请回答下列问题:
(1)现用该浓硫酸来配制460mL 的稀硫酸,需量取该浓硫酸的体积为
的稀硫酸,需量取该浓硫酸的体积为___________ mL(小数点后保留一位小数)
(2)配制时,下列仪器中必须使用___________ (填序号),还缺少的仪器是___________ 、___________ 。
①10mL量筒②托盘天平(带砝码)③20mL量筒④玻璃棒⑤烧杯⑥100mL容量瓶⑦漏斗⑧分液漏斗
(3)①把量取好的浓硫酸缓慢倒入盛有蒸馏水的烧杯中,并不断搅拌;
②将①所得溶液冷却到室温后,小心转入容量瓶中;
③继续加蒸馏水至液面距刻度线1~2cm处,小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;
④用少量蒸馏水洗涤玻璃棒和烧杯2—3次,每次洗涤液小心转入容量瓶,并轻轻摇匀:
⑤将容量瓶塞紧,充分摇匀。
操作步骤正确的顺序是___________ (填序号)。
(4)洗涤烧杯2~3次是为了___________ 。
(5)使用容量瓶配制溶液时,由于操作不当,会引起误差。下列情况一定会使所配溶液浓度偏低的是___________(填标号)。
| 硫酸化学纯(CP)500mL 品名:硫酸 化学式:  相对分子质量:98 密度:  质量分数:98% |
 的稀硫酸,需量取该浓硫酸的体积为
的稀硫酸,需量取该浓硫酸的体积为(2)配制时,下列仪器中必须使用
①10mL量筒②托盘天平(带砝码)③20mL量筒④玻璃棒⑤烧杯⑥100mL容量瓶⑦漏斗⑧分液漏斗
(3)①把量取好的浓硫酸缓慢倒入盛有蒸馏水的烧杯中,并不断搅拌;
②将①所得溶液冷却到室温后,小心转入容量瓶中;
③继续加蒸馏水至液面距刻度线1~2cm处,小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;
④用少量蒸馏水洗涤玻璃棒和烧杯2—3次,每次洗涤液小心转入容量瓶,并轻轻摇匀:
⑤将容量瓶塞紧,充分摇匀。
操作步骤正确的顺序是
(4)洗涤烧杯2~3次是为了
(5)使用容量瓶配制溶液时,由于操作不当,会引起误差。下列情况一定会使所配溶液浓度偏低的是___________(填标号)。
| A.溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 |
| B.转移溶液前容量瓶内有少量蒸馏水 |
| C.定容时,仰视容量瓶的刻度线 |
| D.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线 |
您最近一年使用:0次
2022-11-05更新
|
92次组卷
|
3卷引用:甘肃省金昌市永昌县第一高级中学2022-2023学年高一上学期期末考试化学试题
名校
7 . 二氧化氯(ClO2)是一种新型高效安全消毒剂,易溶于水,沸点为 ,遇热不稳定,易分解并发生爆炸。工业上利用硫铁矿[主要成分为二硫化亚铁(FeS2)]还原氯酸钠(NaClO3)制取二氧化氯。某研究小组利用如图装置模拟工业制备
,遇热不稳定,易分解并发生爆炸。工业上利用硫铁矿[主要成分为二硫化亚铁(FeS2)]还原氯酸钠(NaClO3)制取二氧化氯。某研究小组利用如图装置模拟工业制备 :向三颈烧瓶中加入
:向三颈烧瓶中加入 溶液、浓
溶液、浓 并通入空气,调节恒温器至
并通入空气,调节恒温器至 ,通过固体加料器缓慢匀速加入硫铁矿粉末。
,通过固体加料器缓慢匀速加入硫铁矿粉末。
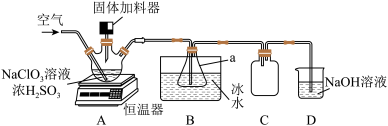
回答下列问题:
(1)仪器a的名称是_______ 。
(2)A装置中生成 的离子方程式为
的离子方程式为_______ ( 对应的产物为
对应的产物为 和
和 ),此离子反应中氧化产物与还原产物的物质的量之比为
),此离子反应中氧化产物与还原产物的物质的量之比为_______ 。
(3)装置C的作用是_______ 。
(4)装置D中 与NaOH溶液反应生成二种盐,其中一种为
与NaOH溶液反应生成二种盐,其中一种为 且二者物质的量之比为
且二者物质的量之比为 ,则另一种盐的化学式为
,则另一种盐的化学式为_______ 。
(5)一种主要成分为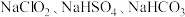 的“
的“ 泡腾片”,能快速溶于水,并产生大量气泡,得到含有
泡腾片”,能快速溶于水,并产生大量气泡,得到含有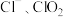 的溶液。上述过程中,每生成
的溶液。上述过程中,每生成 消耗
消耗 的物质的量为
的物质的量为_______ mol。
(6)工业上可用 与水中的
与水中的 在常温下反应,生成
在常温下反应,生成 和盐酸,以除去水中
和盐酸,以除去水中 。写出该反应的离子方程式:
。写出该反应的离子方程式:_______ 。
 ,遇热不稳定,易分解并发生爆炸。工业上利用硫铁矿[主要成分为二硫化亚铁(FeS2)]还原氯酸钠(NaClO3)制取二氧化氯。某研究小组利用如图装置模拟工业制备
,遇热不稳定,易分解并发生爆炸。工业上利用硫铁矿[主要成分为二硫化亚铁(FeS2)]还原氯酸钠(NaClO3)制取二氧化氯。某研究小组利用如图装置模拟工业制备 :向三颈烧瓶中加入
:向三颈烧瓶中加入 溶液、浓
溶液、浓 并通入空气,调节恒温器至
并通入空气,调节恒温器至 ,通过固体加料器缓慢匀速加入硫铁矿粉末。
,通过固体加料器缓慢匀速加入硫铁矿粉末。
回答下列问题:
(1)仪器a的名称是
(2)A装置中生成
 的离子方程式为
的离子方程式为 对应的产物为
对应的产物为 和
和 ),此离子反应中氧化产物与还原产物的物质的量之比为
),此离子反应中氧化产物与还原产物的物质的量之比为(3)装置C的作用是
(4)装置D中
 与NaOH溶液反应生成二种盐,其中一种为
与NaOH溶液反应生成二种盐,其中一种为 且二者物质的量之比为
且二者物质的量之比为 ,则另一种盐的化学式为
,则另一种盐的化学式为(5)一种主要成分为
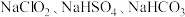 的“
的“ 泡腾片”,能快速溶于水,并产生大量气泡,得到含有
泡腾片”,能快速溶于水,并产生大量气泡,得到含有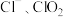 的溶液。上述过程中,每生成
的溶液。上述过程中,每生成 消耗
消耗 的物质的量为
的物质的量为(6)工业上可用
 与水中的
与水中的 在常温下反应,生成
在常温下反应,生成 和盐酸,以除去水中
和盐酸,以除去水中 。写出该反应的离子方程式:
。写出该反应的离子方程式:
您最近一年使用:0次
2022-10-08更新
|
213次组卷
|
3卷引用:甘肃省永昌县第一高级中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
8 . 按要求填空(每空2分,共20分)
(1)2Fe+3Cl2 2FeCl3,氧化剂是
2FeCl3,氧化剂是_______ ,发生氧化反应的是_______ 。
(2)将小块钠投入到硫酸铜的稀溶液中,观察到的现象是:①钠浮于液面上 ②熔化成小球 ③发出“嘶嘶”的响声,放出气体 ④有蓝色沉淀产生,用化学方程式解释实验现象:_______ 。
(3)某化学兴趣小组用如图装置制备家用消毒液。

①装置A中的溶液是_______ ,长玻璃导管的作用是_______ ,图中装置的连接顺序是B→_______ 。
②居家消毒时,不能将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,原因是_______ 。
(4)如图所示实验为“套管实验”,小试管内塞有沾有白色无水硫酸铜粉末的棉花球。

①点燃酒精灯加热,能观察到的实验现象是小试管中棉花_______ ,B烧杯中_______ 。
②实验结论:Na2CO3的热稳定性比NaHCO3_______ 。(填“强”或“弱”)
(1)2Fe+3Cl2
 2FeCl3,氧化剂是
2FeCl3,氧化剂是(2)将小块钠投入到硫酸铜的稀溶液中,观察到的现象是:①钠浮于液面上 ②熔化成小球 ③发出“嘶嘶”的响声,放出气体 ④有蓝色沉淀产生,用化学方程式解释实验现象:
(3)某化学兴趣小组用如图装置制备家用消毒液。

①装置A中的溶液是
②居家消毒时,不能将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,原因是
(4)如图所示实验为“套管实验”,小试管内塞有沾有白色无水硫酸铜粉末的棉花球。

①点燃酒精灯加热,能观察到的实验现象是小试管中棉花
②实验结论:Na2CO3的热稳定性比NaHCO3
您最近一年使用:0次
名校
解题方法
9 . 现需要配制0.200mol/L的NaOH溶液0.5L。
(1)需称量NaOH固体_______ 克。
(2)实验操作中除要用到玻璃棒、托盘天平外,必需用到的实验仪器还有_______ (选填编号):
①量筒 ②烧杯 ③250mL容量瓶 ④500mL容量瓶 ⑤胶头滴管
(3)有以下5个操作步骤:
①向盛有NaOH固体的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温;
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2cm;
③将NaOH溶液沿玻璃棒注入500mL容量瓶中;
④用少量的蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液移入容量瓶;
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
以上操作步骤正确的排序是_______ 。
(4)因为NaOH在空气中容易潮解,其余均按照正确的方法配制溶液,则配得的NaOH溶液的浓度将_______ (选填“偏高”、“偏低”或“无影响”)。
(1)需称量NaOH固体
(2)实验操作中除要用到玻璃棒、托盘天平外,必需用到的实验仪器还有
①量筒 ②烧杯 ③250mL容量瓶 ④500mL容量瓶 ⑤胶头滴管
(3)有以下5个操作步骤:
①向盛有NaOH固体的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温;
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2cm;
③将NaOH溶液沿玻璃棒注入500mL容量瓶中;
④用少量的蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液移入容量瓶;
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
以上操作步骤正确的排序是
(4)因为NaOH在空气中容易潮解,其余均按照正确的方法配制溶液,则配得的NaOH溶液的浓度将
您最近一年使用:0次
名校
解题方法
10 . 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是_______ (填序号),本实验所需玻璃仪器E规格为_______ mL。
(2)下列操作中,容量瓶所不具备的功能有_______(填序号)。
(3)在配制NaOH溶液实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液浓度_______ 0.1mol/L(填“大于”“等于”或“小于”,下同);若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度_______ 0.1mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______ mL(计算结果保留一位小数)。如果实验室有10mL、25mL、50mL量筒,应选用_______ mL规格的量筒最好。

(1)如图所示的仪器中配制溶液肯定不需要的是
(2)下列操作中,容量瓶所不具备的功能有_______(填序号)。
| A.配制一定体积准确浓度的标准溶液 |
| B.长期贮存溶液 |
| C.用来加热溶解固体溶质 |
| D.量取一定体积的液体 |
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
您最近一年使用:0次



