名校
解题方法
1 . 为测定某漂白粉中有效氯的含量[漂白粉中所含+1价氯(Cl-35.5)元素的质量分数: ]
]
设计如下实验:
步骤I:准确称取3.000g漂白粉,配制成500mL溶液;
步骤Ⅱ:取所配溶液25.00mL于锥形瓶中,加入过量酸性NaI溶液,充分反应;
步骤Ⅲ:向所得溶液中加入指示剂,并用0.1000mol/LNa2S2O3标准液滴定至终点,最终消耗标准液体积为30.00mL。(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
回答下列问题:
(1)D已知步骤Ⅱ中NaI被氧化为I2,则发生反应的离子方程式为___________
(2)Na2S2O3标准液应盛放在___________ (填“酸式”或“碱式"")滴定管中。
(3)步骤Ⅲ中所选用的指示剂为___________ ,滴定终点的标志为___________
(4)该实验测得漂白粉中有效氯的含量为___________
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___________ (填“偏高“偏低""或“无影响”,下同),滴定之前使用待测液润洗锥形瓶,则测定结果___________ 。
 ]
]设计如下实验:
步骤I:准确称取3.000g漂白粉,配制成500mL溶液;
步骤Ⅱ:取所配溶液25.00mL于锥形瓶中,加入过量酸性NaI溶液,充分反应;
步骤Ⅲ:向所得溶液中加入指示剂,并用0.1000mol/LNa2S2O3标准液滴定至终点,最终消耗标准液体积为30.00mL。(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
回答下列问题:
(1)D已知步骤Ⅱ中NaI被氧化为I2,则发生反应的离子方程式为
(2)Na2S2O3标准液应盛放在
(3)步骤Ⅲ中所选用的指示剂为
(4)该实验测得漂白粉中有效氯的含量为
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果
您最近一年使用:0次
2 . 为测定某漂白粉中有效氯的含量[漂白粉中所含+1价氯元素的质量分数: ]
]
设计如下实验:
步骤I.准确称取3.000g漂白粉,配制成500mL溶液;
步骤Ⅱ.取所配溶液25.00mL于锥形瓶中,加入过量酸性NaI溶液,充分反应;
步骤Ⅲ.向所得溶液中加入指示剂,并用0.1000mol/LNa2S2O3标准液滴定至终点,最终消耗标准液体积为30.00mL。(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
回答下列问题:
(1)已知步骤Ⅱ中NaI被氧化为I2,则发生反应的离子方程式为_______ 。
(2)Na2S2O3标准液应盛放在_______ (填“酸式”或“碱式"")滴定管中。
(3)步骤Ⅲ中所选用的指示剂为_______ ,滴定终点的标志为_______ 。
(4)该实验测得漂白粉中有效氯的含量为_______ 。
(5)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测定结果_______ (填“偏高“偏低""或“无影响”)。
 ]
]设计如下实验:
步骤I.准确称取3.000g漂白粉,配制成500mL溶液;
步骤Ⅱ.取所配溶液25.00mL于锥形瓶中,加入过量酸性NaI溶液,充分反应;
步骤Ⅲ.向所得溶液中加入指示剂,并用0.1000mol/LNa2S2O3标准液滴定至终点,最终消耗标准液体积为30.00mL。(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
回答下列问题:
(1)已知步骤Ⅱ中NaI被氧化为I2,则发生反应的离子方程式为
(2)Na2S2O3标准液应盛放在
(3)步骤Ⅲ中所选用的指示剂为
(4)该实验测得漂白粉中有效氯的含量为
(5)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测定结果
您最近一年使用:0次
2022-01-23更新
|
291次组卷
|
2卷引用:江西省赣州市2021-2022学高二上学期期末考试化学试题
名校
解题方法
3 . 设 为阿伏加德罗常数的值,下列叙述中正确的是
为阿伏加德罗常数的值,下列叙述中正确的是
 为阿伏加德罗常数的值,下列叙述中正确的是
为阿伏加德罗常数的值,下列叙述中正确的是A.24g石墨中含有的 键数目为 键数目为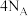 |
B.23g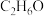 中一定含有 中一定含有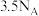 极性共价键 极性共价键 |
C.标准状况下,11.2L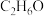 中含有分子的数目为 中含有分子的数目为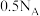 |
D.质量分数为46%的甲酸水溶液100g含氧原子的数目为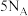 |
您最近一年使用:0次
4 . 氯酸钾和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯(ClO2),ClO2是一种优良消毒剂。
(1)请补充空白并配平化学方程式_______ 。
_____KClO3+_____HCl(浓)→______KCl+_____ClO2↑+_____Cl2↑+_______
(2)若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为_______ 。
(3)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式_______ 。取2.76gCaO2·8H2O样品受热脱水过程的热重曲线(140℃时完全脱水,杂质受热不分解)如图所示。

①试确定60℃时CaO2·xH2O中x=_______ 。
②该样品中CaO2的质量分数为_______ (精确到0.1%)。
(1)请补充空白并配平化学方程式
_____KClO3+_____HCl(浓)→______KCl+_____ClO2↑+_____Cl2↑+_______
(2)若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为
(3)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式

①试确定60℃时CaO2·xH2O中x=
②该样品中CaO2的质量分数为
您最近一年使用:0次
5 . 氯酸钾和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯(ClO2),ClO2是一种优良消毒剂。
(1)请补充空白并配平化学方程式。___________KClO3+___________HCl(浓) → ___________KCl+___________ClO2↑___________Cl2↑+ ___________ ,
,___________
(2)浓盐酸在反应中显示出来的性质是___________。
(3)若反应中生成标准状况下13.44 L气体,则消耗还原剂的物质的量为___________ 。
(4)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式___________ 。取2.76 g CaO2·8H2O样品受热脱水过程的热重曲线(140 ℃时完全脱水,杂质受热不分解)如图所示。
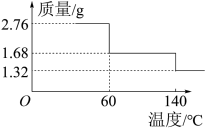
①试确定60 ℃时CaO2·xH2O中x=___________ 。
②该样品中CaO2的质量分数为___________ (精确到0.1%)。
(1)请补充空白并配平化学方程式。___________KClO3+___________HCl(浓) → ___________KCl+___________ClO2↑___________Cl2↑+ ___________
 ,
,(2)浓盐酸在反应中显示出来的性质是___________。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(4)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式

①试确定60 ℃时CaO2·xH2O中x=
②该样品中CaO2的质量分数为
您最近一年使用:0次
2021-10-25更新
|
163次组卷
|
2卷引用:江西省临川一中暨临川一中实验学校2021-2022学年高二下学期第二次月考化学试题
6 . “84”消毒液是一种以NaClO为主的高效消毒剂,在新冠肺炎防治中被广泛应用于宾馆、旅游、医院、家庭等的卫生消毒。某“84”消毒液瓶体部分标签如图1所示,该“84”消毒液通常稀释100倍(体积之比)后使用。下列叙述正确的是“”


| A.根据图1信息,不能求出此“84”消毒液中NaClO的物质的量浓度 |
| B.某同学参阅该“84”消毒液的配方,欲用NaClO固体配制480mL含NaClO质量分数为24%的消毒液。除选用图2所示的部分仪器外,还缺少的玻璃仪器有两种 |
| C.若配制上述溶液,定容时俯视刻度线会导致所配溶液的物质的量浓度偏低 |
| D.为增强“84”消毒液的消毒效果,可加入适量稀盐酸 |
您最近一年使用:0次
2021-09-08更新
|
270次组卷
|
3卷引用:江西省抚州市七校2021-2022学年高二下学期期末考试化学试题
7 . 碳酸镧[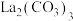 ,
,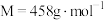 ]为白色难溶固体,分解温度为900℃。在溶液中制备时,形成水合碳酸镧
]为白色难溶固体,分解温度为900℃。在溶液中制备时,形成水合碳酸镧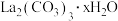 ,若溶液碱性太强,会生成受热易分解的碱式碳酸镧
,若溶液碱性太强,会生成受热易分解的碱式碳酸镧 。已知酒精喷灯火焰温度可达1000℃。
。已知酒精喷灯火焰温度可达1000℃。
实验I:用如图装置模拟制备水合碳酸镧 ,并测定
,并测定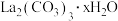 中结晶水的含量。将石英玻璃A管称重,记为
中结晶水的含量。将石英玻璃A管称重,记为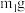 ;将样品装入石英玻璃管中,再次将装置A称重,记为
;将样品装入石英玻璃管中,再次将装置A称重,记为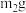 ;将装有试剂的装置C称重,记为
;将装有试剂的装置C称重,记为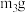 ,按如图连接好装置进行实验。
,按如图连接好装置进行实验。
(1)请写出反应中生成水合碳酸镧的化学方程式为_______ 。
(2)实验II的具体实验步骤为:打开 、
、 和
和 ,通数分钟
,通数分钟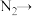
_______ →_______ →熄灭酒精喷灯→_______ →_______ →_______ →_______ →重复上述操作步骤,直至A恒重,记为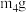 (此时装置A中固体为
(此时装置A中固体为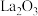 ,
,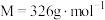 );称重装置C,记为
);称重装置C,记为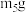 。
。
①冷却到室温,称量A
②点燃酒精喷灯,加热A中样品
③通入数分钟时间的
④关闭 和
和
⑤关闭 、
、 ,打开
,打开
⑥打开
(3)实验II中通入氮气的目的是_______ 。
(4)下列说法不正确的是_______。
(5)计算水合碳酸镧化学式中结晶水数目x=_______ (用含 、
、 、
、 的式子表示,不用化简)。
的式子表示,不用化简)。
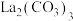 ,
,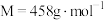 ]为白色难溶固体,分解温度为900℃。在溶液中制备时,形成水合碳酸镧
]为白色难溶固体,分解温度为900℃。在溶液中制备时,形成水合碳酸镧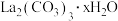 ,若溶液碱性太强,会生成受热易分解的碱式碳酸镧
,若溶液碱性太强,会生成受热易分解的碱式碳酸镧 。已知酒精喷灯火焰温度可达1000℃。
。已知酒精喷灯火焰温度可达1000℃。实验I:用如图装置模拟制备水合碳酸镧

 ,并测定
,并测定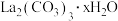 中结晶水的含量。将石英玻璃A管称重,记为
中结晶水的含量。将石英玻璃A管称重,记为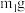 ;将样品装入石英玻璃管中,再次将装置A称重,记为
;将样品装入石英玻璃管中,再次将装置A称重,记为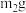 ;将装有试剂的装置C称重,记为
;将装有试剂的装置C称重,记为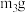 ,按如图连接好装置进行实验。
,按如图连接好装置进行实验。
(1)请写出反应中生成水合碳酸镧的化学方程式为
(2)实验II的具体实验步骤为:打开
 、
、 和
和 ,通数分钟
,通数分钟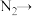
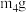 (此时装置A中固体为
(此时装置A中固体为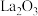 ,
,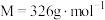 );称重装置C,记为
);称重装置C,记为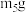 。
。①冷却到室温,称量A
②点燃酒精喷灯,加热A中样品
③通入数分钟时间的

④关闭
 和
和
⑤关闭
 、
、 ,打开
,打开
⑥打开

(3)实验II中通入氮气的目的是
(4)下列说法不正确的是_______。
| A.实验Ⅰ装置的接口连接顺序为f→b→a→d,e←c |
B.制备水合碳酸镧时应先通入 ,防止碱性太强生成副产物碱式碳酸镧 ,防止碱性太强生成副产物碱式碳酸镧 |
C.根据实验记录,当 时,说明制得的样品中不含 时,说明制得的样品中不含 |
| D.实验II装置B中的试剂是浓硫酸,也可通过装置B的增重量达成实验II的目的 |
 、
、 、
、 的式子表示,不用化简)。
的式子表示,不用化简)。
您最近一年使用:0次
2022-03-19更新
|
370次组卷
|
3卷引用:江西省抚州市金溪县第一中学2022-2023学年高二上学期开学考试 化学试卷
名校
解题方法
8 . 河南省镁资源丰富,河南崮山镁业为国内最大的氧化镁生产企业,其利用蛇纹石制备的高纯氧化镁,颗粒细腻不结团。其工艺流程如下:
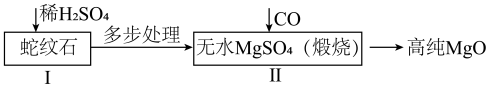
某校化学兴趣小组在实验室探究流程II中的反应原理,并检验产物纯度。回答下列问题:
(1)甲同学设计了如图实验装置探究流程II中的反应原理。
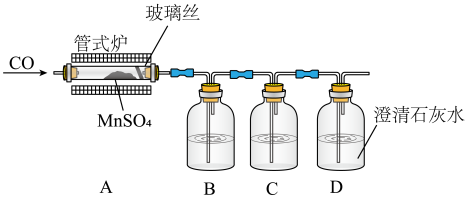
①检验气态产物中是否有SO2及SO3,则装置B、C中的溶液分别是_______ (填标号)。
a.Ba(NO3)2溶液 b.BaCl2溶液 c.浓硫酸 d.酸性高锰酸钾溶液
②实验过程中,装置B中没有明显现象,装置C、D中现象明显,写出A中发生反应的化学方程式:_______ 。
(2)丙同学利用反应:HCOOH CO↑+H2O为甲同学的实验提供CO气体,并设计以下实验装置图。
CO↑+H2O为甲同学的实验提供CO气体,并设计以下实验装置图。

①E装置中,仪器b的名称是_______ 。
②制备的CO气体中常含有杂质气体_______ 、挥发出来的少量甲酸蒸气及水蒸气,已知F装置中盛放的是NaOH溶液,则G装置的作用是_______ 。
(3)Mg2+的含量测定:向含Mg2+的溶液中加入铬黑T溶液(含Hlnd2-离子)作指示剂,用EDTA标准溶液(含H2Y2-离子)滴定。溶液中发生的反应如下:Mg2++Hlnd2-(天蓝色)=Mglnd-(酒红色)+H+,Mg2++H2Y2-=MgY2-+2H+。丁同学称取4.1g样品MgO,溶于稀硫酸,移入1000mL容量瓶中稀释至刻度。取20 mL溶液于锥形瓶中,加2滴铬黑T溶液,用0.1000mol·L-1EDTA溶液滴定,实验数据如下:
①滴定终点的现象是_______ 。
②计算4.1 g样品MgO中镁离子的物质的量为_______ mol(保留两位有效数字)。

某校化学兴趣小组在实验室探究流程II中的反应原理,并检验产物纯度。回答下列问题:
(1)甲同学设计了如图实验装置探究流程II中的反应原理。

①检验气态产物中是否有SO2及SO3,则装置B、C中的溶液分别是
a.Ba(NO3)2溶液 b.BaCl2溶液 c.浓硫酸 d.酸性高锰酸钾溶液
②实验过程中,装置B中没有明显现象,装置C、D中现象明显,写出A中发生反应的化学方程式:
(2)丙同学利用反应:HCOOH
 CO↑+H2O为甲同学的实验提供CO气体,并设计以下实验装置图。
CO↑+H2O为甲同学的实验提供CO气体,并设计以下实验装置图。
①E装置中,仪器b的名称是
②制备的CO气体中常含有杂质气体
(3)Mg2+的含量测定:向含Mg2+的溶液中加入铬黑T溶液(含Hlnd2-离子)作指示剂,用EDTA标准溶液(含H2Y2-离子)滴定。溶液中发生的反应如下:Mg2++Hlnd2-(天蓝色)=Mglnd-(酒红色)+H+,Mg2++H2Y2-=MgY2-+2H+。丁同学称取4.1g样品MgO,溶于稀硫酸,移入1000mL容量瓶中稀释至刻度。取20 mL溶液于锥形瓶中,加2滴铬黑T溶液,用0.1000mol·L-1EDTA溶液滴定,实验数据如下:
| 序号 | 1 | 2 | 3 | 4 |
| 标准溶液体积/mL | 20.10 | 18.40 | 19.90 | 20.00 |
②计算4.1 g样品MgO中镁离子的物质的量为
您最近一年使用:0次
名校
解题方法
9 . W、X、Y、Z是原子序数依次增大的短周期主族元素,原子序数总和为25,Y是地壳中含量最多的元素,由这四种元素形成的某化合物的结构如图所示。下列叙述正确的是
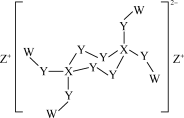
| A.原子半径大小:Z>Y>X>W |
| B.该化合物具有强氧化性,用于消毒杀菌 |
| C.X可与Y形成XY、XY2等共价化合物 |
| D.W分别与X、Y、Z形成的化合物所含化学键类型相同 |
您最近一年使用:0次
2022-03-29更新
|
2669次组卷
|
17卷引用:江西省景德镇一中2022-2023学年高二上学期期中考试化学试题
江西省景德镇一中2022-2023学年高二上学期期中考试化学试题安徽省安庆市第二中学2021-2022学年高二下学期期中考试化学试题黑龙江省实验中学 2021-2022学年高二下学期第一次月考化学试题吉林省吉林市第一中学2021-2022学年高二下学期6月月考化学试题(理科创新班)陕西省咸阳市2022届高考模拟检测(二模)理科综合化学试题山东省泰安市2022届高三二轮验收考试化学试题(已下线)化学-2022年高考考前押题密卷(湖南卷)广东省深圳外国语学校2021-2022学年高一下学期期中考试化学试题山西省太原市英才学校高中部2022-2023学年高三上学期12月第三次测试化学试题湖北省宜昌英杰学校2021-2022学年高三上学期9月月考化学试题山西省太原市第五中学校2022-2023学年高三上学期期末考试化学试题湖南省株洲市南方中学2023届高三第六次月考化学试题巩固训练8辽宁省沈阳市第一二〇中学2022-2023学年高一下学期期初质量监测化学试题四川省绵阳南山中学2023届高三下学期高考仿真考试理综化学试题湖南衡阳名校2024届高三一轮复习12月第2周周练 化学试题山东省营市胜利第一中学2023-2024学年高一下学期4月份阶段性测试化学试题
名校
解题方法
10 . 已知A、B、C、D为原子序数依次增大的短周期元素,E为地壳中含量最高的过渡元素,A与D同主族,B与C同周期,且C与D的原子序数之和为20.甲、乙分别为元素E、A的单质,丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是
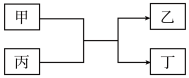

| A.A、B形成的一种化合物具有强氧化性 |
| B.B、D形成的离子化合物可能含有非极性键 |
| C.C的单质能与丙反应置换出B的单质 |
| D.丁为黑色固体,且1 mol甲与足量丙反应转移电子数为3NA(NA为阿伏加德罗常数的值) |
您最近一年使用:0次
2021-09-10更新
|
941次组卷
|
2卷引用:江西省景德镇市第一中学2021-2022学年高二上学期期末(重点班)化学试题



