名校
1 . 下列关于离子检验的说法正确的是
| A.检验溶液中是否含有Ba2+;取少量待测液,向其中加入少量稀硫酸,若有白色沉淀产生,则溶液中含有Ba2+ |
| B.检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是酸性KMnO4溶液 |
C.检验溶液中是否含有CO :取少量待测液,向其中加入适量稀盐酸,观察是否有大量气泡产生 :取少量待测液,向其中加入适量稀盐酸,观察是否有大量气泡产生 |
| D.在未知溶液中滴加稀盐酸出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液有Ag+ |
您最近一年使用:0次
名校
解题方法
2 . 磷酸亚铁[ ]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以
]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以 、
、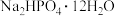 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为
 。合成磷酸亚铁的装置如图。
。合成磷酸亚铁的装置如图。

回答下列问题:
(1)仪器A的名称为___________ 。
(2)实验中需要210 0.1
0.1
 溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有
溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有___________ ,需要称量的绿矾( )的质量为
)的质量为___________ g。
(3)实验中应使用煮沸并冷却的蒸馏水配制酸性 溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为
溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为___________ 。
(4)实验时,在仪器A中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入 与
与 混合溶液至
混合溶液至 ,再滴入
,再滴入 溶液,最终维持
溶液,最终维持 。用抗坏血酸稀溶液作底液的作用是
。用抗坏血酸稀溶液作底液的作用是___________ 。
(5)生成的 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是___________ 。
(6)某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠(含 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到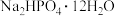 晶体。已知:
晶体。已知: 溶液的
溶液的 在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;
在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;___________ ,冷却结晶,过滤、洗涤及干燥。[实验中可选用的试剂: 溶液、0.1
溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、活性炭]
溶液、活性炭]
 ]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以
]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以 、
、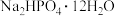 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为
 。合成磷酸亚铁的装置如图。
。合成磷酸亚铁的装置如图。
回答下列问题:
(1)仪器A的名称为
(2)实验中需要210
 0.1
0.1
 溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有
溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有 )的质量为
)的质量为(3)实验中应使用煮沸并冷却的蒸馏水配制酸性
 溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为
溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为(4)实验时,在仪器A中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入
 与
与 混合溶液至
混合溶液至 ,再滴入
,再滴入 溶液,最终维持
溶液,最终维持 。用抗坏血酸稀溶液作底液的作用是
。用抗坏血酸稀溶液作底液的作用是(5)生成的
 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是(6)某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠(含
 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到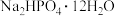 晶体。已知:
晶体。已知: 溶液的
溶液的 在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;
在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水; 溶液、0.1
溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、活性炭]
溶液、活性炭]
您最近一年使用:0次
2023-10-22更新
|
321次组卷
|
3卷引用:新疆生产建设兵团第二中学(新疆兵团地州学校)2023-2024学年高三上学期期中联考化学试题
名校
解题方法
3 . 下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中: 、Na+、[Al(OH)4]-、
、Na+、[Al(OH)4]-、
③加入Al能放出H2的溶液中:Cl-、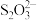 、
、 、
、
④由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、 、SCN-、
、SCN-、
⑥酸性溶液中:Fe2+、Al3+、NO 、I-、Cl-
、I-、Cl-
①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中:
 、Na+、[Al(OH)4]-、
、Na+、[Al(OH)4]-、
③加入Al能放出H2的溶液中:Cl-、
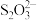 、
、 、
、
④由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、
 、SCN-、
、SCN-、
⑥酸性溶液中:Fe2+、Al3+、NO
 、I-、Cl-
、I-、Cl-| A.①② | B.③⑥ | C.②④ | D.③⑤ |
您最近一年使用:0次
2023-08-26更新
|
1315次组卷
|
3卷引用:新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题
名校
解题方法
4 . 由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4•7H2O),然后制取透明氧化铁颜料的流程如图:
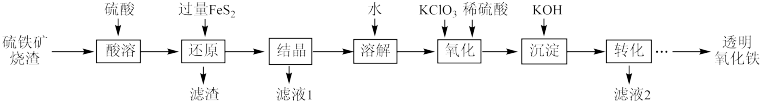
已知:
I.透明氧化铁又称纳米氧化铁,粒子直径很微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
II.Fe3+能将FeS2中的硫元素氧化为+6价。
(1)FeS2的电子式是_____ 。
(2)“滤渣”中的主要成分是_____ (填名称)。
(3)流程中“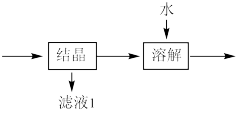 ”环节的目的是
”环节的目的是_____ 。
(4)“还原”过程中涉及的离子方程式为_____ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以_____ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示。
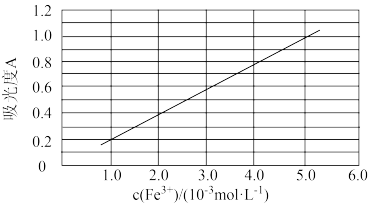
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL,测得溶液吸光度A=0.8,则透明氧化铁中氧化铁黄的质量分数为_____ 。

已知:
I.透明氧化铁又称纳米氧化铁,粒子直径很微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
II.Fe3+能将FeS2中的硫元素氧化为+6价。
(1)FeS2的电子式是
(2)“滤渣”中的主要成分是
(3)流程中“
 ”环节的目的是
”环节的目的是(4)“还原”过程中涉及的离子方程式为
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示。

称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL,测得溶液吸光度A=0.8,则透明氧化铁中氧化铁黄的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 为探究铁及其化合物的性质,某化学兴趣小组利用铁与水蒸气反应所得的固体进行了实验,先用过量盐酸溶解,并分成4份,继续如下实验:
依据上述实验现象,下列结论合理的是
| 实验 | 操作与现象 |
| ① | 加入高锰酸钾溶液,紫色褪去 |
| ② | 加入 溶液,生成蓝色沉淀 溶液,生成蓝色沉淀 |
| ③ | 加入KSCN溶液,无明显现象 |
| ④ | 加入NaOH溶液,生成的白色沉淀逐渐变为灰绿色,最后变为红褐色 |
A.实验①说明溶液中一定含有 |
| B.实验③说明该固体中不含三价铁 |
| C.实验②③说明反应后的固体中有铁粉剩余 |
D.实验④中灰绿色的沉淀是 |
您最近一年使用:0次
2023-01-14更新
|
438次组卷
|
4卷引用:新疆维吾尔自治区部分名校2022-2023学年高三上学期期末大联考化学试题
9-10高二下·山东潍坊·期末
名校
解题方法
6 . 要证明某溶液中不含Fe3+,而可能含有Fe2+,进行如下实验操作的最佳顺序为
①加入足量氯水②加入足量KMnO4(H+)溶液③加入少量KSCN溶液
①加入足量氯水②加入足量KMnO4(H+)溶液③加入少量KSCN溶液
| A.①③ | B.③① | C.①②③ | D.③②① |
您最近一年使用:0次
2023-01-09更新
|
366次组卷
|
113卷引用:【全国校级联考】新疆维吾尔自治区昌吉市教育共同体2019届高三上学期9月月考化学试题
【全国校级联考】新疆维吾尔自治区昌吉市教育共同体2019届高三上学期9月月考化学试题(已下线)2010年江苏省泰兴市重点中学高三上学期第一次检测化学试题(已下线)2012届上海市松江二中高三上学期期中考试化学试卷(已下线)2011-2012学年内蒙古巴彦淖尔市中学高三期中考试化学试卷(已下线)2013届辽宁朝阳柳城高级中学高三上学期第二次月考化学试卷2016届江西省宜春市铜鼓中学高三二模化学试卷2017届河北省故城县高级中学高三上学期期中化学试卷宁夏银川市兴庆区2018届高三上学期第二次月考化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【教学案】(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)新疆疏勒县八一中学2018-2019学年高一上学期期末考试化学试题上海市青浦二中2016届高三上学期8月摸底考试化学试题(已下线)上海市建平中学2013届高三第一次模拟化学试题广东省中山市中山纪念中学2020届高三第二次质量检测化学试题陕西省榆林市第十二中学2021届高三上学期第一次月考化学试题福建省莆田第二十五中学2021届高三上学期月考二化学试题陕西省榆林市子洲中学2021届高三上学期第一次月考化学试题(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练新疆新源县第二中学2019-2020学年高一上学期期末考试化学试题(已下线)微专题13 亚铁离子、三价铁离子的性质及检验-备战2022年高考化学考点微专题广东省普宁二中实验学校2021-2022学年高三上学期第一次月考化学试题上海市向明中学2021-2022学年高三上学期期中考试化学试题(已下线)第07讲 铁及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省牡丹江市第三高级中学2022-2023学年高三上学期第一次月考化学试题新疆阿克苏市实验中学2021-2022学年高一上学期期末考试化学(文)试题新疆阿克苏市实验中学2021-2022学年高一上学期期末考试化学(理)试题新疆可克达拉市镇江高级中学2022-2023学年高一上学期期末考试化学试题新疆昌吉州行知学校2022-2023学年高一下学期第一次月考化学试题新疆石河子第一中学2023-2024学年高一上学期11月月考化学试题(已下线)2010年潍坊市高二下学期新课程期末测试化学(已下线)2010年上海市吴淞中学高二上学期期中考试化学试卷(已下线)2010—2011年福建省厦门市杏南中学高一12月月考化学卷(已下线)2011-2012学年上海市崇明中学高二上学期期中考试化学试卷(已下线)2011-2012学年江苏省泰州中学高三化学期中化学试卷(已下线)2011-2012学年黑龙江省庆安三中高一上学期期末考试化学试卷(已下线)2011-2012学年云南省玉溪一中高一下学期期中考试化学试卷(已下线)2015河北保定某重点中学同步作业(必修1苏教版)3.2.2铜铁及其化合物(已下线)2014-2015学年福建省三明一中高一上学期期中化学试卷2015-2016学年黑龙江省哈尔滨六中高一上期末化学试卷2015-2016学年河北省冀州中学高一下开学考试化学试卷2015-2016学年广东省清远市高一上学期期末考试化学试卷2015-2016学年黑龙江省海林林业局一中高一上学期期末化学试卷2015-2016学年河南省安阳三十六中高二6月月考化学试卷2015-2016学年辽宁省庄河高中高一下期末化学试卷2015-2016学年山西晋城市高平市特立高级中学高二下期中理科化学卷2016-2017学年福建省三明一中高一上期中化学卷2016-2017学年吉林省实验中学高一上学期期末化学试卷上海市金山中学2016-2017学年高二上学期期末等级考试化学试题河南省鹤壁市淇滨高级中学2017-2018学年高一上学期第三次月考化学试题安徽省濉溪县临涣中学2017-2018学年高一上学期第二次月考化学试题河北省辛集中学2017-2018学年高一上学期第三次阶段考试化学试题湖北省长阳中学2017-2018学年高一化学上学期期末考试题山东省昌邑市第一中学2017-2018学年高一上学期第二次期末模拟考试化学试题湖南省石门县第一中学2016-2017学年高一下学期期末考试化学试题内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题黑龙江省伊春市第二中学2017-2018学年高二下学期期末考试化学试题人教版2017-2018学年高一化学必修1:3.2 几种重要的金属化合物 同步测试1吉林省辽源市田家炳高级中学等五校2017-2018学年高一上学期期末联考(第64届)化学试题【全国百强校】云南省玉溪市第一中学2018-2019学年高一上学期第一次月考化学试题山东省泰安市宁阳一中2018-2019学年高一上学期阶段性考试二(12月)化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题内蒙古开来中学2018-2019学年高二下学期期末考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二下学期期末考试化学试题云南省易门一中2019-2020学年高二开学考试化学试题(已下线)上海市华东师范大学第二附属中学2016-2017学年高二上学期期末考试化学试题上海市吴淞中学2017-2018学年高二上第一次月考化学试题上海市复旦中学2019-2020学年高二上学期第一次月考化学试题上海市上海交大附中2017-2018高二上期末化学题2019学年上海市奉贤区曙光中学高二化学上学期期中考试试卷福建省三明第一中学2019-2020学年高一上学期期中考试化学试题浙江省金华市东阳中学2019-2020学年高一上学期期中考试化学试题山东省德州市夏津县双语中学2019-2020学年高一12月月考化学试题宁夏青铜峡市高级中学2019-2020学年高一上学期期末考试化学试题甘肃省武威第八中学2019—2020学年高一上学期期末考试化学试题四川省三台县芦溪中学2017—2018学年高一上学期第三次月考化学试题四川省绵阳市三台县芦溪中学2017-2018学年高一上学期第三次月考化学试题上海市华东师大二附中2016-2017学年高二(上)期末化学试卷人教版高中化学必修一第三章《金属及其化合物》测试卷1山西省运城市盐湖五中2019-2020学年高一上学期期中考试化学试题(已下线)【南昌新东方】湾里一中2019-2020 高一(上)期末吉林省长春市九台区第四中学2019-2020高一上学期期末测试化学试题海南省海南枫叶国际学校2019-2020学年高一上学期期末考试化学试题甘肃省武威市第十八中学2019-2020学年高一上学期期末考试化学试题辽宁省阜新市第二高级中学2019-2020学年高一下学期期末考试化学试题上海南洋中学2019-2020学年高二上学期期中复习卷(沪科版)化学试题(已下线)3.1.2 铁及其化合物之间的转化关系练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)人教版(2019)高一必修第一册第三章 铁 金属材料 第一节 铁及其化合物 课时2 铁盐、亚铁盐鲁科版(2019)高一必修第一册第三章第1节 铁的多样性 课时1 亚铁盐和铁盐铁 铁的氧化物和铁的氢氧化物(已下线)第三章 铁 金属材料(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版2019必修第一册)(已下线)3.1.2 铁的重要化合物-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)【浙江新东方】71.河北省石家庄市第二中学西校区2020-2021学年高一上学期12月月考化学试卷辽宁省阜新市第二高级中学2020-2021学年高一上学期期末考试化学试题宁夏青铜峡市高级中学2020-2021学年高一上学期期末考试化学试题黑龙江省大庆市肇州县肇州中学2020-2021学年高一下学期第一次月考化学试题黑龙江省伊春市伊美区第二中学2020-2021学年高一上学期第三次月考化学试题福建省莆田第十五中学2018-2019学年高一下学期期中测试化学试题(苏教版2019)必修第二册专题9 金属与人类文明 第二单元 探究铁及其化合物的转化黑龙江省双鸭山市第一中学2020-2021学年高一第二次月考化学试题上海市向明中学2021-2022学年高二上学期期中考试化学试题浙江省乐清市知临中学2021-2022学年高一上学期期中考试化学(B)试题黑龙江省牡丹江市第三高级中学2021-2022学年高一上学期期末考试化学试题黑龙江省牡丹江市第三高级中学2021-2022学年高一下学期开学考试化学试题第三章 铁金属材料 本章复习提升黑龙江省嫩江市第一中学2021-2022学年高一下学期开学考试化学试题甘肃省武威市古浪县第二中学2021-2022学年高一上学期期末考试化学试题四川省凉山州宁南中学2022-2023学年高一上学期第二次月考化学试题辽宁省大石桥市第三高级中学2021-2022学年高一12月月考化学试题云南省大姚县第一中2021-2022学年高一下学期3月份考试化学试题吉林省永吉县第四中学2022-2023学年高一上学期期末考试化学试题黑龙江省富锦市第一中学2022-2023学年高一下学期第一次考试化学试题第1课时 亚铁盐和铁盐四川省宜宾市兴文第二中学校2023-2024学年高一下学期开学化学试题
7 . 铜及其化合物在生产、生活中有广泛的应用。印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路铜板制备CuCl2•2H2O,实验室模拟回收过程如图:

(1)证明步骤1所加FeCl3溶液过量的方法是____ 。
(2)步骤2中所加的氧化剂较适宜的有____ 。
(3)步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的试剂1是___ 。
A.NH3•H2O B.NaOH C.Cu(OH)2
(4)蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是____ (写出离子反应方程式并结合简要的文字说明),再经____ (某实验操作方法)、过滤得到CuCl2•2H2O。
方法一:用FeCl3溶液浸泡印刷电路铜板制备CuCl2•2H2O,实验室模拟回收过程如图:

(1)证明步骤1所加FeCl3溶液过量的方法是
(2)步骤2中所加的氧化剂较适宜的有
| A.HNO3 | B.H2O2 | C.KMnO4 | D.氯水 |
A.NH3•H2O B.NaOH C.Cu(OH)2
(4)蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是
您最近一年使用:0次
名校
8 . 根据实验目的,下列操作、现象及结论都正确的是
| 选项 | 目的 | 操作及现象 | 结论 |
| A | 检验 的性质 的性质 | 向试管中加入3mL稀 酸性溶液,再通入 酸性溶液,再通入 气体,紫红色褪去 气体,紫红色褪去 |  具有漂白性 具有漂白性 |
| B | 检验补铁口服液中是否含有 | 加入KSCN溶液无明显现象,再滴加少量氯水,溶液立即变为红色 | 含有 |
| C | 检验 固体是否变质 固体是否变质 | 溶解后,滴加硝酸酸化的硝酸钡溶液,产生白色沉淀 | 已变质 |
| D | 检验某溶液中是否含有 | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 不含 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-27更新
|
254次组卷
|
3卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高三上学期11月月考化学试题
9 . 铁元素是人体重要的微量元素,参与人体血红蛋白的形成,人体内的铁大部分是+2价的铁, 易被人体吸收,下列有关铁及其化合物的说法正确的是
易被人体吸收,下列有关铁及其化合物的说法正确的是
 易被人体吸收,下列有关铁及其化合物的说法正确的是
易被人体吸收,下列有关铁及其化合物的说法正确的是A.维生素C具有氧化性,可将难吸收的 转化为 转化为 ,促进人体对铁元素的吸收 ,促进人体对铁元素的吸收 |
B.向 溶液中加入KSCN溶液,溶液变为红色 溶液中加入KSCN溶液,溶液变为红色 |
C.向 溶液中加入NaOH溶液,生成红褐色沉淀 溶液中加入NaOH溶液,生成红褐色沉淀 |
D. 溶液滴在淀粉-KI试纸上,试纸变蓝 溶液滴在淀粉-KI试纸上,试纸变蓝 |
您最近一年使用:0次
2022-08-17更新
|
608次组卷
|
4卷引用:新疆第二师八一中学2022-2023学年高三上学期第一次月考化学试题
名校
解题方法
10 . 以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴(CoxOy)的流程如下:
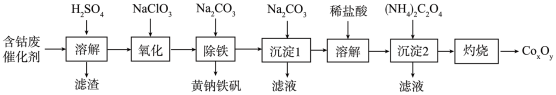
(1)用H2SO4溶解后过滤,得到的滤渣是_______ (填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是_______ 。
(2)在加热搅拌条件下加入NaClO3将Fe2+氧化成Fe3+,反应的离子方程式是_______ 。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2 (蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3 (蓝色沉淀)
确定Fe2+是否氧化完全的方法是_______ 。
(仅供选择的试剂:铁氯化钾溶液、亚铁氯化钾溶液、铁粉、KSCN溶液)
(4)“除铁”工艺中加入适量的Na2CO3,调节pH约为2,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:_______ 。

(1)用H2SO4溶解后过滤,得到的滤渣是
(2)在加热搅拌条件下加入NaClO3将Fe2+氧化成Fe3+,反应的离子方程式是
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2 (蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3 (蓝色沉淀)
确定Fe2+是否氧化完全的方法是
(仅供选择的试剂:铁氯化钾溶液、亚铁氯化钾溶液、铁粉、KSCN溶液)
(4)“除铁”工艺中加入适量的Na2CO3,调节pH约为2,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:
您最近一年使用:0次
2022-06-24更新
|
284次组卷
|
3卷引用:新疆石河子第一中学2022-2023学年高三10月月考化学试题



