名校
解题方法
1 . 磷酸亚铁[ ]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以
]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以 、
、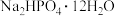 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为
 。合成磷酸亚铁的装置如图。
。合成磷酸亚铁的装置如图。

回答下列问题:
(1)仪器A的名称为___________ 。
(2)实验中需要210 0.1
0.1
 溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有
溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有___________ ,需要称量的绿矾( )的质量为
)的质量为___________ g。
(3)实验中应使用煮沸并冷却的蒸馏水配制酸性 溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为
溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为___________ 。
(4)实验时,在仪器A中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入 与
与 混合溶液至
混合溶液至 ,再滴入
,再滴入 溶液,最终维持
溶液,最终维持 。用抗坏血酸稀溶液作底液的作用是
。用抗坏血酸稀溶液作底液的作用是___________ 。
(5)生成的 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是___________ 。
(6)某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠(含 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到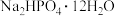 晶体。已知:
晶体。已知: 溶液的
溶液的 在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;
在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;___________ ,冷却结晶,过滤、洗涤及干燥。[实验中可选用的试剂: 溶液、0.1
溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、活性炭]
溶液、活性炭]
 ]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以
]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以 、
、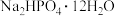 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为
 。合成磷酸亚铁的装置如图。
。合成磷酸亚铁的装置如图。
回答下列问题:
(1)仪器A的名称为
(2)实验中需要210
 0.1
0.1
 溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有
溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有 )的质量为
)的质量为(3)实验中应使用煮沸并冷却的蒸馏水配制酸性
 溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为
溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为(4)实验时,在仪器A中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入
 与
与 混合溶液至
混合溶液至 ,再滴入
,再滴入 溶液,最终维持
溶液,最终维持 。用抗坏血酸稀溶液作底液的作用是
。用抗坏血酸稀溶液作底液的作用是(5)生成的
 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是(6)某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠(含
 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到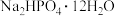 晶体。已知:
晶体。已知: 溶液的
溶液的 在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;
在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水; 溶液、0.1
溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、活性炭]
溶液、活性炭]
您最近一年使用:0次
2023-10-22更新
|
321次组卷
|
3卷引用:新疆生产建设兵团第二中学(新疆兵团地州学校)2023-2024学年高三上学期期中联考化学试题
名校
解题方法
2 . 下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中: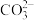 、Na+、[Al(OH)4]-、
、Na+、[Al(OH)4]-、
③加入Al能放出H2的溶液中:Cl-、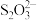 、
、 、
、
④由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、 、SCN-、
、SCN-、
⑥酸性溶液中:Fe2+、Al3+、NO 、I-、Cl-
、I-、Cl-
①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中:
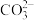 、Na+、[Al(OH)4]-、
、Na+、[Al(OH)4]-、
③加入Al能放出H2的溶液中:Cl-、
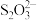 、
、 、
、
④由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、
 、SCN-、
、SCN-、
⑥酸性溶液中:Fe2+、Al3+、NO
 、I-、Cl-
、I-、Cl-| A.①② | B.③⑥ | C.②④ | D.③⑤ |
您最近一年使用:0次
2023-08-26更新
|
1315次组卷
|
3卷引用:新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题
名校
解题方法
3 . 由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4•7H2O),然后制取透明氧化铁颜料的流程如图:
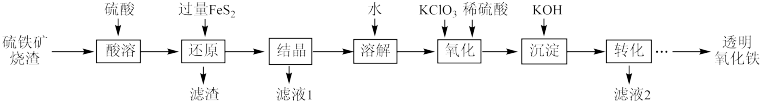
已知:
I.透明氧化铁又称纳米氧化铁,粒子直径很微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
II.Fe3+能将FeS2中的硫元素氧化为+6价。
(1)FeS2的电子式是_____ 。
(2)“滤渣”中的主要成分是_____ (填名称)。
(3)流程中“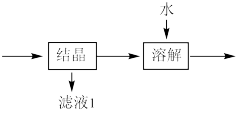 ”环节的目的是
”环节的目的是_____ 。
(4)“还原”过程中涉及的离子方程式为_____ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以_____ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示。
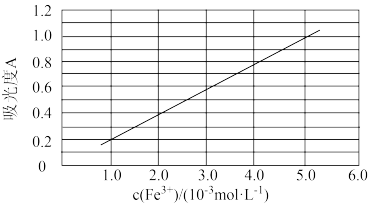
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL,测得溶液吸光度A=0.8,则透明氧化铁中氧化铁黄的质量分数为_____ 。

已知:
I.透明氧化铁又称纳米氧化铁,粒子直径很微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
II.Fe3+能将FeS2中的硫元素氧化为+6价。
(1)FeS2的电子式是
(2)“滤渣”中的主要成分是
(3)流程中“
 ”环节的目的是
”环节的目的是(4)“还原”过程中涉及的离子方程式为
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示。

称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL,测得溶液吸光度A=0.8,则透明氧化铁中氧化铁黄的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 为探究铁及其化合物的性质,某化学兴趣小组利用铁与水蒸气反应所得的固体进行了实验,先用过量盐酸溶解,并分成4份,继续如下实验:
依据上述实验现象,下列结论合理的是
| 实验 | 操作与现象 |
| ① | 加入高锰酸钾溶液,紫色褪去 |
| ② | 加入 溶液,生成蓝色沉淀 溶液,生成蓝色沉淀 |
| ③ | 加入KSCN溶液,无明显现象 |
| ④ | 加入NaOH溶液,生成的白色沉淀逐渐变为灰绿色,最后变为红褐色 |
A.实验①说明溶液中一定含有 |
| B.实验③说明该固体中不含三价铁 |
| C.实验②③说明反应后的固体中有铁粉剩余 |
D.实验④中灰绿色的沉淀是 |
您最近一年使用:0次
2023-01-14更新
|
438次组卷
|
4卷引用:新疆维吾尔自治区部分名校2022-2023学年高三上学期期末大联考化学试题



