1 . 某实验小组探究Fe2+与H2O2反应中滴加KSCN溶液变红色后又褪色的原因,提出如下假设:
a.Fe3+被H2O2还原 b.SCN-被O2氧化 c.SCN-被H2O2氧化。
设计如下实验,下列说法错误的是
a.Fe3+被H2O2还原 b.SCN-被O2氧化 c.SCN-被H2O2氧化。
设计如下实验,下列说法错误的是
| 实验 | 滴加试剂 | 现象 |
| I | i.向2mLFeCl2溶液中滴加2滴0.1mol·L-1KSCN溶液 ii.再滴加5滴5%H2O2溶液(物质的量浓度约为1.5mol·L-1、pH约为5) | i.无明显现象 ii.溶液变红,大约10秒左右红色褪去,并测得生成了两种可直接排放到空气中的气体 |
| II | iii.取褪色后溶液两份,一份滴加FeC13溶液;另一份滴加KSCN溶液 iV.取褪色后溶液,滴加盐酸和BaCl2溶液 | iii.一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色 iV.产生白色沉淀 |
| III | V.向2mL0.1mol·L-1FeCl3溶液中滴加2滴0.1mol·L-1KSCN溶液,观察现象;后通入O2,观察现象 | V.先变红,通入氧气后无明显变化 |
| A.实验I褪色后的溶液中n(H+)变小 | B.通过实验II、III可验证假设c正确 |
C.实验II证明SCN-被氧化成SO | D.实验III的目的是排除假设b |
您最近一年使用:0次
名校
解题方法
2 . 某化学兴趣小组在研究“铁及其化合物性质”时,发现向 溶液中滴加2滴
溶液中滴加2滴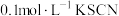 溶液;无明显现象,再滴加
溶液;无明显现象,再滴加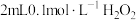 溶液溶液(
溶液溶液( 约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
(1)溶液先变红的原因是____________ 、____________ (用两个离子方程式表示)。
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是 被
被 还原。取褪色后溶液,滴加
还原。取褪色后溶液,滴加 溶液,无明显现象,证明甲同学观点不正确。
溶液,无明显现象,证明甲同学观点不正确。
Ⅱ.乙同学认为是 被氧化。取褪色后溶液,滴加
被氧化。取褪色后溶液,滴加 溶液,出现红色。
溶液,出现红色。
根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为 被
被 氧化。
氧化。
丙同学认为____________ 。
为了探究溶液褪色的原因究竟是上述的哪一种,该兴趣小组进行了如下实验。向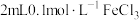 溶液中滴加2滴
溶液中滴加2滴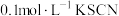 溶液,后通入
溶液,后通入 ,发现溶液
,发现溶液___________ ,证明溶液褪色的原因不是乙同学认为的原因,而是丙同学认为的原因。
(3)该兴趣小组通过查阅资料,发现 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体,写出上述实验中
和两种可直接排放到空气中的气体,写出上述实验中 被氧化的离子方程式:
被氧化的离子方程式:_________ 。
(4)根据题目所给信息及实验现象推断物质还原性强弱:
____________  (填“>”或“<”)
(填“>”或“<”)
 溶液中滴加2滴
溶液中滴加2滴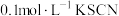 溶液;无明显现象,再滴加
溶液;无明显现象,再滴加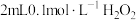 溶液溶液(
溶液溶液( 约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:(1)溶液先变红的原因是
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是
 被
被 还原。取褪色后溶液,滴加
还原。取褪色后溶液,滴加 溶液,无明显现象,证明甲同学观点不正确。
溶液,无明显现象,证明甲同学观点不正确。Ⅱ.乙同学认为是
 被氧化。取褪色后溶液,滴加
被氧化。取褪色后溶液,滴加 溶液,出现红色。
溶液,出现红色。根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为
 被
被 氧化。
氧化。丙同学认为
为了探究溶液褪色的原因究竟是上述的哪一种,该兴趣小组进行了如下实验。向
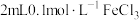 溶液中滴加2滴
溶液中滴加2滴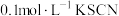 溶液,后通入
溶液,后通入 ,发现溶液
,发现溶液(3)该兴趣小组通过查阅资料,发现
 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体,写出上述实验中
和两种可直接排放到空气中的气体,写出上述实验中 被氧化的离子方程式:
被氧化的离子方程式:(4)根据题目所给信息及实验现象推断物质还原性强弱:

 (填“>”或“<”)
(填“>”或“<”)
您最近一年使用:0次
3 . 用富含铁元素的食品,可以补充人体所需的铁元素。某班级研究性学习小组对菠菜中的铁元素展开了检测,实验如下:

(1)下列图示装置或操作合理的是________ 。
(2)写出试剂B的化学式___________ 。
(3)试剂C若为双氧水,请写出该反应的离子方程式:___________ ;该实验证明菠菜中含有的铁元素为_____ 价。
(4)其中一名同学在研究过程中向滤液A中先加入氯水,再加入试剂B,也看到溶液变红,由此也得出和其他同学一样的结论。他的做法是否正确?______ ,原因是什么?___________ 。
(5)另取少量滤液 ,向其中加入少量NaOH溶液,观察到的现象是
,向其中加入少量NaOH溶液,观察到的现象是________ ;原因是___________ 、________ (用离子方程式解释)。

(1)下列图示装置或操作合理的是
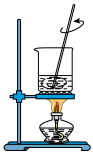 | 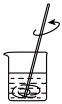 | 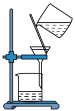 |  |
| A.灼烧 | B.溶解 | C.过滤 | D.检测菠菜液中的铁元素 |
(2)写出试剂B的化学式
(3)试剂C若为双氧水,请写出该反应的离子方程式:
(4)其中一名同学在研究过程中向滤液A中先加入氯水,再加入试剂B,也看到溶液变红,由此也得出和其他同学一样的结论。他的做法是否正确?
(5)另取少量滤液
 ,向其中加入少量NaOH溶液,观察到的现象是
,向其中加入少量NaOH溶液,观察到的现象是
您最近一年使用:0次
解题方法
4 . 某小组同学设计如下实验,研究亚铁盐与 溶液的反应。
溶液的反应。
【实验1】试剂:酸化的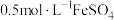 溶液(
溶液( ),
),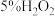 溶液(
溶液( )
)
(1)上述实验中 溶液与
溶液与 溶液反应的离子方程式是
溶液反应的离子方程式是_______ 。
(2)产生气泡的原因是_______ 。
【实验Ⅱ】试剂:未酸化的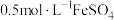 溶液(
溶液( ),
), 溶液(
溶液( )
)
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加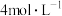 盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有
盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有 ,经检验还含有
,经检验还含有 。检验棕黄色沉淀中
。检验棕黄色沉淀中 的方法是
的方法是_______ 。
(4)对于生成红褐色胶体的原因,提出两种假设:
ⅰ. 溶液氧化
溶液氧化 消耗
消耗
ⅱ. 氧化的产物发生了水解
氧化的产物发生了水解
①根据实验Ⅱ记录否定假设ⅰ,理由是_______ 。
②实验验证假设ⅱ:取_______ ,加热,溶液变为红褐色, 下降,证明假设ⅱ成立。
下降,证明假设ⅱ成立。
(5)将 溶液加入
溶液加入 溶液后,产生红褐色胶体,反应的离子方程式是:
溶液后,产生红褐色胶体,反应的离子方程式是:_______ 。
 溶液的反应。
溶液的反应。【实验1】试剂:酸化的
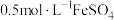 溶液(
溶液( ),
),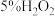 溶液(
溶液( )
)| 操作 | 现象 |
取 上述 上述 溶液于试管中,加入5滴 溶液于试管中,加入5滴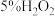 溶液 溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液 |
向反应后的溶液中加入 溶液 溶液 | 溶液变红 |
 溶液与
溶液与 溶液反应的离子方程式是
溶液反应的离子方程式是(2)产生气泡的原因是
【实验Ⅱ】试剂:未酸化的
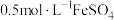 溶液(
溶液( ),
), 溶液(
溶液( )
)| 操作 | 现象 |
取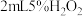 溶液于试管中,加入5滴上述 溶液于试管中,加入5滴上述 溶液 溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液 |
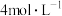 盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有
盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有 ,经检验还含有
,经检验还含有 。检验棕黄色沉淀中
。检验棕黄色沉淀中 的方法是
的方法是(4)对于生成红褐色胶体的原因,提出两种假设:
ⅰ.
 溶液氧化
溶液氧化 消耗
消耗
ⅱ.
 氧化的产物发生了水解
氧化的产物发生了水解①根据实验Ⅱ记录否定假设ⅰ,理由是
②实验验证假设ⅱ:取
 下降,证明假设ⅱ成立。
下降,证明假设ⅱ成立。(5)将
 溶液加入
溶液加入 溶液后,产生红褐色胶体,反应的离子方程式是:
溶液后,产生红褐色胶体,反应的离子方程式是:
您最近一年使用:0次
2023-07-05更新
|
351次组卷
|
3卷引用:广东省汕头市2022-2023学年高二下学期7月期末考试化学试题
5 . 某电子厂腐蚀废液含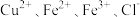 ,为了减少污染并变废为宝,工厂计划从废液中回收金属铜,并重新获得
,为了减少污染并变废为宝,工厂计划从废液中回收金属铜,并重新获得 溶液,请根据以下流程图,回答下列问题。
溶液,请根据以下流程图,回答下列问题。
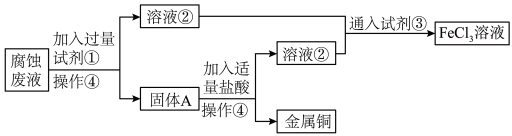
(1)②_______ (化学式)、③_______ (化学式)、④_______ (操作)。
(2)腐蚀废液中加入过量试剂①,写出发生反应的离子方程式_______ 。
(3)证明溶液②中不含 ,可往溶液中滴加
,可往溶液中滴加_______ (化学式)溶液。
(4)若已知处理前原腐蚀废液中 的质量
的质量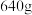 ,固体A的质量
,固体A的质量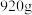 ,则流程图中加入适量盐酸(浓度
,则流程图中加入适量盐酸(浓度 )的体积至少
)的体积至少_______ L。
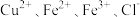 ,为了减少污染并变废为宝,工厂计划从废液中回收金属铜,并重新获得
,为了减少污染并变废为宝,工厂计划从废液中回收金属铜,并重新获得 溶液,请根据以下流程图,回答下列问题。
溶液,请根据以下流程图,回答下列问题。
(1)②
(2)腐蚀废液中加入过量试剂①,写出发生反应的离子方程式
(3)证明溶液②中不含
 ,可往溶液中滴加
,可往溶液中滴加(4)若已知处理前原腐蚀废液中
 的质量
的质量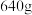 ,固体A的质量
,固体A的质量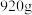 ,则流程图中加入适量盐酸(浓度
,则流程图中加入适量盐酸(浓度 )的体积至少
)的体积至少
您最近一年使用:0次
2023-02-10更新
|
240次组卷
|
2卷引用:广东省江门市2022-2023学年高一上学期调研测试(一)期末考试化学试题
6 . 某班同学用如下实验探究 、
、 的性质。回答下列问题:
的性质。回答下列问题:
(1)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和 溶液,继续煮沸至液体呈透明的
溶液,继续煮沸至液体呈透明的_________ 色,停止加热,即制得 胶体。用激光笔照射烧杯中的液体,可以看到
胶体。用激光笔照射烧杯中的液体,可以看到_________ 。
(2)甲组同学通过研究pH对 稳定性的影响,得到如图1所示结果,增强
稳定性的影响,得到如图1所示结果,增强 稳定性的措施为
稳定性的措施为_________ 。

(3)乙组同学为探究 与Cu的反应,进行如图2所示实验:
与Cu的反应,进行如图2所示实验:

① 与Cu反应的离子方程式为
与Cu反应的离子方程式为_________ 。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
ⅰ.CuSCN是难溶于水的白色固体;
ⅱ. 的化学性质与
的化学性质与 相似;
相似;
ⅲ. 。
。
填写实验方案:
 与
与 反应的离子方程式为
反应的离子方程式为_________ 。
(4)市售某种补铁口服液的主要成分是葡萄糖酸亚铁。根据名称认为该糖浆中含有 ,设计方案进行验证。
,设计方案进行验证。
①方案ⅰ中预期现象与实验现象相同,并不能证明补铁口服液中一定含有 ,猜想理由是
,猜想理由是_________ 。
②方案ⅱ中预期现象是_________ ;若方案ⅱ实际操作中自始至终无明显现象,说明符合方案ⅰ猜想理由。为验证猜想,在方案ⅱ的基础上可进行操作:_________ ,即可得到预期的现象。
 、
、 的性质。回答下列问题:
的性质。回答下列问题:(1)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和
 溶液,继续煮沸至液体呈透明的
溶液,继续煮沸至液体呈透明的 胶体。用激光笔照射烧杯中的液体,可以看到
胶体。用激光笔照射烧杯中的液体,可以看到(2)甲组同学通过研究pH对
 稳定性的影响,得到如图1所示结果,增强
稳定性的影响,得到如图1所示结果,增强 稳定性的措施为
稳定性的措施为
(3)乙组同学为探究
 与Cu的反应,进行如图2所示实验:
与Cu的反应,进行如图2所示实验:
①
 与Cu反应的离子方程式为
与Cu反应的离子方程式为②为了探究白色沉淀产生的原因,同学们查阅资料得知:
ⅰ.CuSCN是难溶于水的白色固体;
ⅱ.
 的化学性质与
的化学性质与 相似;
相似;ⅲ.
 。
。填写实验方案:
| 实验方案 | 实验现象 |
步骤1:取4mL0.2mol/L的 溶液,向其中滴加3滴0.1mol/LKSCN溶液 溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
步骤2:取4mL 溶液,向其中滴加3滴0.1mol/LKSCN溶液 溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 |
 与
与 反应的离子方程式为
反应的离子方程式为(4)市售某种补铁口服液的主要成分是葡萄糖酸亚铁。根据名称认为该糖浆中含有
 ,设计方案进行验证。
,设计方案进行验证。 | 方案 | 试剂X |
| 方案ⅰ | 1mL1mol/L酸性 溶液 溶液 | |
| 方案ⅱ | 依次加入5滴KSCN溶液、1mL氯水 |
 ,猜想理由是
,猜想理由是②方案ⅱ中预期现象是
您最近一年使用:0次
2023-01-08更新
|
190次组卷
|
2卷引用:陕西省汉中市2021-2022学年高一上学期期末校际联考化学试题
名校
7 . 某研究小组同学对市售某种补铁口服液的成分进行探究。根据名称认为该糖浆中含有 ,设计方案进行验证。
,设计方案进行验证。

Ⅰ.设计方案如下:
(1)方案ⅰ的预期现象是产生白色沉淀,逐渐变为灰绿色,最终变为红褐色。白色沉淀最终变为红褐色所涉及的化学方程式是_______ 。
(2)方案ⅱ的预期现象是_______ 。
(3)方案ⅲ的预期现象是_______ 。反应中双氧水参与反应的离子方程式是_______ 。
Ⅱ.进行实验操作,得到的实际现象如下:
(4)为探究实验中出现异常现象的原因,该小组同学查看说明书,得知有关补铁口服液成分的如下:
结合资料对异常现象产生的原因进行猜想:_______ ;为验证其猜想,在方案ⅱ的基础上继续加入过量的酸性 溶液,到了预期的现象。
溶液,到了预期的现象。
(5)实验反思:方案ⅱ中预期现象与实验现象相同,并不能证明补铁口服液中一定含有 ,理由是
,理由是_______ 。
(6)某兴趣小组同学进一步查阅资料,发现某种补铁口服液中 的含量为0.784mg/mL,则该补铁口服液中
的含量为0.784mg/mL,则该补铁口服液中
_______ mol/L。
 ,设计方案进行验证。
,设计方案进行验证。
Ⅰ.设计方案如下:
 | 方案 | 试剂X | 预期现象 |
| 方案ⅰ | 1mL1mol/LNaOH溶液 | a | |
| 方案ⅱ | 1mL1mol/L酸性 溶液 溶液 | b | |
| 方案ⅲ | 依次加入5滴KSCN溶液、1mL酸性 溶液 溶液 | c |
(2)方案ⅱ的预期现象是
(3)方案ⅲ的预期现象是
Ⅱ.进行实验操作,得到的实际现象如下:
| 方案 | 实际现象 | 是否与预期现象相同 |
| 方案ⅰ | 产生灰绿色浑浊,长时间不变红褐色 | 不同 |
| 方案ⅱ | 相同 | |
| 方案ⅲ | 自始至终无明显现象 | 不同 |
| 本品每毫升含主要成分葡萄糖酸亚铁30毫克,辅料为:蔗糖、香精、枸檬酸、羟苯乙酯。 |
 溶液,到了预期的现象。
溶液,到了预期的现象。(5)实验反思:方案ⅱ中预期现象与实验现象相同,并不能证明补铁口服液中一定含有
 ,理由是
,理由是(6)某兴趣小组同学进一步查阅资料,发现某种补铁口服液中
 的含量为0.784mg/mL,则该补铁口服液中
的含量为0.784mg/mL,则该补铁口服液中
您最近一年使用:0次
名校
8 . 二茂铁[Fe(C5H5)2,Fe为 价]是最早被发现的夹心配合物,橙色晶体,100℃ 以上升华,熔点172℃,沸点249℃,难溶于水,空气中稳定,与酸、碱一般不作用。实验室中,先由二聚环戊二烯C10H12(沸点170℃)热解聚制备环戊二烯C5H6(密度0.88g·cm-3,熔点-85℃,沸点42.5℃)(图1),然后制备二茂铁(图2),最后纯化(图3),夹持装置已略。回答下列问题:
价]是最早被发现的夹心配合物,橙色晶体,100℃ 以上升华,熔点172℃,沸点249℃,难溶于水,空气中稳定,与酸、碱一般不作用。实验室中,先由二聚环戊二烯C10H12(沸点170℃)热解聚制备环戊二烯C5H6(密度0.88g·cm-3,熔点-85℃,沸点42.5℃)(图1),然后制备二茂铁(图2),最后纯化(图3),夹持装置已略。回答下列问题:

(1)检查装置气密性并在烧瓶中加入二聚环戊二烯。实验中需要一直慢慢地通入N2,其作用是_______ 。将电热棒调至360~400℃,同时170℃油浴加热烧瓶,油浴加热的优点是_______ 。反应完成后在接收瓶中得到环戊二烯纯品。
(2)将磁子和足量 粉末放在三颈烧瓶中,加入适量有机溶剂和
粉末放在三颈烧瓶中,加入适量有机溶剂和 环戊二烯,缓慢搅拌,烧瓶左侧口用A塞紧,中间瓶口装上仪器C(已打开旋塞B和玻璃塞),右侧口接带T形管的汞起泡器和氮气瓶,用氮气流吹洗烧瓶和C直至空气完全吹出,关上B,将溶解了11.94gFeCl2·4H2O的有机溶剂注入仪器C,……打开B,滴加完后快速搅拌30min,制备反应结束。……向烧瓶中加入稍过量的盐酸和适量碎冰。……将烧瓶内的沉淀收集到过滤器上,用水洗涤,干燥,得到二茂铁粗品。
环戊二烯,缓慢搅拌,烧瓶左侧口用A塞紧,中间瓶口装上仪器C(已打开旋塞B和玻璃塞),右侧口接带T形管的汞起泡器和氮气瓶,用氮气流吹洗烧瓶和C直至空气完全吹出,关上B,将溶解了11.94gFeCl2·4H2O的有机溶剂注入仪器C,……打开B,滴加完后快速搅拌30min,制备反应结束。……向烧瓶中加入稍过量的盐酸和适量碎冰。……将烧瓶内的沉淀收集到过滤器上,用水洗涤,干燥,得到二茂铁粗品。
①仪器C的名称为_______ 。
②将空气完全吹出的目的是_______ 。
③加入碎冰的作用是_______ 。
④证明盐酸已稍过量的试剂是_______ 。
⑤写出生成二茂铁的反应的化学方程式:_______ 。
(3)将盛有粗品的培养皿放在电热板上加热,最终得到纯品9.49g,二茂铁的产率为_______ %(保留到小数点后一位)。
 价]是最早被发现的夹心配合物,橙色晶体,100℃ 以上升华,熔点172℃,沸点249℃,难溶于水,空气中稳定,与酸、碱一般不作用。实验室中,先由二聚环戊二烯C10H12(沸点170℃)热解聚制备环戊二烯C5H6(密度0.88g·cm-3,熔点-85℃,沸点42.5℃)(图1),然后制备二茂铁(图2),最后纯化(图3),夹持装置已略。回答下列问题:
价]是最早被发现的夹心配合物,橙色晶体,100℃ 以上升华,熔点172℃,沸点249℃,难溶于水,空气中稳定,与酸、碱一般不作用。实验室中,先由二聚环戊二烯C10H12(沸点170℃)热解聚制备环戊二烯C5H6(密度0.88g·cm-3,熔点-85℃,沸点42.5℃)(图1),然后制备二茂铁(图2),最后纯化(图3),夹持装置已略。回答下列问题:
(1)检查装置气密性并在烧瓶中加入二聚环戊二烯。实验中需要一直慢慢地通入N2,其作用是
(2)将磁子和足量
 粉末放在三颈烧瓶中,加入适量有机溶剂和
粉末放在三颈烧瓶中,加入适量有机溶剂和 环戊二烯,缓慢搅拌,烧瓶左侧口用A塞紧,中间瓶口装上仪器C(已打开旋塞B和玻璃塞),右侧口接带T形管的汞起泡器和氮气瓶,用氮气流吹洗烧瓶和C直至空气完全吹出,关上B,将溶解了11.94gFeCl2·4H2O的有机溶剂注入仪器C,……打开B,滴加完后快速搅拌30min,制备反应结束。……向烧瓶中加入稍过量的盐酸和适量碎冰。……将烧瓶内的沉淀收集到过滤器上,用水洗涤,干燥,得到二茂铁粗品。
环戊二烯,缓慢搅拌,烧瓶左侧口用A塞紧,中间瓶口装上仪器C(已打开旋塞B和玻璃塞),右侧口接带T形管的汞起泡器和氮气瓶,用氮气流吹洗烧瓶和C直至空气完全吹出,关上B,将溶解了11.94gFeCl2·4H2O的有机溶剂注入仪器C,……打开B,滴加完后快速搅拌30min,制备反应结束。……向烧瓶中加入稍过量的盐酸和适量碎冰。……将烧瓶内的沉淀收集到过滤器上,用水洗涤,干燥,得到二茂铁粗品。①仪器C的名称为
②将空气完全吹出的目的是
③加入碎冰的作用是
④证明盐酸已稍过量的试剂是
⑤写出生成二茂铁的反应的化学方程式:
(3)将盛有粗品的培养皿放在电热板上加热,最终得到纯品9.49g,二茂铁的产率为
您最近一年使用:0次
2022-05-29更新
|
405次组卷
|
2卷引用:安徽师范大学附属中学2022届高三适应性考试理综化学试题
9 . 化合物X由4种元素组成,按如下流程进行探究:

已知混合气体E与G的成分及成分之间比例相同,且G的质量是E的1.5倍。
请回答:
(1)组成X的四种元素_______ (填元素符号),X的化学式_______ 。
(2)写出固体B使酸性高锰酸钾溶液褪色的离子方程式_______ 。
(3)X分解成A、B、C的化学方程式_______ 。
(4)探究固体D时把 溶液改为氯水,逐滴加入氯水至过量的过程中,溶液先变血红色后褪色,褪色的原因可能是
溶液改为氯水,逐滴加入氯水至过量的过程中,溶液先变血红色后褪色,褪色的原因可能是_______ 。请设计实验证明_______ 。

已知混合气体E与G的成分及成分之间比例相同,且G的质量是E的1.5倍。
请回答:
(1)组成X的四种元素
(2)写出固体B使酸性高锰酸钾溶液褪色的离子方程式
(3)X分解成A、B、C的化学方程式
(4)探究固体D时把
 溶液改为氯水,逐滴加入氯水至过量的过程中,溶液先变血红色后褪色,褪色的原因可能是
溶液改为氯水,逐滴加入氯水至过量的过程中,溶液先变血红色后褪色,褪色的原因可能是
您最近一年使用:0次
10 . 某班同学用如下实验探究 与
与 的转化,回答下列问题,
的转化,回答下列问题,
(1)实验I: 转化为
转化为
实验步骤及现象;甲组同学将少量铜粉加入1mL 0.1mol/L 溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL 0.1mol/L
溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL 0.1mol/L  溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入1mL 0.05mol/L
溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入1mL 0.05mol/L  溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀,
溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀,
①分别取三组实验反应后的溶液于三支试管中_______ (填操作步骤以及现象),证明生成了 ;分析三组实验结果,实验中均发生的反应离子方程式为
;分析三组实验结果,实验中均发生的反应离子方程式为_________
②对比三组实验,说明加入蒸馏水后沉淀的产生与_________ 有关。
③向丙组实验后的溶液中加入饱和NaCl溶液可能出现的现象为_________ 。
④丙组在检验反应后的溶液中是否存在 时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i.
时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i. 的化学性质与
的化学性质与 相似,CuSCN为白色固体;ii.
相似,CuSCN为白色固体;ii. ,写出该实验中出现白色沉淀的离子方程式为
,写出该实验中出现白色沉淀的离子方程式为________ 。
(2)实验II: 转化为
转化为
实验步骤及现象:向3mL 0.1mol/L 溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知
溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知 (棕色)
(棕色)
⑤使用的 溶液中存在少量铁屑,其目的是
溶液中存在少量铁屑,其目的是___________ 。
⑥实验中产生NO的原因为___________ (用离子方程式表示)。
(3)实验III: 与
与 互转化
互转化
实验步骤及现象:将 通入足量
通入足量 溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入
溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入 溶液,则会产生白色沉淀。将产生的白色沉淀经过滤、洗涤、干燥后称量其质量为6.99g,则整个实验中产生的气体(假设只生成一种气体,该气体遇空气变为红棕色)在标准状况下体积为
溶液,则会产生白色沉淀。将产生的白色沉淀经过滤、洗涤、干燥后称量其质量为6.99g,则整个实验中产生的气体(假设只生成一种气体,该气体遇空气变为红棕色)在标准状况下体积为___________ 。
 与
与 的转化,回答下列问题,
的转化,回答下列问题,(1)实验I:
 转化为
转化为
实验步骤及现象;甲组同学将少量铜粉加入1mL 0.1mol/L
 溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL 0.1mol/L
溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL 0.1mol/L  溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入1mL 0.05mol/L
溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入1mL 0.05mol/L  溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀,
溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀,①分别取三组实验反应后的溶液于三支试管中
 ;分析三组实验结果,实验中均发生的反应离子方程式为
;分析三组实验结果,实验中均发生的反应离子方程式为②对比三组实验,说明加入蒸馏水后沉淀的产生与
③向丙组实验后的溶液中加入饱和NaCl溶液可能出现的现象为
④丙组在检验反应后的溶液中是否存在
 时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i.
时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i. 的化学性质与
的化学性质与 相似,CuSCN为白色固体;ii.
相似,CuSCN为白色固体;ii. ,写出该实验中出现白色沉淀的离子方程式为
,写出该实验中出现白色沉淀的离子方程式为(2)实验II:
 转化为
转化为
实验步骤及现象:向3mL 0.1mol/L
 溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知
溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知 (棕色)
(棕色)⑤使用的
 溶液中存在少量铁屑,其目的是
溶液中存在少量铁屑,其目的是⑥实验中产生NO的原因为
(3)实验III:
 与
与 互转化
互转化实验步骤及现象:将
 通入足量
通入足量 溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入
溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入 溶液,则会产生白色沉淀。将产生的白色沉淀经过滤、洗涤、干燥后称量其质量为6.99g,则整个实验中产生的气体(假设只生成一种气体,该气体遇空气变为红棕色)在标准状况下体积为
溶液,则会产生白色沉淀。将产生的白色沉淀经过滤、洗涤、干燥后称量其质量为6.99g,则整个实验中产生的气体(假设只生成一种气体,该气体遇空气变为红棕色)在标准状况下体积为
您最近一年使用:0次
2021-10-17更新
|
355次组卷
|
2卷引用:江西省抚州市临川区第十中学2022届高三月考化学试卷



