名校
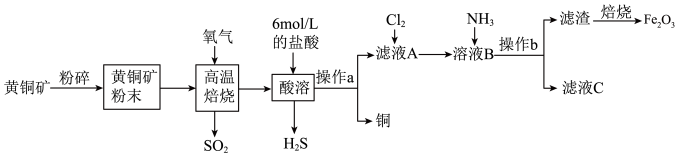
1 . Cu和Fe2O3在工农业生产中用途广泛,用黄铜矿(主要成分为CuFeS2,其中Cu为+2价,Fe为+2价)制取Cu和Fe2O3的工艺流程如图所示:__________ 。
(2)CuFeS2中S元素的化合价是______ ,高温焙烧时生成FeS及另外两种产物,则发生的化学反应方程式为____________ 。
(3)操作a为____________ 。
(4)向滤液A中通入Cl2的目的是__________ 。
(5)向溶液B中通入NH3发生反应的离子方程式为___________ 。
(6)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
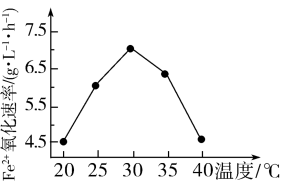
由下图可知,使用硫杆菌的最佳温度为______ ℃,若反应温度过高,反应速率下降,其原因是_______________ 。
(2)CuFeS2中S元素的化合价是
(3)操作a为
(4)向滤液A中通入Cl2的目的是
(5)向溶液B中通入NH3发生反应的离子方程式为
(6)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4
 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O由下图可知,使用硫杆菌的最佳温度为
您最近一年使用:0次
解题方法
2 . 铜及其化合物在工业生产中有着广泛的用途。
(1)某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu(NO3)2的部分工艺流程如图所示:
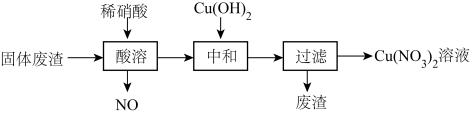
①分别写出CuO、Cu2O与稀硝酸反应的离子方程式为___________ 、___________ 。
②酸溶时,反应温度不宜超过70℃,其主要原因是___________ 。
③过滤后所得废渣的主要成分的化学式为___________ 。
④Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,该反应的化学方程式为___________ ,由Cu(NO3)2溶液制Cu(NO3)2晶体的操作方法是:蒸发浓缩、___________ 、过滤、冰水洗涤、___________ 。
(2)印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时用 溶液作为“腐蚀液”,得到反应后的溶液A。
溶液作为“腐蚀液”,得到反应后的溶液A。
①为了回收利用使用过的腐蚀液,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是___________ (请将答案填涂在答题卷相应位置)。
A.氯气B.铁C.双氧水D.稀硫酸
写出其中上述一种试剂将 转化为
转化为 的离子方程式:
的离子方程式:___________ 。
②为了回收金属铜和得到较纯净的 溶液,请补充完整下列实验步骤:在溶液A中加入过量的铁粉,过滤,得到滤渣B和滤液C,将滤渣B
溶液,请补充完整下列实验步骤:在溶液A中加入过量的铁粉,过滤,得到滤渣B和滤液C,将滤渣B___________ ,得到金属铜;将处理滤渣B时得到的滤液和滤液C合并,得到 溶液。
溶液。
(1)某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu(NO3)2的部分工艺流程如图所示:

①分别写出CuO、Cu2O与稀硝酸反应的离子方程式为
②酸溶时,反应温度不宜超过70℃,其主要原因是
③过滤后所得废渣的主要成分的化学式为
④Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,该反应的化学方程式为
(2)印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时用
 溶液作为“腐蚀液”,得到反应后的溶液A。
溶液作为“腐蚀液”,得到反应后的溶液A。①为了回收利用使用过的腐蚀液,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是
A.氯气B.铁C.双氧水D.稀硫酸
写出其中上述一种试剂将
 转化为
转化为 的离子方程式:
的离子方程式:②为了回收金属铜和得到较纯净的
 溶液,请补充完整下列实验步骤:在溶液A中加入过量的铁粉,过滤,得到滤渣B和滤液C,将滤渣B
溶液,请补充完整下列实验步骤:在溶液A中加入过量的铁粉,过滤,得到滤渣B和滤液C,将滤渣B 溶液。
溶液。
您最近一年使用:0次
解题方法
3 . 草酸钴用途广泛,可用于指示剂和催化剂的制备。用含钴废料(主要成分为 ,还含有一定量的
,还含有一定量的 、
、 、
、 、
、 、
、 等)制备草酸钴晶体
等)制备草酸钴晶体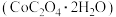 的工业流程如下图所示。请回答下列问题:
的工业流程如下图所示。请回答下列问题:

已知:①草酸钴晶体难溶于水
②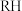 为有机物(难电离)
为有机物(难电离)
③相关金属离子 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:
(1)滤渣Ⅰ的成分_______ 。
(2) 是一种绿色氧化剂,写出加入
是一种绿色氧化剂,写出加入 后溶液中发生的主要反应的离子方程式
后溶液中发生的主要反应的离子方程式______ 。
(3)加入氧化钴调节浸出液的 的范围是
的范围是______ 。
(4)加入有机溶剂的目的是______ 。
(5)若仅从沉淀转化角度考虑,能否利用反应 将
将 转化为
转化为
____ (填“能”或“不能”),说明理由:______ 。【已知 ,
,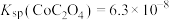 】
】
(6)为测定制得的草酸钴晶体样品的纯度,现称取样品 ,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液
,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液 。移取
。移取 该溶液加入过量的稀硫酸酸化,用
该溶液加入过量的稀硫酸酸化,用 高锰酸钾溶液滴定,当溶液由
高锰酸钾溶液滴定,当溶液由__________ (填颜色变化),消耗高锰酸钾溶液 ,计算草酸钴晶体样品的纯度为
,计算草酸钴晶体样品的纯度为__________  。(用含
。(用含 、
、 、
、 的代数式表示)(已知
的代数式表示)(已知 的摩尔质量为
的摩尔质量为 )
)
 ,还含有一定量的
,还含有一定量的 、
、 、
、 、
、 、
、 等)制备草酸钴晶体
等)制备草酸钴晶体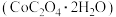 的工业流程如下图所示。请回答下列问题:
的工业流程如下图所示。请回答下列问题:
已知:①草酸钴晶体难溶于水
②
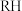 为有机物(难电离)
为有机物(难电离)③相关金属离子
 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:| 金属离子 |  |  |  |  |
开始沉淀的 | 7.5 | 2.7 | 3.4 | 6.9 |
沉淀完全的 | 9.0 | 3.7 | 4.7 | 8.9 |
(1)滤渣Ⅰ的成分
(2)
 是一种绿色氧化剂,写出加入
是一种绿色氧化剂,写出加入 后溶液中发生的主要反应的离子方程式
后溶液中发生的主要反应的离子方程式(3)加入氧化钴调节浸出液的
 的范围是
的范围是(4)加入有机溶剂的目的是
(5)若仅从沉淀转化角度考虑,能否利用反应
 将
将 转化为
转化为
 ,
,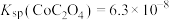 】
】(6)为测定制得的草酸钴晶体样品的纯度,现称取样品
 ,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液
,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液 。移取
。移取 该溶液加入过量的稀硫酸酸化,用
该溶液加入过量的稀硫酸酸化,用 高锰酸钾溶液滴定,当溶液由
高锰酸钾溶液滴定,当溶液由 ,计算草酸钴晶体样品的纯度为
,计算草酸钴晶体样品的纯度为 。(用含
。(用含 、
、 、
、 的代数式表示)(已知
的代数式表示)(已知 的摩尔质量为
的摩尔质量为 )
)
您最近一年使用:0次
4 . 某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(一) 探究FeSO4溶液的酸碱性:
(1)取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和_____________ 。
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性

(2)II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是_____________ 。
A.Fe2O3、SO3、H2O
B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
(3)III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是_______ 。
(4)NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式:_________ 。
(三)探究FeSO4中Fe2+还原性:
(5)证明FeSO4有较强的还原性,完成下表。
(四)硫酸亚铁用途探究
(6)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是__________________ 。
(一) 探究FeSO4溶液的酸碱性:
(1)取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性

(2)II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是
A.Fe2O3、SO3、H2O
B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
(3)III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是
(4)NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式:
(三)探究FeSO4中Fe2+还原性:
(5)证明FeSO4有较强的还原性,完成下表。
实验步骤 | 实验预期现象及结论 |
| 步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 | |
| 步骤二: |
(四)硫酸亚铁用途探究
(6)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是
您最近一年使用:0次
解题方法
5 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加 溶液,溶液颜色无明显变化。再向试管中通入空气,产生的现象是
溶液,溶液颜色无明显变化。再向试管中通入空气,产生的现象是______ 。
(2)为测定绿矾中结晶水含量,将带有两端开关K1和K2的石英玻璃管(设为装置A)称重,记为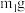 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为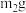 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。
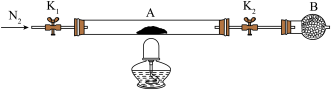
①仪器B的名称是________________ 。
②实验操作步骤:a.打开K1和K2,缓缓通入N2→b.点燃酒精灯,加热→c.熄灭酒精灯→d.→e.关闭 和
和 →f.称量A。d的操作为
→f.称量A。d的操作为________________ 。
③重复②的操作步骤,直至A恒重,记为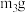 ,根据实验记录,计算绿矾化学式中结晶水数目
,根据实验记录,计算绿矾化学式中结晶水数目
________________ (列式表示)。若实验时将a、b的操作次序颠倒,则使x________ (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
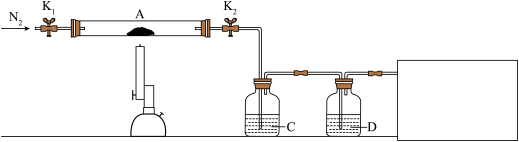
已知:装置C用于检验和吸收分解得到的气体产物之一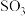 .
.
①C/D中的溶液依次为________ (填标号)。
a、品红 b. c.
c. d.
d. e.浓
e.浓
C、D中有气泡冒出,并可观察到的现象分别为________ 、________ 。
②写出硫酸亚铁高温分解反应的化学方程式:________________________ 。
③在方框中画出尾气吸收装置并注明所用试剂。_________
(1)在试管中加入少量绿矾样品,加水溶解,滴加
 溶液,溶液颜色无明显变化。再向试管中通入空气,产生的现象是
溶液,溶液颜色无明显变化。再向试管中通入空气,产生的现象是(2)为测定绿矾中结晶水含量,将带有两端开关K1和K2的石英玻璃管(设为装置A)称重,记为
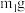 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为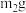 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。
①仪器B的名称是
②实验操作步骤:a.打开K1和K2,缓缓通入N2→b.点燃酒精灯,加热→c.熄灭酒精灯→d.→e.关闭
 和
和 →f.称量A。d的操作为
→f.称量A。d的操作为③重复②的操作步骤,直至A恒重,记为
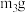 ,根据实验记录,计算绿矾化学式中结晶水数目
,根据实验记录,计算绿矾化学式中结晶水数目
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

已知:装置C用于检验和吸收分解得到的气体产物之一
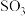 .
.①C/D中的溶液依次为
a、品红 b.
 c.
c. d.
d. e.浓
e.浓
C、D中有气泡冒出,并可观察到的现象分别为
②写出硫酸亚铁高温分解反应的化学方程式:
③在方框中画出尾气吸收装置并注明所用试剂。
您最近一年使用:0次
6 . 氯及其化合物有广泛用途。
(1)二氧化氯是一种新型的消毒剂。
①NaClO2中Cl元素的化合价为____________ 。
②实验室用氯酸钾与浓盐酸反应制备ClO2,产物除ClO2外,还有Cl2,KCl等,写出该反应的化学方程式__________ 。若生成11.2L氯气(标准状况),转移电子数为_________ 。
③ClO2和Cl2在消毒时自身均被还原为Cl-,则常温常压下,等体积的ClO2的消毒能力是Cl2的____ 倍。
④自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1﹣0.8 mg•L-1之间。碘量法可以检测水中ClO2的浓度(不同pH环境中粒子种类如图所示),步骤如下:
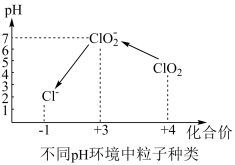
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2═S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1﹣3。
请问答:
若水样的体积为1.0L,在操作II时消耗了1.0×10-3mol•L-1的Na2S2O3溶液10mL.则水样中ClO2的浓度是_____ mg•L-1。
(2)ICl,ICl3的化学性质与卤素相似,被称为卤素互化物。三氯化碘(ICl3,其中Cl为-1价)常以二聚体的I2Cl6形式存在,经电导仪测定知,它能发生部分电离,生成的两种离子的摩尔质量分别为198 g/mol和269 g/mol,则其电离方程式为_______________ 。
(3)向盛有一定量的溴化亚铁溶液和四氯化碳溶液的试管中持续通入氯气,反应完毕后,振荡、静置、分层,发现有机层呈红棕色,经检验生成了BrCl(其中Cl为-1价)。可能发生如下反应:
①2Br-+Cl2=2Cl-+Br2②Br2+Cl2=2BrCl ③2Fe2++Cl2=2Fe3++2Cl-
按通入氯气,发生先后反应的顺序为____________ (填序号)。
(1)二氧化氯是一种新型的消毒剂。
①NaClO2中Cl元素的化合价为
②实验室用氯酸钾与浓盐酸反应制备ClO2,产物除ClO2外,还有Cl2,KCl等,写出该反应的化学方程式
③ClO2和Cl2在消毒时自身均被还原为Cl-,则常温常压下,等体积的ClO2的消毒能力是Cl2的
④自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1﹣0.8 mg•L-1之间。碘量法可以检测水中ClO2的浓度(不同pH环境中粒子种类如图所示),步骤如下:

Ⅰ.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2═S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1﹣3。
请问答:
若水样的体积为1.0L,在操作II时消耗了1.0×10-3mol•L-1的Na2S2O3溶液10mL.则水样中ClO2的浓度是
(2)ICl,ICl3的化学性质与卤素相似,被称为卤素互化物。三氯化碘(ICl3,其中Cl为-1价)常以二聚体的I2Cl6形式存在,经电导仪测定知,它能发生部分电离,生成的两种离子的摩尔质量分别为198 g/mol和269 g/mol,则其电离方程式为
(3)向盛有一定量的溴化亚铁溶液和四氯化碳溶液的试管中持续通入氯气,反应完毕后,振荡、静置、分层,发现有机层呈红棕色,经检验生成了BrCl(其中Cl为-1价)。可能发生如下反应:
①2Br-+Cl2=2Cl-+Br2②Br2+Cl2=2BrCl ③2Fe2++Cl2=2Fe3++2Cl-
按通入氯气,发生先后反应的顺序为
您最近一年使用:0次
2017-12-16更新
|
275次组卷
|
3卷引用:黑龙江省大庆铁人中学2017-2018学年高一上学期12月月考化学试题
解题方法
7 . 硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)工业制硫酸铜的方法很多。
① 方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是________ ,此法的最大缺点是__________ 。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:

稀硫酸、铜和氧化铁反应的化学方程式是_________________ ;向混合溶液中通入热空气的反应的离子方程式是___________________ ;由滤液得到无水硫酸铜的实验操作是______________ 。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:

①吸收塔中发生反应的化学方程式是_______________________ 。
② 有数据表明,吸收塔中溶液的pH在5.5~6.0之间,生产效率较高。当控制一定流量的尾气时,调节溶液的pH的方法是________________ 。
(1)工业制硫酸铜的方法很多。
① 方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:

稀硫酸、铜和氧化铁反应的化学方程式是
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:

①吸收塔中发生反应的化学方程式是
② 有数据表明,吸收塔中溶液的pH在5.5~6.0之间,生产效率较高。当控制一定流量的尾气时,调节溶液的pH的方法是
您最近一年使用:0次
2016-04-12更新
|
404次组卷
|
2卷引用:2015-2016学年四川省成都市龙泉一中高二下入学考试化学试卷



