名校
解题方法
1 . 碳酸亚铁( )是一种重要的工业盐,是制备医用补铁剂的原料。常温下它是一种白色、难溶于水的晶体。在干燥的环境中性质稳定,在潮湿的空气中,易被
)是一种重要的工业盐,是制备医用补铁剂的原料。常温下它是一种白色、难溶于水的晶体。在干燥的环境中性质稳定,在潮湿的空气中,易被 氧化,长期放置后最终转化为
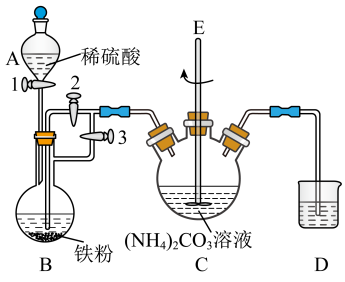
氧化,长期放置后最终转化为 。实验小组通过查阅文献资料设计用下图装置制备少量
。实验小组通过查阅文献资料设计用下图装置制备少量 。
。
①连接装置检查气密性后,先将开关2关闭,然后依次打开开关3和1,将A中稀硫酸滴入B中。
②反应一段时间后,当D中气泡均匀冒出,关闭开关3,打开开关2.使装置B中的溶液进入装置C。
③当装置B中溶液不再进入C后,关闭开关1。
④充分反应后将装置C中生成的固体经过滤、洗涤、干燥。
回答下列问题:
(1)装置B中产生的气体是___________ (化学式),反应开始时持续通入该气体的目的是___________ 。
(2)装置D的作用___________ 。(选择:A.吸收尾气 B.防止空气进入装置影响产物)
(3)步骤④中证明固体洗涤干净的实验方案是___________ 。
II.因存放时间较长,装置密封性缺失导致 发生了变质,某同学设计如下方案对样品的质量百分含量进行测定:
发生了变质,某同学设计如下方案对样品的质量百分含量进行测定:
准确称取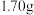 样品,用适量的稀硫酸使其完全溶解配成
样品,用适量的稀硫酸使其完全溶解配成 溶液。量取
溶液。量取 溶液于锥形瓶中,滴加适量磷酸,用
溶液于锥形瓶中,滴加适量磷酸,用 的
的 标准溶液滴定至终点,(离子方程式为:
标准溶液滴定至终点,(离子方程式为: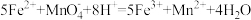 )消耗
)消耗 标准溶液
标准溶液 (重复实验2~3次)。
(重复实验2~3次)。
(4)计算样品中 的质量百分含量为
的质量百分含量为___________ %。(写出必要的计算过程,结果保留到小点数后一位)
 )是一种重要的工业盐,是制备医用补铁剂的原料。常温下它是一种白色、难溶于水的晶体。在干燥的环境中性质稳定,在潮湿的空气中,易被
)是一种重要的工业盐,是制备医用补铁剂的原料。常温下它是一种白色、难溶于水的晶体。在干燥的环境中性质稳定,在潮湿的空气中,易被 氧化,长期放置后最终转化为
氧化,长期放置后最终转化为 。实验小组通过查阅文献资料设计用下图装置制备少量
。实验小组通过查阅文献资料设计用下图装置制备少量 。
。
①连接装置检查气密性后,先将开关2关闭,然后依次打开开关3和1,将A中稀硫酸滴入B中。
②反应一段时间后,当D中气泡均匀冒出,关闭开关3,打开开关2.使装置B中的溶液进入装置C。
③当装置B中溶液不再进入C后,关闭开关1。
④充分反应后将装置C中生成的固体经过滤、洗涤、干燥。
回答下列问题:
(1)装置B中产生的气体是
(2)装置D的作用
(3)步骤④中证明固体洗涤干净的实验方案是
II.因存放时间较长,装置密封性缺失导致
 发生了变质,某同学设计如下方案对样品的质量百分含量进行测定:
发生了变质,某同学设计如下方案对样品的质量百分含量进行测定:准确称取
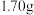 样品,用适量的稀硫酸使其完全溶解配成
样品,用适量的稀硫酸使其完全溶解配成 溶液。量取
溶液。量取 溶液于锥形瓶中,滴加适量磷酸,用
溶液于锥形瓶中,滴加适量磷酸,用 的
的 标准溶液滴定至终点,(离子方程式为:
标准溶液滴定至终点,(离子方程式为: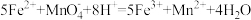 )消耗
)消耗 标准溶液
标准溶液 (重复实验2~3次)。
(重复实验2~3次)。(4)计算样品中
 的质量百分含量为
的质量百分含量为
您最近一年使用:0次
名校
2 . 下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究浓硫酸的吸水性 | 向表面皿中加入少量 ,再加入约3mL浓硫酸,搅拌,观察实验现象 ,再加入约3mL浓硫酸,搅拌,观察实验现象 |
B | 比较浓硝酸和浓盐酸的氧化性强弱 | 室温下,在浓硝酸和浓盐酸中分别投入光亮的铁钉 |
C | 探究浓硫酸与木炭反应的气体产物中是否含有 | 将浓硫酸与木炭混合加热生成的气体通入足量澄清石灰水中,观察是否有白色沉淀产生 |
D | 检验 | 将 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-11更新
|
501次组卷
|
2卷引用:陕西省咸阳市实验中学2023-2024学年高一下学期第一次月考化学试题
名校
3 . 下列方案设计、现象和结论均正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 证明 与 与 在光照条件下发生的是取代反应 在光照条件下发生的是取代反应 | 通过排饱和NaCl溶液的方法收集半试管 和半试管 和半试管 ,固定好后,放在光亮处,静置,反应结束后用手堵住试管口取出试管,向其中加硝酸银溶液 ,固定好后,放在光亮处,静置,反应结束后用手堵住试管口取出试管,向其中加硝酸银溶液 | 若出现白色沉淀,说明有 生成,发生的是取代反应 生成,发生的是取代反应 |
| B | 探究 固体样品是否变质 固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀硝酸,再加入足量 溶液 溶液 | 若有白色沉淀产生,则样品已经变质 |
| C | 检验某无色气体是否为 | 将气体通入品红溶液中,再加热 | 若通入气体后品红溶液褪色,加热该褪色溶液能恢复红色,则一定为 |
| D | 探究铁与水蒸气发生反应后的产物中铁元素的价态 | 取少量固体产物溶于足量稀硫酸后,再取上层清液,依次入KSCN溶液和双氧水 | 若上层清液开始无明显现象,加双氧水后出现红色溶液,则说明产物中含+2价的铁 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-20更新
|
257次组卷
|
2卷引用:浙江省杭州市及周边重点中学2022-2023学年高一下学期期中考试化学试题
名校
4 . 铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
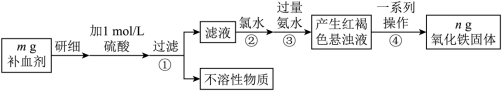
(1)实验中配制480 mL 1 mol/L的硫酸溶液,量取18.4 mol/L的浓硫酸_____ mL。
(2)步骤②加入过量氯水后发生反应的离子方程式为_______ 。
(3)步骤④中一系列操作步骤为______ 、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为_______ 。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol/L的硫酸溶液,过滤。取滤液加________ 溶液(填写化学式),溶液变红说明该补血剂已部分变质。
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是___________。

(1)实验中配制480 mL 1 mol/L的硫酸溶液,量取18.4 mol/L的浓硫酸
(2)步骤②加入过量氯水后发生反应的离子方程式为
(3)步骤④中一系列操作步骤为
(4)若实验无损耗,则该补血剂含铁元素的质量分数为
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol/L的硫酸溶液,过滤。取滤液加
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是___________。
| A.氯水 | B.酸性KMnO4溶液 | C.铁粉 | D.FeCl3溶液 |
您最近一年使用:0次
解题方法
5 . 下列关于铁及其化合物的说法正确的是
| A.检验 FeCl2溶液中的Fe2+,可将酸性KMnO4溶液滴加到该溶液中,若酸性KMnO4溶液褪色,证明含有Fe2+ |
| B.Fe3O4中铁的化合价有+2和+3价,是一种混合物 |
| C.为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,应取少量样品溶于盐酸,滴加KSCN溶液,若溶液未变红,说明铁粉未变质 |
| D. FeCl3溶液腐蚀铜板的离子方程式为2Fe3++Cu=2Fe2++Cu2+ |
您最近一年使用:0次
名校
6 . 下列关于物质的除杂、鉴别、检验的方法中错误的是
A.除去 溶液中 溶液中 的方法是往溶液中缓缓通入氧气 的方法是往溶液中缓缓通入氧气 |
B. 与溴蒸气的鉴别可以用水、 与溴蒸气的鉴别可以用水、 溶液或 溶液或 ,但不能用湿润的碘化钾淀粉试纸 ,但不能用湿润的碘化钾淀粉试纸 |
C.检验 是否变质,可取少量样品溶解并滴加 是否变质,可取少量样品溶解并滴加 溶液,观察溶液是否褪色 溶液,观察溶液是否褪色 |
D.检验 溶液是否变质,可取少量样品于试管中并滴加KSCN,观察溶液是否变红 溶液是否变质,可取少量样品于试管中并滴加KSCN,观察溶液是否变红 |
您最近一年使用:0次
解题方法
7 . 下列实验操作和现象及所得到的结论均正确的是
实验操作和现象 | 结论 | |
| A | 取某无色溶液做焰色试验观察到焰色为黄色 | 该溶液只含 ,无 ,无 |
| B | 向某物质的水溶液中加入盐酸能产生无色无味气体 | 该溶液中一定含有 |
| C | 取少量高锰酸钾溶液于试管中,加入氯化亚铁样品,高锰酸钾溶液褪色 | 该样品一定未变质 |
| D | 向淀粉碘化钾溶液中滴加氯水后溶液变蓝 | Cl的非金属性强于I |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . 某品牌补血剂,主要成分是硫酸亚铁晶体( ),不含其它铁的化合物。
),不含其它铁的化合物。
某研究性学习小组为测定该补血剂中铁元素的含量,并检验其是否变质,进行了如下探究。
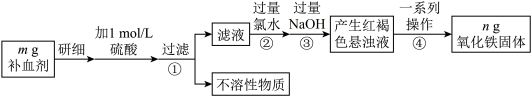
回答下列问题:
(1)实验中用浓硫酸配制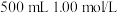 的硫酸溶液,配制时用到的玻璃仪器除量筒、烧杯、
的硫酸溶液,配制时用到的玻璃仪器除量筒、烧杯、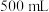 容量瓶外,还需要
容量瓶外,还需要___________ 。
(2)步骤②加入过量氯水发生反应的离子方程式为___________ 。
(3)步骤④中一系列操作为___________ 、洗涤、灼烧、___________ 、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为___________ (用含m、n的式子表示)。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于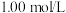 的硫酸溶液,过滤。
的硫酸溶液,过滤。
①取少量滤液滴加___________ (填化学式)溶液,溶液变红说明该补血剂已部分变质。
②检验滤液中是否含有 应选用的试剂是
应选用的试剂是___________ (填标号)。
a.酸性 溶液 b.铁粉 c.
溶液 b.铁粉 c. 溶液 d.硫酸溶液
溶液 d.硫酸溶液
(6)缺铁性贫血患者应补充 ,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的主要作用是
,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的主要作用是___________ 。
 ),不含其它铁的化合物。
),不含其它铁的化合物。某研究性学习小组为测定该补血剂中铁元素的含量,并检验其是否变质,进行了如下探究。

回答下列问题:
(1)实验中用浓硫酸配制
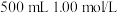 的硫酸溶液,配制时用到的玻璃仪器除量筒、烧杯、
的硫酸溶液,配制时用到的玻璃仪器除量筒、烧杯、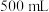 容量瓶外,还需要
容量瓶外,还需要(2)步骤②加入过量氯水发生反应的离子方程式为
(3)步骤④中一系列操作为
(4)若实验无损耗,则该补血剂含铁元素的质量分数为
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于
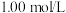 的硫酸溶液,过滤。
的硫酸溶液,过滤。①取少量滤液滴加
②检验滤液中是否含有
 应选用的试剂是
应选用的试剂是a.酸性
 溶液 b.铁粉 c.
溶液 b.铁粉 c. 溶液 d.硫酸溶液
溶液 d.硫酸溶液(6)缺铁性贫血患者应补充
 ,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的主要作用是
,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的主要作用是
您最近一年使用:0次
9 . 为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其中说法正确的是
| A.若滴加KSCN溶液,溶液变红,说明铁粉变质 |
| B.若滴加KSCN溶液,溶液未变红,说明铁粉未变质 |
| C.若依次滴加氯水、KSCN溶液,溶液变红,说明铁粉全部变质 |
| D.若溶于盐酸未观察到有气泡且滴加KSCN溶液后溶液未变红,说明铁粉未变质 |
您最近一年使用:0次
10 . 以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO4·7H2O)的工艺流程如下:

(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式为_______ 。
(2)滤液中金属阳离子的检验方法_______ 。
(3)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.F)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如下图所示:
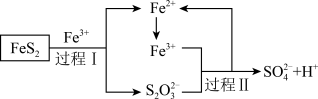
过程Ⅱ反应的离子方程式为_______ 。
(4)FeSO4可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(Na2FeO4),其氧化性比Cl2、O2、ClO2、KMnO4更强,工业上有多种制备高铁酸钠方法。
①干法制备:主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。该反应中的氧化剂是_______ ,还原剂是_______ 。
②湿法制备:在碱性条件下,用NaClO溶液和Fe2(SO4)3溶液反应制备。该反应的离子方程式为_______ 。
③在Na2FeO4溶液中加入稀硫酸,溶液很快变为棕黄色,并有无色气体产生。该反应的离子方程式为_______ 。
(5)绿矾晶体在空气中易被氧化变质。取x g样品,加水完全溶解,滴加硫酸酸化的a mol/L K2Cr2O7溶液至恰好完全反应,消耗K2Cr2O7溶液b mL。
反应原理:6Fe2++Cr2O +14H+ = 6Fe3++2Cr3++7H2O。
+14H+ = 6Fe3++2Cr3++7H2O。
则绿矾晶体纯度的计算式为_______ 。

(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式为
(2)滤液中金属阳离子的检验方法
(3)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.F)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如下图所示:

过程Ⅱ反应的离子方程式为
(4)FeSO4可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(Na2FeO4),其氧化性比Cl2、O2、ClO2、KMnO4更强,工业上有多种制备高铁酸钠方法。
①干法制备:主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。该反应中的氧化剂是
②湿法制备:在碱性条件下,用NaClO溶液和Fe2(SO4)3溶液反应制备。该反应的离子方程式为
③在Na2FeO4溶液中加入稀硫酸,溶液很快变为棕黄色,并有无色气体产生。该反应的离子方程式为
(5)绿矾晶体在空气中易被氧化变质。取x g样品,加水完全溶解,滴加硫酸酸化的a mol/L K2Cr2O7溶液至恰好完全反应,消耗K2Cr2O7溶液b mL。
反应原理:6Fe2++Cr2O
 +14H+ = 6Fe3++2Cr3++7H2O。
+14H+ = 6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
您最近一年使用:0次

 固体是否氧化变质
固体是否氧化变质

