21-22高一·全国·假期作业
解题方法
1 . 某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性。请完成对铁元素价态的探究:
(1)①提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:催化剂中铁元素为+2价;
假设3:_______ 。
②设计实验方案。
③根据②的实验方案进行实验:
(2)步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是_______ ;步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
(3)步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设_______ 成立;若出现血红色,则假设_______ 成立;
(4)步骤4:另取A溶液于试管,加入KMnO4溶液,振荡,结合步骤3中的结论,若出现_______ 现象,则假设1成立;反之,则假设3成立。
(1)①提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:催化剂中铁元素为+2价;
假设3:
②设计实验方案。
③根据②的实验方案进行实验:
(2)步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是
(3)步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设
(4)步骤4:另取A溶液于试管,加入KMnO4溶液,振荡,结合步骤3中的结论,若出现
您最近一年使用:0次
名校
解题方法
2 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
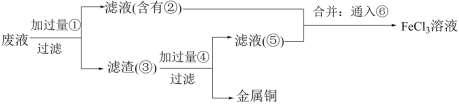
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
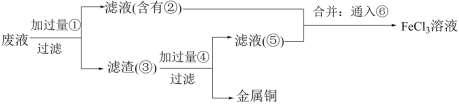
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
408次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市第一中学2021--2022学年高一上学期期末考试化学试题
名校
3 . 苹果汁是人们喜爱的饮料。现榨苹果汁露置在空气中,其中的 会转变为
会转变为 离子,使其由淡绿色变为棕黄色。若榨苹果汁时加入维生素C,可有效防止此现象的发生。这说明维生素C具有
离子,使其由淡绿色变为棕黄色。若榨苹果汁时加入维生素C,可有效防止此现象的发生。这说明维生素C具有
 会转变为
会转变为 离子,使其由淡绿色变为棕黄色。若榨苹果汁时加入维生素C,可有效防止此现象的发生。这说明维生素C具有
离子,使其由淡绿色变为棕黄色。若榨苹果汁时加入维生素C,可有效防止此现象的发生。这说明维生素C具有| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
您最近一年使用:0次
4 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视⻆。铁元素的“价-类”二维图如图所示:

(1)C的化学式是___________ ,E→F反应的化学方程式是___________ ,反应过程的现象为___________ 。
(2)A在一定条件下可以和水蒸气发生反应,反应方程式是___________ 。
(3)维生素C可将H转化为G,维生素C具有___________ (填“酸性”、“氧化性”或“还原性”)。
(4)在指定条件下,下列铁及其化合物之间的转化不能实现的是___________ 。
A.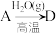 B.
B.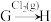 C.
C.
(5)某小组同学设计如下实验,研究亚铁盐与 溶液的反应。
溶液的反应。
试剂:酸化的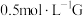 溶液,5%
溶液,5% 溶液
溶液
上述实验中 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是___________ 。

(1)C的化学式是
(2)A在一定条件下可以和水蒸气发生反应,反应方程式是
(3)维生素C可将H转化为G,维生素C具有
(4)在指定条件下,下列铁及其化合物之间的转化不能实现的是
A.
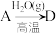 B.
B.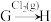 C.
C.
(5)某小组同学设计如下实验,研究亚铁盐与
 溶液的反应。
溶液的反应。试剂:酸化的
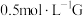 溶液,5%
溶液,5% 溶液
溶液| 操作 | 现象 |
取 酸化的G溶液于试管中,加入 酸化的G溶液于试管中,加入 5% 5% 溶液 溶液 | 溶液立即变为棕黄色,稍后,产生气泡。 |
向反应后的溶液中加入 溶液 溶液 | 溶液变红 |
 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是
您最近一年使用:0次
解题方法
5 . 黑木耳是常见食品,可以补充入体所必需的微量元素铁,某兴趣小组设计实验,检验黑木耳中的铁元素,实验流程如图;
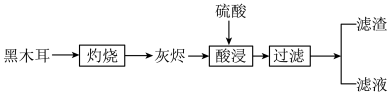
(1)灼烧黑木耳必须用到下列仪器中的___________(填字母)。
(2)灰烬中含有铁的氧化物以及钾、钙、硅等元素的化合物,酸浸的目的是___________ 。
(3)取少许滤液于试管中,滴入几滴KSCN溶液,显红色,说明滤液中含有___________ ;另取滤液检验,滤液能使KMnO4溶液紫色褪去,说明滤液中存在具有___________ (填“氧化性”或“还原性”)的粒子。
(4)为进一步探究 Fe3+和 Fe2+的氧化性和还原性,该兴趣小组设计并进行如下实验,记录现象,完成实验报告。
(5)由 和硫黄制取
和硫黄制取 的废水中含有一定量的
的废水中含有一定量的 ,Cr元素含量达标才能排放,可以加入
,Cr元素含量达标才能排放,可以加入 溶液去除酸性废水中的
溶液去除酸性废水中的 ,使
,使 转化为
转化为 而自身转化为三价铁,再放入沉淀池,达到指定标准后方可排放。上述过程
而自身转化为三价铁,再放入沉淀池,达到指定标准后方可排放。上述过程 溶液与
溶液与 发生的反应中氧化剂与还原剂的物质的量之比为
发生的反应中氧化剂与还原剂的物质的量之比为___________ 。
(6)某兴趣小组同学想根据上述反应原理测出某酸性废水中残留的 的物质的量浓度,采样后,经初步预算需要
的物质的量浓度,采样后,经初步预算需要 的
的 溶液240mL,配制该溶液时至少需称量
溶液240mL,配制该溶液时至少需称量___________ g 。下列操作会导致所配制的溶液物质的量浓度偏低的是
。下列操作会导致所配制的溶液物质的量浓度偏低的是___________ 。
A.配制前,容量瓶中有少量蒸馏水 B.定容时仰视容量瓶刻度线
C.向容量瓶转移溶液时有少量液体溅出 D.定容、摇匀后,发现液面低于刻度线
(7)往配制好的FeSO4溶液滴入少量的氢氧化钠溶液,出现的现象是___________ ,用化学方程式来解释该过程颜色变化的原因 ___________ 。

(1)灼烧黑木耳必须用到下列仪器中的___________(填字母)。
A. | B. | C. | D. |
(2)灰烬中含有铁的氧化物以及钾、钙、硅等元素的化合物,酸浸的目的是
(3)取少许滤液于试管中,滴入几滴KSCN溶液,显红色,说明滤液中含有
(4)为进一步探究 Fe3+和 Fe2+的氧化性和还原性,该兴趣小组设计并进行如下实验,记录现象,完成实验报告。
| 实验操作 | 实验现象 | 离子方程式 | 实验结论 |
| 向FeCl2溶液中添加新制氯水 | 溶液由浅绿色变为棕黄色 | ① | Fe2+具有还原性 |
| 向 FeCl3溶液加入足量的铁粉 | 铁粉逐渐溶解,溶液由棕黄色变为浅绿色 | Fe+2Fe3+=3Fe 2+ | ② |
(5)由
 和硫黄制取
和硫黄制取 的废水中含有一定量的
的废水中含有一定量的 ,Cr元素含量达标才能排放,可以加入
,Cr元素含量达标才能排放,可以加入 溶液去除酸性废水中的
溶液去除酸性废水中的 ,使
,使 转化为
转化为 而自身转化为三价铁,再放入沉淀池,达到指定标准后方可排放。上述过程
而自身转化为三价铁,再放入沉淀池,达到指定标准后方可排放。上述过程 溶液与
溶液与 发生的反应中氧化剂与还原剂的物质的量之比为
发生的反应中氧化剂与还原剂的物质的量之比为(6)某兴趣小组同学想根据上述反应原理测出某酸性废水中残留的
 的物质的量浓度,采样后,经初步预算需要
的物质的量浓度,采样后,经初步预算需要 的
的 溶液240mL,配制该溶液时至少需称量
溶液240mL,配制该溶液时至少需称量 。下列操作会导致所配制的溶液物质的量浓度偏低的是
。下列操作会导致所配制的溶液物质的量浓度偏低的是A.配制前,容量瓶中有少量蒸馏水 B.定容时仰视容量瓶刻度线
C.向容量瓶转移溶液时有少量液体溅出 D.定容、摇匀后,发现液面低于刻度线
(7)往配制好的FeSO4溶液滴入少量的氢氧化钠溶液,出现的现象是
您最近一年使用:0次
名校
解题方法
6 . 某兴趣小组利用下列试剂:铁粉、锌粉、0.1mol/L 溶液、0.1mol/L
溶液、0.1mol/L 溶液、KSCN溶液、新制氯水,探究
溶液、KSCN溶液、新制氯水,探究 、
、 的氧化性、还原性,并利用实验结论解决一些问题。
的氧化性、还原性,并利用实验结论解决一些问题。
(1)用所给试剂写出体现 具有还原性的反应的离子反应方程式:
具有还原性的反应的离子反应方程式:___________ 。
(2)设计实验方案,完成下列表格。
(3)该兴趣小组未说明“ 具有氧化性”,提出了向
具有氧化性”,提出了向 溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为
溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为___________ 。
(4)已知:酸性 可将
可将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ ,该反应中氧化产物是___________ (写离子符号)。
 溶液、0.1mol/L
溶液、0.1mol/L 溶液、KSCN溶液、新制氯水,探究
溶液、KSCN溶液、新制氯水,探究 、
、 的氧化性、还原性,并利用实验结论解决一些问题。
的氧化性、还原性,并利用实验结论解决一些问题。(1)用所给试剂写出体现
 具有还原性的反应的离子反应方程式:
具有还原性的反应的离子反应方程式:(2)设计实验方案,完成下列表格。
| 探究内容 | 实验方案 | 实验现象 |
探究 的化学性质 的化学性质 | 取少量0.1mol/L 溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液变成 |
结论: 具有 具有 | ||
 具有氧化性”,提出了向
具有氧化性”,提出了向 溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为
溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为(4)已知:酸性
 可将
可将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
7 . 实验探究 、
、 的性质。
的性质。
已知: 可与
可与 溶液反应生成蓝色沉淀。
溶液反应生成蓝色沉淀。
(1)分别取一定量硫酸铁、氯化亚铁固体,均配制成 溶液。配制
溶液。配制 溶液时需加入少量铁屑,目的是
溶液时需加入少量铁屑,目的是_______ 。
(2)甲组同学取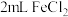 溶液,加入几滴氯水,再加入1滴
溶液,加入几滴氯水,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为_______ 。
(3)乙组同学认为甲组实验不够严谨,该组同学用煮沸冷却后的水配制溶液,向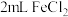 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴氯水和1滴
煤油,再于液面下依次加入几滴氯水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是_____ 。
(4)丙组同学取 溶液,加入足量
溶液,加入足量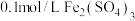 溶液混合后,滴加淀粉溶液,出现蓝色,该现象说明氧化性:
溶液混合后,滴加淀粉溶液,出现蓝色,该现象说明氧化性:
_______  (填“>”或“<”);另取
(填“>”或“<”);另取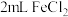 溶液,加入几小块锌片,实验现象为
溶液,加入几小块锌片,实验现象为_______ ,说明 具有
具有_______ 。(填“氧化性”或“还原性”)。
(5)丁组同学为探究维生素C是否可将 转化为
转化为 ,设计了如下实验。
,设计了如下实验。
其他组同学认为:根据该实验现象不能得出“维生素C可将 转化为
转化为 ”的结论,原因是
”的结论,原因是_______ ;认为可另外设计实验验证结论是否正确:取a溶液少许,滴加_______ ,若出现_______ ,则结论正确。
 、
、 的性质。
的性质。已知:
 可与
可与 溶液反应生成蓝色沉淀。
溶液反应生成蓝色沉淀。(1)分别取一定量硫酸铁、氯化亚铁固体,均配制成
 溶液。配制
溶液。配制 溶液时需加入少量铁屑,目的是
溶液时需加入少量铁屑,目的是(2)甲组同学取
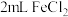 溶液,加入几滴氯水,再加入1滴
溶液,加入几滴氯水,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为(3)乙组同学认为甲组实验不够严谨,该组同学用煮沸冷却后的水配制溶液,向
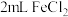 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴氯水和1滴
煤油,再于液面下依次加入几滴氯水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是(4)丙组同学取
 溶液,加入足量
溶液,加入足量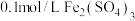 溶液混合后,滴加淀粉溶液,出现蓝色,该现象说明氧化性:
溶液混合后,滴加淀粉溶液,出现蓝色,该现象说明氧化性:
 (填“>”或“<”);另取
(填“>”或“<”);另取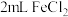 溶液,加入几小块锌片,实验现象为
溶液,加入几小块锌片,实验现象为 具有
具有(5)丁组同学为探究维生素C是否可将
 转化为
转化为 ,设计了如下实验。
,设计了如下实验。| 实验操作 | 实验现象 | 得出结论 |
取一定量 溶液于试管中,加入维生素C片,振荡溶解得到溶液a.取a溶液少许,滴加酸性 溶液于试管中,加入维生素C片,振荡溶解得到溶液a.取a溶液少许,滴加酸性 溶液。 溶液。 | 紫色褪去 | 维生素C可将 转化为 转化为 |
 转化为
转化为 ”的结论,原因是
”的结论,原因是
您最近一年使用:0次
2023-01-10更新
|
436次组卷
|
4卷引用:广东省广州市2022-2023学年高一上学期期末化学试题
13-14高一上·北京门头沟·期末
解题方法
8 . 回答下列关于铁元素及其化合物的知识:
(1) 向一支装有FeCl3溶液的试管中滴加NaOH溶液,现象为_____________ ,其中含铁元素的产物的化学式是________ ;
(2) 为了检验某未知溶液是否含有Fe2+离子,两位同学分别设计了以下实验方案加以证明. 方案一:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液含有Fe2+离子;
方案二:向另一支装有该未知溶液的试管中先滴加KSCN溶液,无现象,再通入氯气,溶液变为红色,证明该未知溶液含有Fe2+离子;
则请回答:①你认为哪个方案较为合理_______________ ;
②写出Fe2+与氯气反应的离子方程式_______________________ ;
③实验室在保存含有Fe2+离子的溶液时,为了防止Fe2+离子变质,经常向其中加入铁粉,其目的是__________
(3) 鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,鲜榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色的Fe3+,则这个变色的过程中Fe2+被________ ;若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生。这说明维生素C具有________ 。
A. 氧化性 B. 还原性 C. 酸性 D. 碱性.
(1) 向一支装有FeCl3溶液的试管中滴加NaOH溶液,现象为
(2) 为了检验某未知溶液是否含有Fe2+离子,两位同学分别设计了以下实验方案加以证明. 方案一:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液含有Fe2+离子;
方案二:向另一支装有该未知溶液的试管中先滴加KSCN溶液,无现象,再通入氯气,溶液变为红色,证明该未知溶液含有Fe2+离子;
则请回答:①你认为哪个方案较为合理
②写出Fe2+与氯气反应的离子方程式
③实验室在保存含有Fe2+离子的溶液时,为了防止Fe2+离子变质,经常向其中加入铁粉,其目的是
(3) 鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,鲜榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色的Fe3+,则这个变色的过程中Fe2+被
A. 氧化性 B. 还原性 C. 酸性 D. 碱性.
您最近一年使用:0次
9 . 铁是人体必需的微量元素,在肺部,血红蛋白中血红素的Fe2+与O2结合,把O2送到各个组织器官,铁摄入不足可能引起缺铁性贫血,黑木耳中含有比较丰富的铁元素。某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:i.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100克黑木耳含铁高达185毫克。
ii.紫色的 溶液在酸性条件下具有强氧化性,其还原产物是无色的
溶液在酸性条件下具有强氧化性,其还原产物是无色的 。
。
I.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。

(1)步骤④检验 所用试剂是
所用试剂是_______ (填名称)溶液。
(2)下列有关上述实验得出的结论是_______ (填字母符号)。
a.黑木耳中一定含Fe2+和Fe3+
b.滤液A中一定含Fe2+和Fe3+
c.蓝色沉淀中一定含
(3)完成酸浸后铁元素的分离、将滤液配制成100mL溶液这两个实验,下列仪器不必使用的是_______ 。

II.(铁元素含量测定) 研究小组提出如下测量方案:
(4)沉淀法:向溶液中加入足量NaOH溶液,搅拌使Fe(OH)2全部转化为Fe(OH)3然后过滤、洗涤沉淀、加热烘干、称量Fe(OH)3的质量进行分析。请指出该测量方案_______ (填“是或否”)可行,其理由是_______ 。
(5)比色法:流程示意如下:
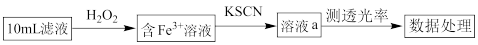
①用离子方程式解释加入H2O2的目的是_______ 。
②溶液颜色越深,光的透过能力越差,即透光率越小。若不加H2O2,测出黑木耳中铁元素的含量_______ (填“偏大”或“偏小”)。
③亚铁盐易被氧化,但在体内Fe2+参与O2的运输却不被氧化。蛋白质是一种既有亲水部分、又有疏水部分的大分子,为血红素提供了疏水环境。可见,氧化还原反应能否发生与_______ 有关。

已知:i.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。每100克黑木耳含铁高达185毫克。
ii.紫色的
 溶液在酸性条件下具有强氧化性,其还原产物是无色的
溶液在酸性条件下具有强氧化性,其还原产物是无色的 。
。I.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。

(1)步骤④检验
 所用试剂是
所用试剂是(2)下列有关上述实验得出的结论是
a.黑木耳中一定含Fe2+和Fe3+
b.滤液A中一定含Fe2+和Fe3+
c.蓝色沉淀中一定含

(3)完成酸浸后铁元素的分离、将滤液配制成100mL溶液这两个实验,下列仪器不必使用的是

II.(铁元素含量测定) 研究小组提出如下测量方案:
(4)沉淀法:向溶液中加入足量NaOH溶液,搅拌使Fe(OH)2全部转化为Fe(OH)3然后过滤、洗涤沉淀、加热烘干、称量Fe(OH)3的质量进行分析。请指出该测量方案
(5)比色法:流程示意如下:
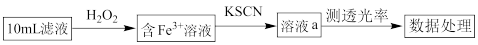
①用离子方程式解释加入H2O2的目的是
②溶液颜色越深,光的透过能力越差,即透光率越小。若不加H2O2,测出黑木耳中铁元素的含量
③亚铁盐易被氧化,但在体内Fe2+参与O2的运输却不被氧化。蛋白质是一种既有亲水部分、又有疏水部分的大分子,为血红素提供了疏水环境。可见,氧化还原反应能否发生与

您最近一年使用:0次
2022-11-02更新
|
260次组卷
|
2卷引用:广东省化州市第一中学2020-2021学年高一上学期期末考试化学试题
10 . 某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
(1)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________ ;该反应中氧化剂是_____ ;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______ 。(用NA表示)
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______ (填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性: 维生素C > Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________ 。
| 药品 | NaNO2 (亚硝酸钠) |
| 性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是
A.NaNO2被还原 B.维生素C具有还原性
C.还原性: 维生素C > Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:
您最近一年使用:0次
2018-01-31更新
|
533次组卷
|
6卷引用:四川省成都市2017-2018学年高一上期期末调研考试化学试题



