名校
解题方法
1 . FeSO4溶液放置在空气中容易变质,因此为了方便使用 Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。(稳定是指物质放置 在空气中不易发生各种化学反应而变质)
I.硫酸亚铁铵晶体的制备与检验
(1)某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都必须煮沸、冷却后再使用,这样处理蒸馏水的目的是_______ 。向 FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______ 、冷却结晶、过滤、洗涤和干燥后得到一 种浅蓝绿色的晶体。
(2)该小组同学继续设计实验证明所制得晶体的成分。
①如图所示实验的目的是_______ ,C 装置的作用是_______ 。
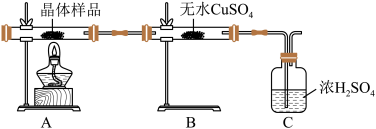
取少量晶体溶于水,得淡绿色待测液。
②取少量待测液,_______ (填操作与现象),证明所制得的晶体中有 Fe2+。
③取少量待测液,经其它实验证明晶体中有NH4+和SO42-
II.实验探究影响溶液中 Fe2+稳定性的因素
(3)配制 0.8 mol/L 的 FeSO4溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2溶液(pH=4.0),各取 2 ml 上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分钟后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液;FeSO4溶液则出现淡黄色浑浊。
【资料 1】
①请用离子方程式解释 FeSO4溶液产生淡黄色浑浊的原因_______ 。
②讨论影响 Fe2+稳定性的因素,小组同学提出以下 3 种假设:
假设 1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中 Fe2+稳定性较好。
假设 2:其它条件相同时,在一定 pH 范围内,溶液 pH 越小 Fe2+稳定性越好。
假设 3:_______ 。
(4)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分 别控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)为不同的 pH,
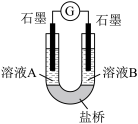
观察记录电流计读数,对假设 2 进行实验研究,实验结果如表所示。
【资料 2】原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原 电池的电流越大。
【资料 3】常温下,0.1mol/L pH=1 的 FeSO4溶液比 pH=5 的 FeSO4溶液稳定性更好。 根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U 形管中左池的电极反应式____________ 。
②对比实验 1 和 2(或 3 和 4) ,在一定 pH 范围内,可得出的结论为____________ 。
③对比实验____________ 和____________ ,还可得出在一定pH 范围内溶液酸碱性变化对 O2氧化性强弱的影响因素。
④ 对【资料 3】实验事实的解释为____________ 。
I.硫酸亚铁铵晶体的制备与检验
(1)某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都必须煮沸、冷却后再使用,这样处理蒸馏水的目的是
(2)该小组同学继续设计实验证明所制得晶体的成分。
①如图所示实验的目的是

取少量晶体溶于水,得淡绿色待测液。
②取少量待测液,
③取少量待测液,经其它实验证明晶体中有NH4+和SO42-
II.实验探究影响溶液中 Fe2+稳定性的因素
(3)配制 0.8 mol/L 的 FeSO4溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2溶液(pH=4.0),各取 2 ml 上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分钟后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液;FeSO4溶液则出现淡黄色浑浊。
【资料 1】
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.6 | 2.7 |
| 完全沉淀pH | 9.6 | 3.7 |
②讨论影响 Fe2+稳定性的因素,小组同学提出以下 3 种假设:
假设 1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中 Fe2+稳定性较好。
假设 2:其它条件相同时,在一定 pH 范围内,溶液 pH 越小 Fe2+稳定性越好。
假设 3:
(4)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分 别控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)为不同的 pH,

观察记录电流计读数,对假设 2 进行实验研究,实验结果如表所示。
| 序号 | A:0.2mol·L-1NaCl | B:0.1mol·L-1FeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |
【资料 3】常温下,0.1mol/L pH=1 的 FeSO4溶液比 pH=5 的 FeSO4溶液稳定性更好。 根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U 形管中左池的电极反应式
②对比实验 1 和 2(或 3 和 4) ,在一定 pH 范围内,可得出的结论为
③对比实验
④ 对【资料 3】实验事实的解释为
您最近一年使用:0次
2020-04-16更新
|
457次组卷
|
2卷引用:山东省济宁市嘉祥县第一中学2020届高三下学期第三次质量检测化学试题
2023高三·全国·专题练习
解题方法
2 . 某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性。请完成对铁元素价态的探究:
(1)①提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:催化剂中铁元素为+2价;
假设3:_____ 。
②设计实验方案。
③根据②的实验方案进行实验:
(2)步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是_____ ;步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
(3)步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现红色,则假设_____ 成立;若出现红色,则假设_____ 成立;
(4)步骤4:另取A溶液于试管,加入KMnO4溶液,振荡,结合步骤3中的结论,若出现_____ 现象,则假设1成立;反之,则假设3成立。
(5)某同学将步骤2中的稀硫酸改成稀硝酸得到了A溶液,向A溶液中滴加KSCN溶液后出现血红色,由此得出该催化剂中铁元素为+3价的结论,该结论是否合理?(填“是”或“否”)_____ ,理由是_____ 。
(1)①提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:催化剂中铁元素为+2价;
假设3:
②设计实验方案。
③根据②的实验方案进行实验:
(2)步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是
(3)步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现红色,则假设
(4)步骤4:另取A溶液于试管,加入KMnO4溶液,振荡,结合步骤3中的结论,若出现
(5)某同学将步骤2中的稀硫酸改成稀硝酸得到了A溶液,向A溶液中滴加KSCN溶液后出现血红色,由此得出该催化剂中铁元素为+3价的结论,该结论是否合理?(填“是”或“否”)
您最近一年使用:0次
解题方法
3 . 某种常见补铁药物的主要成分为琥珀酸亚铁。该药品不溶于水但能溶于常见稀酸。某学习小组同学分别设计实验检验药片中Fe2+的存在并测定Fe2+的含量(假设杂质不参与反应)。回答下列问题:
(1)甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是_______ (填编号)。
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为_______ 。
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为_______ 。
②步骤三中,加入H2O2溶液发生反应的离子方程式为_______ ,灼烧后 所得固体的颜色为 _______ ,灼烧时需要使用下列仪器中的 _______ (填编号)。
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是_______ 。
④由实验数据计算,每片药片中约含Fe2+_______ mg。
(3)医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的_______ (选填“氧化性”、“ 还原性”或“碱性”。)
(1)甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为
②步骤三中,加入H2O2溶液发生反应的离子方程式为
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是
④由实验数据计算,每片药片中约含Fe2+
(3)医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的
您最近一年使用:0次
21-22高一·全国·假期作业
解题方法
4 . 某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性。请完成对铁元素价态的探究:
(1)①提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:催化剂中铁元素为+2价;
假设3:_______ 。
②设计实验方案。
③根据②的实验方案进行实验:
(2)步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是_______ ;步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
(3)步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设_______ 成立;若出现血红色,则假设_______ 成立;
(4)步骤4:另取A溶液于试管,加入KMnO4溶液,振荡,结合步骤3中的结论,若出现_______ 现象,则假设1成立;反之,则假设3成立。
(1)①提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:催化剂中铁元素为+2价;
假设3:
②设计实验方案。
③根据②的实验方案进行实验:
(2)步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是
(3)步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设
(4)步骤4:另取A溶液于试管,加入KMnO4溶液,振荡,结合步骤3中的结论,若出现
您最近一年使用:0次
名校
解题方法
5 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
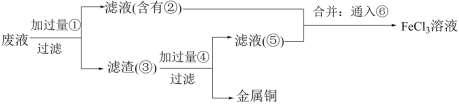
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
406次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市第一中学2021--2022学年高一上学期期末考试化学试题
名校
6 . 苹果汁是人们喜爱的饮料。现榨苹果汁露置在空气中,其中的 会转变为
会转变为 离子,使其由淡绿色变为棕黄色。若榨苹果汁时加入维生素C,可有效防止此现象的发生。这说明维生素C具有
离子,使其由淡绿色变为棕黄色。若榨苹果汁时加入维生素C,可有效防止此现象的发生。这说明维生素C具有
 会转变为
会转变为 离子,使其由淡绿色变为棕黄色。若榨苹果汁时加入维生素C,可有效防止此现象的发生。这说明维生素C具有
离子,使其由淡绿色变为棕黄色。若榨苹果汁时加入维生素C,可有效防止此现象的发生。这说明维生素C具有| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
您最近一年使用:0次
7 . 高三老师设计了“Fe3+的氧化性实验探究”学案,课后选取一学生学案,其中部分内容如下。依据已有知识及学案相关内容。
回顾:Fe2+呈淡绿色、Fe3+呈棕黄色、Fe(OH)3胶体是红褐色液体。
提供资料:FeSO3是墨绿色沉淀
设置问题:Na2SO3溶液与FeCl3溶液反应猜想
猜提一:Na2SO3溶液与FeCl3溶液发生氧化还原反应;
猜想二:Na2SO3溶液与FeCl3溶液发生相互促进的水解反应,产生了Fe(OH)3胶体;
猜想三:_______。
(1)请将划线空白处补充完整_______ 。
问题探究:
(2)若猜想一正确,预测的实验现象是_______ ,反应的离子方程式为_______ 。
小组实验i:
现象记录:溶液黄色逐渐加深,最终得到红褐色溶液W
(3)观察实验现象证实猜想二合理,用红色激光笔照射该红褐色液体,预测的现象是_______ ;反应的离子方程式为_______ 。
(4)组织同学讨论:氧化还原反应是否发生,怎样检验。(归纳同学得出的检验方案)
方来①:取少量W液作,加铁氧化钾溶液,检验是否有Fe2+;
方来②:取少量W液伸,加酸性高锰酸钾漆液,检验是否有Fe2+;
方来③:取少量W液伸,加盐酸酸化,再加氯化钾溶液,检验是否有SO 。
。
你认为方案②_______ (填“合理”或“不合理”),理由是_______ 。
完善证据:
分组实验ⅱ:
现象记录:产生由色沉淀
分组实验ⅲ:取少量W液体,加铁氰化钾溶液,发现有蓝色沉淀生成。
探究结论:Fe3+与SO 的反应体系中,氧化还原反应与水解反应下仅共存而且存在竞争。
的反应体系中,氧化还原反应与水解反应下仅共存而且存在竞争。
回顾:Fe2+呈淡绿色、Fe3+呈棕黄色、Fe(OH)3胶体是红褐色液体。
提供资料:FeSO3是墨绿色沉淀
设置问题:Na2SO3溶液与FeCl3溶液反应猜想
猜提一:Na2SO3溶液与FeCl3溶液发生氧化还原反应;
猜想二:Na2SO3溶液与FeCl3溶液发生相互促进的水解反应,产生了Fe(OH)3胶体;
猜想三:_______。
(1)请将划线空白处补充完整
问题探究:
(2)若猜想一正确,预测的实验现象是
小组实验i:
| 装置 | 操作 |
 | 向2mLmol·L-1的FeCl3溶液中逐滴滴加1mLmol·L-1的Na2SO3溶液 |
(3)观察实验现象证实猜想二合理,用红色激光笔照射该红褐色液体,预测的现象是
(4)组织同学讨论:氧化还原反应是否发生,怎样检验。(归纳同学得出的检验方案)
方来①:取少量W液作,加铁氧化钾溶液,检验是否有Fe2+;
方来②:取少量W液伸,加酸性高锰酸钾漆液,检验是否有Fe2+;
方来③:取少量W液伸,加盐酸酸化,再加氯化钾溶液,检验是否有SO
 。
。你认为方案②
完善证据:
分组实验ⅱ:
| 装置 | 操作 |
 | 取1mLW液体于试管中,滴加过量盐酸,再滴加5滴BaCl溶液 |
分组实验ⅲ:取少量W液体,加铁氰化钾溶液,发现有蓝色沉淀生成。
探究结论:Fe3+与SO
 的反应体系中,氧化还原反应与水解反应下仅共存而且存在竞争。
的反应体系中,氧化还原反应与水解反应下仅共存而且存在竞争。
您最近一年使用:0次
名校
解题方法
8 . 下列实验操作、现象和结论一致的是
选项 | 操作 | 现象 | 解释(或结论) |
A | 向补铁口服液中滴加几滴酸性KMnO4溶液 | 紫色褪去 | 补铁口服液中有Fe2+ |
B | 向I2水中先加浓NaOH溶液,再加CCl4,振荡后静置 | 液体分层, 上层无色,下层紫红色 | CCl4能萃取碘水中的碘,而NaOH溶液不能 |
C | 向盛有1 mL乙酸乙酯的a、b两支试管中分别加入2 mL H2O、2 mLNaOH溶液,70 ~ 80°C热水浴 | 试管 a液体分层,酯层无明显 变化; 试管b酯层消失 | 乙酸乙酯在碱性条件下可以水解; |
D | 向Fe(NO3)3溶液中先加稀HNO3 ,再加NaCl | 溶液黄色先褪去,再变为黄色 | HNO3的强氧化性将Fe3+氧化为无色, Cl-的还原性再将其还原为Fe3+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-09更新
|
2274次组卷
|
5卷引用:安徽省蚌埠市2023届高三下学期第三次教学质量检查考试理综化学试题
安徽省蚌埠市2023届高三下学期第三次教学质量检查考试理综化学试题(已下线)化学-2023年高考押题预测卷01(全国甲卷)(含考试版、全解全析、参考答案、答题卡)(已下线)化学-2023年高考押题预测卷03(山东卷)(含考试版、全解全析、参考答案、答题卡)(已下线)第09练 微型实验设计与评价 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)甘肃省兰州第一中学2023-2024学年高三上学期第三次月考化学试题
9 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视⻆。铁元素的“价-类”二维图如图所示:

(1)C的化学式是___________ ,E→F反应的化学方程式是___________ ,反应过程的现象为___________ 。
(2)A在一定条件下可以和水蒸气发生反应,反应方程式是___________ 。
(3)维生素C可将H转化为G,维生素C具有___________ (填“酸性”、“氧化性”或“还原性”)。
(4)在指定条件下,下列铁及其化合物之间的转化不能实现的是___________ 。
A.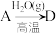 B.
B.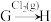 C.
C.
(5)某小组同学设计如下实验,研究亚铁盐与 溶液的反应。
溶液的反应。
试剂:酸化的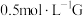 溶液,5%
溶液,5% 溶液
溶液
上述实验中 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是___________ 。

(1)C的化学式是
(2)A在一定条件下可以和水蒸气发生反应,反应方程式是
(3)维生素C可将H转化为G,维生素C具有
(4)在指定条件下,下列铁及其化合物之间的转化不能实现的是
A.
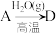 B.
B.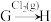 C.
C.
(5)某小组同学设计如下实验,研究亚铁盐与
 溶液的反应。
溶液的反应。试剂:酸化的
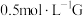 溶液,5%
溶液,5% 溶液
溶液| 操作 | 现象 |
取 酸化的G溶液于试管中,加入 酸化的G溶液于试管中,加入 5% 5% 溶液 溶液 | 溶液立即变为棕黄色,稍后,产生气泡。 |
向反应后的溶液中加入 溶液 溶液 | 溶液变红 |
 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是
您最近一年使用:0次
名校
10 . 某实验小组对KSCN的性质进行探究,设计如下实验:
资料:①溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关,例如Cu2+可与SCN-反应生成CuSCN白色沉淀和(SCN)2。但是用CuSO4溶液、KSCN溶液与石墨电极、电流表、盐桥组装成原电池,电流表指针几乎不偏转;
②(SCN)2称为“拟卤素”,在水溶液中呈黄色;(SCN)2的化学性质与Cl2相似,可与水、碱等发生反应。
回答下列问题:
(1)①用离子方程式表示实验I溶液变红的原因_______ 、_______ ;
②针对实验I中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO ,试设计实验验证
,试设计实验验证_______ (简述操作及现象);
③写出与SCN-互为等电子体的分子为_______ ;互为等电子体的离子为_______ 。
(2)实验II中CuSO4溶液显酸性的原因是_______ (用离子方程式表示)。反应后试管内溶液pH减小,可能的原因是_______ 。
(3)同学们根据相同条件下氧化性Fe3+>Cu2+,预测实验III中除了发生络合反应外,Fe3+与SCN-还可发生类似II中的氧化还原反应,于是通过实验IV进行探究。
①写出该实验生成蓝色沉淀的离子方程式:_______ ;
②试分析该实验中原电池指针由几乎不偏转到偏转明显的原因_______ 。
| 试管中试剂 | 实验 | 滴加试剂 | 现象 |
 2mL 0.1mol/LKSCN溶液 | Ⅰ | i.先加1mL 0.1mol/L FeSO4溶液 ii.再加硫酸酸化的KMnO4溶液 | i.无明显现象 ii.先变红,后褪色 |
| Ⅱ | iii.滴加1mL 0.1mol/L CuSO4溶液(pH=4) | iii.生成白色沉淀,溶液pH=2 | |
| Ⅲ | iv.滴加1mL 0.05mol/L Fe2(SO4)3溶液 | iv.溶液变红 | |
| Ⅳ | v.用Fe2(SO4)3溶液、KSCN溶液与石墨电极、电流表、盐桥等组装成原电池 vi.往实验Ⅲ反应后的试管中逐滴加入K3[Fe(CN)6]溶液 vii.向原电池盛有Fe2(SO4)3溶液的容器中加入少量K3[Fe(CN)6] | v.电流表指针几乎不偏转 vi.产生蓝色沉淀且沉淀量逐渐增多 vii.指针明显偏转 |
②(SCN)2称为“拟卤素”,在水溶液中呈黄色;(SCN)2的化学性质与Cl2相似,可与水、碱等发生反应。
回答下列问题:
(1)①用离子方程式表示实验I溶液变红的原因
②针对实验I中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO
 ,试设计实验验证
,试设计实验验证③写出与SCN-互为等电子体的分子为
(2)实验II中CuSO4溶液显酸性的原因是
(3)同学们根据相同条件下氧化性Fe3+>Cu2+,预测实验III中除了发生络合反应外,Fe3+与SCN-还可发生类似II中的氧化还原反应,于是通过实验IV进行探究。
①写出该实验生成蓝色沉淀的离子方程式:
②试分析该实验中原电池指针由几乎不偏转到偏转明显的原因
您最近一年使用:0次



