1 . 绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:

(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是__________ ,甲组由此得出绿矾的分解产物中含有SO2。装置C的作用是______________ 。
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。乙对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中___________ 。(填字母)
A.不含SO2B.可能含SO2C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置:
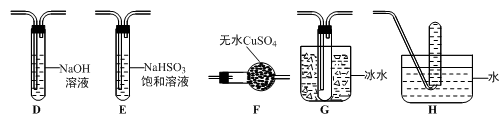
①丙组同学的实验装置中,依次连接的合理顺序为______________________ 。
②能证明绿矾分解产物中有O2的实验操作及现象是_______________________ 。
(4)为证明绿矾分解产物中含有三价铁,选用的实验仪器有试管、胶头滴管、_____________ ;选用的试剂为_____________ 。

(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置B中可观察到的现象是
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。乙对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中
A.不含SO2B.可能含SO2C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解气态产物的装置:

①丙组同学的实验装置中,依次连接的合理顺序为
②能证明绿矾分解产物中有O2的实验操作及现象是
(4)为证明绿矾分解产物中含有三价铁,选用的实验仪器有试管、胶头滴管、
您最近一年使用:0次
2017-02-17更新
|
2438次组卷
|
9卷引用:2017届湖北省八校高三上学期12月联考化学试卷
解题方法
2 . 某小组欲探究反应2Fe2++I2 2Fe3++2I−,完成如下实验:
2Fe3++2I−,完成如下实验:
资料:AgI是黄色固体,不溶于稀硝酸。新制的AgI见光会少量分解。

(1)Ⅰ、Ⅱ均未检出Fe3+,检验Ⅱ中有无Fe3+的实验操作及现象是:取少量Ⅱ中溶液,___ 。
(2)Ⅲ中的黄色浑浊是__ 。
(3)经检验,Ⅱ→Ⅲ的过程中产生了Fe3+。
①对Fe3+产生的原因做出如下假设:
假设a:空气中存在O2,由于___ (用离子方程式表示),可产生Fe3+;
假设b:酸性溶液中NO3−具有氧化性,可产生Fe3+;
假设c:___ ;
假设d:该条件下,I2溶液可将Fe2+氧化为Fe3+。
②通过实验进一步证实a、b、c不是产生Fe3+的主要原因,假设d成立。Ⅱ→Ⅲ的过程中I2溶液氧化Fe2+的原因是___ 。
(4)经检验,Ⅳ中灰黑色浑浊中含有AgI和Ag。
①验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,___ 。
②为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验1和实验2。
实验1:向1mL0.1 mol·L−1 FeSO4溶液中加入1mL0.1mol·L−1AgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如图。

实验2:实验开始时,先向试管中加入几滴Fe2(SO4)3溶液,重复实验1,实验结果与实验1相同。
ⅰ.实验1中发生反应的离子方程式是___ 。
ⅱ.Ⅳ中迅速出现灰黑色浑浊的可能的原因是___ 。
 2Fe3++2I−,完成如下实验:
2Fe3++2I−,完成如下实验:资料:AgI是黄色固体,不溶于稀硝酸。新制的AgI见光会少量分解。

(1)Ⅰ、Ⅱ均未检出Fe3+,检验Ⅱ中有无Fe3+的实验操作及现象是:取少量Ⅱ中溶液,
(2)Ⅲ中的黄色浑浊是
(3)经检验,Ⅱ→Ⅲ的过程中产生了Fe3+。
①对Fe3+产生的原因做出如下假设:
假设a:空气中存在O2,由于
假设b:酸性溶液中NO3−具有氧化性,可产生Fe3+;
假设c:
假设d:该条件下,I2溶液可将Fe2+氧化为Fe3+。
②通过实验进一步证实a、b、c不是产生Fe3+的主要原因,假设d成立。Ⅱ→Ⅲ的过程中I2溶液氧化Fe2+的原因是
(4)经检验,Ⅳ中灰黑色浑浊中含有AgI和Ag。
①验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,
②为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验1和实验2。
实验1:向1mL0.1 mol·L−1 FeSO4溶液中加入1mL0.1mol·L−1AgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如图。

实验2:实验开始时,先向试管中加入几滴Fe2(SO4)3溶液,重复实验1,实验结果与实验1相同。
ⅰ.实验1中发生反应的离子方程式是
ⅱ.Ⅳ中迅速出现灰黑色浑浊的可能的原因是
您最近一年使用:0次
名校
解题方法
3 . 为证明化学反应有一定的限度,进行如下探究活动: I.取5m1 0.1mol/L的KI溶液,滴加几滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+) Ⅱ.继续加入2ml CCl4振荡. Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为____________________________________ ;
探究活动Ⅱ的实验现象为____________________________________ 。
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+ ;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6] 4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
ⅱ.写出实验操作“步骤一”中反应的离子方程式为___________________ 。
(1)探究活动I的实验现象为
探究活动Ⅱ的实验现象为
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+ ;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6] 4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
| 实 验 操 作 | 现 象 和 结 论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] | 若产生 则 |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 | 若 则 |
您最近一年使用:0次
2016-12-09更新
|
678次组卷
|
2卷引用:2014-2015浙江省杭州地区重点中学高一第二学期期中联考化学试卷
4 . 卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如图:
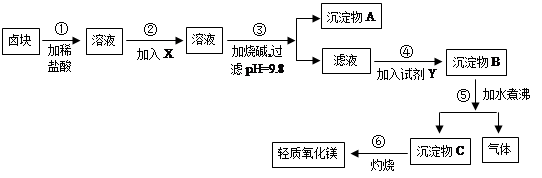
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1和表2提供的资料,填写空白:
(1)在步骤②中加入的试剂X(从表2中选择)是___ 而不是双氧水,其原因是________________ 。
写出加入X发生反应的离子方程式_______________________________ 。
(2)在步骤③中控制pH=9.8,其目的是_______________________________ 。
(3)沉淀物A的成分为_____________ ,试剂Y(从表2中选择)应该是________ 。
(4)在步骤⑤中发生反应的化学方程式是_______________________________ 。
(5)若在实验室中完成步骤⑥,则沉淀物C必需在______ (填仪器名称)中灼烧。

已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1和表2提供的资料,填写空白:
| 表1 生成氢氧化物沉淀的pH | 表2 化学试剂价格表 | ||||
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) | |
| Fe(OH)3 | 2.7 | 3.7 | 漂液(含25.2% NaClO) | 450 | |
| Fe(OH)2 | 7.6 | 9.6 | 双氧水(含30% H2O2) | 2400 | |
| Mn(OH)2 | 8.3 | 9.8 | 烧碱(含98% NaOH) | 2100 | |
| Mg(OH)2 | 10.0 | 11.1 | 纯碱(含99.5% Na2CO3) | 600 | |
写出加入X发生反应的离子方程式
(2)在步骤③中控制pH=9.8,其目的是
(3)沉淀物A的成分为
(4)在步骤⑤中发生反应的化学方程式是
(5)若在实验室中完成步骤⑥,则沉淀物C必需在
您最近一年使用:0次



