14-15高二上·湖南长沙·期中
名校
1 . 苹果切开后的剖面在空气中会很快变黄,有人称之为“苹果生锈”。若将维生素C溶液涂在新切开的剖面上,剖面就不会迅速变成黄色。这说明维生素C具有
| A.氧化性 | B.还原性 | C.碱性 | D.酸性 |
您最近一年使用:0次
2016-12-09更新
|
123次组卷
|
4卷引用:吉林省延边第二中学2019-2020学年高二上学期期中考化学(文)试题
吉林省延边第二中学2019-2020学年高二上学期期中考化学(文)试题(已下线)2014秋湖南省浏阳一中高二上学期期中化学(文)试卷黑龙江省哈尔滨市第三中学2017-2018学年高二上学期期中考试(文)化学试题湖南省邵东县创新实验学校2019-2020学年高二上学期期中考试化学(文)试题
14-15高一上·吉林长春·期末
名校
解题方法
2 . 为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是( )
| 实验操作 | 实验现象 | 离子反应 | 实验结论 | |
| A | 在氯化亚铁溶液中通入氯气 | 浅绿色溶液变成棕黄色溶液 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 | Fe2++Zn=Fe+Zn2+ | Zn具有还原性 |
| C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | Fe3++Fe=2Fe2+ | 铁单质具有还原性 |
| D | 在氯化铁溶液中加入铜粉 | 蓝色溶液变成棕黄色溶液 | 2Fe3++Cu=2Fe2++Cu2+ | Fe3+具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2014-01-14更新
|
879次组卷
|
7卷引用:2013-2014学年吉林省长春外国语学校高一上学期期末理科化学试卷
(已下线)2013-2014学年吉林省长春外国语学校高一上学期期末理科化学试卷(已下线)2014吉林省长春外国语学校高一上学期期末化学(理)试卷 吉林省白城市洮南市第一中学2020-2021学年高一上学期第三次月考化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【押题专练】黑龙江省牡丹江市2020-2021学年高一上学期期末考试化学试题黑龙江省哈尔滨市第六中学校2022—2023学年高一上学期期中考试化学试题青海省西宁市海湖中学2021-2022学年高三上学期期中考试化学试题
13-14高三·四川成都·阶段练习
名校
解题方法
3 . 已知氯气有强氧化性,能氧化Fe2+、Br-、I-等。又已知还原性I->Fe2+>Br-。向含有Fe2+、I-、Br-的溶液中通入一定量氯气后,对所得溶液中离子的成分分析正确的是
| A.I-、Fe3+、Cl- | B.Fe2+、Cl-、Br- |
| C.Fe2+、Fe3+、Cl- | D.Fe2+、I-、Cl- |
您最近一年使用:0次
2021-10-18更新
|
482次组卷
|
21卷引用:吉林省白城市第一中学2019-2020学年高二下学期期末考试化学试题
吉林省白城市第一中学2019-2020学年高二下学期期末考试化学试题吉林省辽源市第五中学校2019-2020学年高一期中考试化学试题(已下线)2015届四川省都江堰中学高三第三次理综考试化学试卷【区级联考】上海市闵行区2019届高三第二学期二模质量调研考试化学试题(已下线)专题04 氧化还原反应——2019年高考真题和模拟题化学分项汇编黑龙江省哈尔滨市第六中学2018-2019学年高二下学期期末考试化学试题江西省横峰中学等五校2019-2020学年新高一竞赛班联考化学试题浙江省温州十五校联合体2019-2020学年高一上学期期中联考化学试题上海市虹口区2020届高三上学期一模化学试题上海市虹口区2014届高三二模化学试题甘肃省天水一中2019-2020学年高一上学期第三学段(期末)考试化学试题宁夏石嘴山市第三中学2021届高三上学期第一次月考化学试题上海市青浦高级中学2021届高三下学期3月月考化学试题辽宁省六校协作体2021-2022学年高一上学期第一次联考化学试题(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)黑龙江省双鸭山市第一中学2022-2023学年高一10月月考化学试题黑龙江省鹤岗市绥滨县第一中学2021-2022学年高三上学期期中考试化学试题微专题(二)——氧化还原反应的简单规律及应用微专题(四) 氧化还原反应的简单规律及应用辽宁省大连市第八中学2021-2022学年高一上学期12月月考化学试题辽宁省沈阳市第十中学2023-2024学年高一上学期12月份考试化学试题
解题方法
4 . I.在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液,迅速发生反应放出大量气体,反应过程可表示如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)H2O2在反应③中的作用是______ (填正确选项的标号)
A.氧化剂 B.还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂也不是还原剂
(2)有人认为上述反应说明了碘单质是过氧化氢分解的催化剂,你认为______ (填“对”或“不对”),其理由是______ 。
(3)上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是______ >______ >______ 。
II.硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。请回答下列问题:
(1)Fe(OH)3在碱性介质中与NaClO反应生成Na2FeO4和NaCl,写出Fe(OH)3与NaClO在碱性介质中反应的离子方程式是______ 。
(2)硫酸亚铁制备中实验步骤①的目的是______ 。
(3)实验步骤②明显不合理,理由是______ 。
(4)实验步骤④中用少量冰水洗涤晶体,其目的是______ 。
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)H2O2在反应③中的作用是
A.氧化剂 B.还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂也不是还原剂
(2)有人认为上述反应说明了碘单质是过氧化氢分解的催化剂,你认为
(3)上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是
II.硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。请回答下列问题:
(1)Fe(OH)3在碱性介质中与NaClO反应生成Na2FeO4和NaCl,写出Fe(OH)3与NaClO在碱性介质中反应的离子方程式是
(2)硫酸亚铁制备中实验步骤①的目的是
(3)实验步骤②明显不合理,理由是
(4)实验步骤④中用少量冰水洗涤晶体,其目的是
您最近一年使用:0次
5 . 鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色Fe3+。这个变色的过程中的Fe2+被___ (填“氧化”或“还原”)。若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生。这说明维生素C有:_____ 氧化性 、还原性)
您最近一年使用:0次
名校
6 . 某研究性学习小组请你参与“铁及其化合物”有关性质的实验探究,并共同解答下列问题:
探究一 设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为_______________________________ 。
(2)反应前A中投放碎瓷片的目的是____________________ 。
(3)装置E中的现象是__________________________________ 。
探究二 FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需的玻璃仪器是________ 。
(2)下列有关配制过程中说法正确的是________ (填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
若假设1正确,从实验①中分离出Br2的实验操作名称是_______________ 。
(4)已知:Br2+2Fe2+=2Fe3++2Br-。若在50mL上述FeBr2溶液中通入标准状况112mlCl2,反应的离子方程式为__________________________________________ 。
探究一 设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为
(2)反应前A中投放碎瓷片的目的是
(3)装置E中的现象是
探究二 FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需的玻璃仪器是
(2)下列有关配制过程中说法正确的是
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入 现象:下层呈橙红色,上层呈无色 | 假设1正确 |
| ②向溶液中加入 现象:溶液变为红色 | 假设2正确 |
若假设1正确,从实验①中分离出Br2的实验操作名称是
(4)已知:Br2+2Fe2+=2Fe3++2Br-。若在50mL上述FeBr2溶液中通入标准状况112mlCl2,反应的离子方程式为
您最近一年使用:0次
2018-01-24更新
|
673次组卷
|
4卷引用:吉林省柳河中学2017-2018学年高一上学期期末考试化学试题
12-13高一上·广东·期末
名校
解题方法
7 . 已知下述三个实验均能发生化学反应
①将铁钉放入硫酸铜溶液中 ②向硫酸亚铁溶液中滴入几滴双氧水
③将铜丝放入氯化铁溶液中
下列判断正确的是( )
①将铁钉放入硫酸铜溶液中 ②向硫酸亚铁溶液中滴入几滴双氧水
③将铜丝放入氯化铁溶液中
下列判断正确的是( )
| A.实验①中铁钉做氧化剂 |
| B.实验②中Fe2+具有还原性 |
| C.实验③中发生的是置换反应 |
| D.上述实验证明氧化性Fe3+>Fe2+>Cu2+ |
您最近一年使用:0次
2016-10-21更新
|
327次组卷
|
10卷引用:2014-2015吉林省松原市扶余县一中高一上学期期末化学试卷
2014-2015吉林省松原市扶余县一中高一上学期期末化学试卷(已下线)2011-2012学年广东省实验中学高一上学期期末考试化学试卷2014-2015辽宁省大连市第二十高中高一上学期期末化学试卷2017届天津市静海一中高三上学期9月调研化学试卷山东省寿光现代中学2016-2017学年高一下学期第三学段质量监测(期中)化学试题湖南省郴州市2017-2018学年高一上学期期末考试化学试题湖南省长沙市雨花区2018-2019学年高一上学期期末考试化学试题河北省元氏县第四中学2020-2021学年高一10月月考化学试题云南省玉溪第三中学2021-2022学年高一上学期期末考试化学试题云南省开远市第一中学校2023-2024学年高一上学期期中考试化学试题
14-15高一上·江西南昌·期末
名校
8 . 下列关于Fe2+和Fe3+的叙述中。错误的是
| A.Fe2+的水溶液为浅绿色 |
| B.Fe3+的水溶液为棕黄色 |
| C.Fe3+具有氧化性,Fe2+具有还原性 |
| D.Fe3+溶液中滴入含SCN-的溶液,立即出现红色沉淀 |
您最近一年使用:0次
2016-12-09更新
|
1010次组卷
|
8卷引用:吉林省长春市榆树高级中学2020-2021学年高一上学期期末考试化学试题
名校
解题方法
9 . 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
氯化铁:熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。氯化亚铁:熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁(铁粉足量)。请回答下列问题:
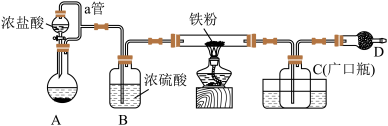
(1)在装置A中,用 与浓盐酸反应制取氯气,写出反应的离子方程式
与浓盐酸反应制取氯气,写出反应的离子方程式_______ 。
(2)B装置的作用_______ 。
(3)D中装的药品是_______ ,其作用是吸收未反应的 ,防止污染环境;同时防止空气中的水进入装置C,使
,防止污染环境;同时防止空气中的水进入装置C,使 潮解。
潮解。
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有 ,可用下列试剂中的
,可用下列试剂中的_______ (只能选取一种试剂,填序号)进行检测。
① 溶液 ②酸性
溶液 ②酸性 溶液 ③
溶液 ③ 溶液 ④
溶液 ④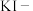 淀粉溶液
淀粉溶液
(5)定量分析。取装置C中的产物,按以下步骤进行测定:
①称取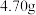 产品溶于过量的稀盐酸中;
产品溶于过量的稀盐酸中;
②加入足量 溶液;
溶液;
③再加入足量 溶液;
溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为 。
。
则该样品中铁元素的质量分数为_______ %(结果精确到小数点后两位)。
(6)由(5)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量_______ (填“相等”“偏高”或“偏低”),说明含有 杂质。
杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_______ 。
氯化铁:熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。氯化亚铁:熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁(铁粉足量)。请回答下列问题:

(1)在装置A中,用
 与浓盐酸反应制取氯气,写出反应的离子方程式
与浓盐酸反应制取氯气,写出反应的离子方程式(2)B装置的作用
(3)D中装的药品是
 ,防止污染环境;同时防止空气中的水进入装置C,使
,防止污染环境;同时防止空气中的水进入装置C,使 潮解。
潮解。(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有
 ,可用下列试剂中的
,可用下列试剂中的①
 溶液 ②酸性
溶液 ②酸性 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 淀粉溶液
淀粉溶液(5)定量分析。取装置C中的产物,按以下步骤进行测定:
①称取
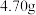 产品溶于过量的稀盐酸中;
产品溶于过量的稀盐酸中;②加入足量
 溶液;
溶液;③再加入足量
 溶液;
溶液;④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为
 。
。则该样品中铁元素的质量分数为
(6)由(5)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量
 杂质。
杂质。②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是
您最近一年使用:0次
名校
解题方法
10 . FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S气体。
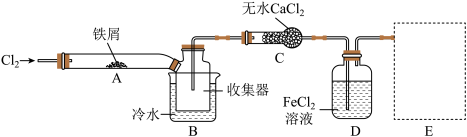
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华,氢硫酸为弱酸。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为_______________________________________ 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作应该是__________________________________ 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________ 。
(4)装置B中冷水浴的作用为_______________________________________________ ;装置C的名称为________ ;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂_______________________________________________ 。
(5)在虚线框中画出尾气吸收装置E并注明试剂。____________
(6)FeCl3溶液与H2S气体反应的离子方程式为____________________________ 。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华,氢硫酸为弱酸。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作应该是
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)
(4)装置B中冷水浴的作用为
(5)在虚线框中画出尾气吸收装置E并注明试剂。
(6)FeCl3溶液与H2S气体反应的离子方程式为
您最近一年使用:0次
2018-01-10更新
|
655次组卷
|
3卷引用:吉林省实验中学2017-2018学年高一上学期期末考试化学试题



