1 . 由下列实验操作和现象所得结论均正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液有白色沉淀产生 | 样品已变质 |
| B | 将盐酸滴入某溶液,产生能使澄清石灰水变浑浊的气体 | 溶液中有 |
| C | 铁投入冷的浓硝酸中无明显现象,投入稀硝酸中有气泡冒出 | 氧化性:稀硝酸>浓硝酸 |
| D | 向Na2SO3溶液中滴入稀盐酸,产生刺激性气味的气体可使品红溶液褪色 | 酸性:HCl>H2SO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-09更新
|
200次组卷
|
3卷引用:重庆市两江中学校2021-2022学年高一下学期第一次月考化学试题
2 . 工业上用辉铜矿(主要成分是Cu2S,还含有少量SiO2)制备CuCl的工艺流程如下:
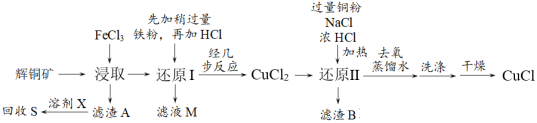
查阅资料得以下信息:CuCl是有机合成工业中应用较广的催化剂,是一种白色粉末,微溶于水,不溶于稀硫酸和乙醇,在潮湿的空气中易水解氧化为碱式氯化铜。
回答以下问题:
(1)已知铜是29号元素,最外层电子数为1,画出铜的原子结构示意图_______ 。
(2)滤渣A的成分是_______ 。
(3)要回收滤渣A中的硫单质,溶剂X可以选择_______。
(4)写出浸取时发生反应的离子方程式_______ 。
(5)检验滤液M是否氧化变质,应加入的最佳试剂为_______ 。
(6)滤液M与试剂Y发生反应后,所得产物可以循环利用,试剂Y为_______ 。
(7)洗涤时选择的最佳试剂是_______。
(8)CuSO4与Na2SO3溶液、NaCl溶液混合加热,也可以得到CuCl沉淀,写出反应的离子方程式_______ 。

查阅资料得以下信息:CuCl是有机合成工业中应用较广的催化剂,是一种白色粉末,微溶于水,不溶于稀硫酸和乙醇,在潮湿的空气中易水解氧化为碱式氯化铜。
回答以下问题:
(1)已知铜是29号元素,最外层电子数为1,画出铜的原子结构示意图
(2)滤渣A的成分是
(3)要回收滤渣A中的硫单质,溶剂X可以选择_______。
| A.水 | B.酒精 | C.CS2 | D.稀H2SO4 |
(5)检验滤液M是否氧化变质,应加入的最佳试剂为
(6)滤液M与试剂Y发生反应后,所得产物可以循环利用,试剂Y为
(7)洗涤时选择的最佳试剂是_______。
| A.稀盐酸 | B.酒精 | C.稀HNO3 | D.稀H2SO4 |
您最近一年使用:0次
名校
解题方法
3 . 某溶液中可能含有浓度均为0.5mol/L的K+、Na+、Fe2+、Fe3+、SO 、SO
、SO 中的几种离子。根据下列实验操作与现象,推测合理的是
中的几种离子。根据下列实验操作与现象,推测合理的是
 、SO
、SO 中的几种离子。根据下列实验操作与现象,推测合理的是
中的几种离子。根据下列实验操作与现象,推测合理的是| 实验步骤 | 实验现象 | |
| Ⅰ | 向该溶液中加酸性高锰酸钾溶液 | 紫色褪去 |
| Ⅱ | 向该溶液中加氯化钡溶液 | 产生难溶于水的沉淀 |
A.若溶液中有SO ,则有Fe2+ ,则有Fe2+ | B.溶液中可能有Fe3+ |
C.若溶液中有SO ,则一定有Fe3+ ,则一定有Fe3+ | D.SO 、SO 、SO 可能同时存在于溶液中 可能同时存在于溶液中 |
您最近一年使用:0次
4 . 下列离子检验说法正确的是
A.某溶液中滴加Ba(NO3)2溶液产生白色沉淀,该溶液中有SO |
B.某溶液中滴加HNO3溶液产生气体,该溶液中一定有CO |
| C.某溶液中滴加酸性KMnO4溶液,酸性KMnO4溶液褪色,该溶液一定有Fe2+ |
| D.某溶液中滴加KSCN溶液,溶液变为红色,该溶液中一定有Fe3+ |
您最近一年使用:0次
名校
解题方法
5 . 为了检验某溶液中是否含有硫酸根离子,下列操作最合理的是
| A.先加硝酸钡溶液产生白色沉淀,再加盐酸,白色沉淀不溶解则原溶液中含有硫酸根 |
| B.先加硝酸钡溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解则原溶液中含有硫酸根 |
| C.先用盐酸酸化无明显现象,再加氯化钡溶液,若有白色沉淀则原溶液中含有硫酸根 |
| D.先用硝酸酸化无明显现象,再加氯化钡溶液,若有白色沉淀则原溶液中含有硫酸根 |
您最近一年使用:0次
2021-04-08更新
|
244次组卷
|
3卷引用:重庆市巴蜀中学2020-2021学年高一3月月考化学试题
重庆市巴蜀中学2020-2021学年高一3月月考化学试题黑龙江省漠河市高级中学2021-2022学年高一上学期第一次月考化学试题(已下线)期中01-2020-2021学年高一化学章末集训必刷卷(人教版2019必修第二册)
名校
6 . 下列溶液加热蒸干后,能析出溶质固体的是
| A.AlCl3 | B.KHCO3 | C.Fe2(SO4)3 | D.Na2SO3 |
您最近一年使用:0次
名校
解题方法
7 . 下列实验操作和现象、结论或目的均正确的是
| 选项 | 操作和现象 | 结论或目的 |
| A | 向某溶液中滴加盐酸,再加Ba(NO3)2溶液,有白色沉淀生成 | 原溶液中一定含有SO |
| B | CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液,溶液不显红色 | 黑色固体中可能含有Fe3O4 |
| C | 用托盘天平称取1.0g NaOH固体,在烧杯中加少量蒸馏水溶解,转移至250mL容量瓶中定容 | 配制250mL 0.1nol/L的NaOH溶液 |
| D | 用 pH 试纸分别测定等浓度的 NaClO 和NaHCO3溶液的 pH,pH:NaClO> NaHCO3 | 碱性:NaClO> NaHCO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5,装置Ⅲ中有Na2S2O5黄色晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。

(1)装置Ⅰ中盛放浓硫酸的仪器名称为_____ ;装置Ⅰ中产生气体的化学方程式为______ 。
(2)装置Ⅱ的作用之一是观察SO2的生成速率,盛装的试剂为_____ 。
(3)要从装置Ⅲ中获得已析出的晶体,可采取的分离方法是_____ 。
实验二 焦亚硫酸钠的性质:Na2S2O5溶于水即生成NaHSO3
(4)证明NaHSO3溶液中 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是_____ (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是_______ 。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时化学方程式为:SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为_______ g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果______ (填“偏高”“偏低”或“不变”)。
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5,装置Ⅲ中有Na2S2O5黄色晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。

(1)装置Ⅰ中盛放浓硫酸的仪器名称为
(2)装置Ⅱ的作用之一是观察SO2的生成速率,盛装的试剂为
(3)要从装置Ⅲ中获得已析出的晶体,可采取的分离方法是
实验二 焦亚硫酸钠的性质:Na2S2O5溶于水即生成NaHSO3
(4)证明NaHSO3溶液中
 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时化学方程式为:SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
②在上述实验过程中,若有部分HI被空气氧化,则测得结果
您最近一年使用:0次
2020-09-21更新
|
458次组卷
|
2卷引用:重庆实验中学2021届高三第一学月测试化学试题



